抑郁症作为一种全球性高致残性精神疾病,当前治疗面临两大核心瓶颈:一是药物因血脑屏障阻隔难以有效入脑,导致起效延迟、效率低下;二是全身给药方式易引发不良反应,且复发率高。
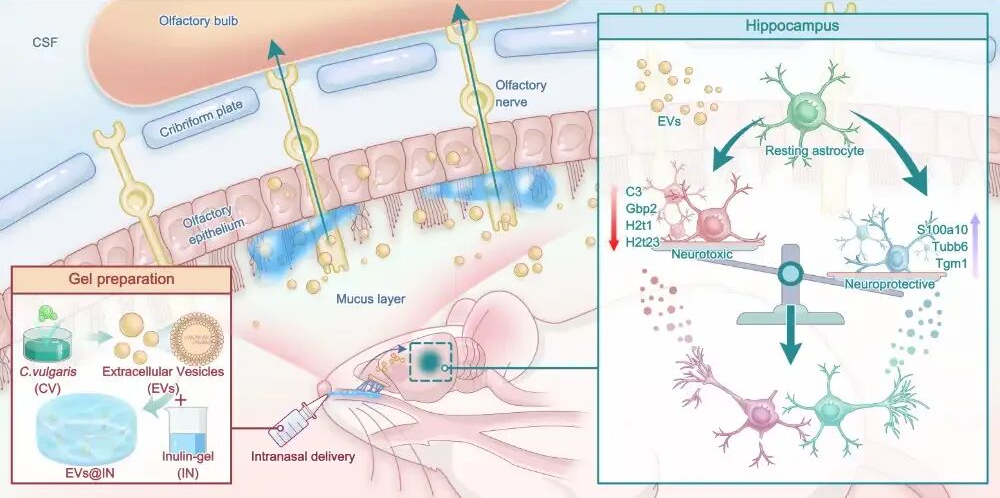
细胞外囊泡(EVs)是天然的细胞间通讯载体,能传递生物活性分子。相比难以规模化生产的人源EVs,植物源EVs更具应用潜力,其中小球藻来源EVs因其抗炎、抗氧化及改善能量代谢等功能,并能缓解抑郁相关症状,成为极具前景的天然治疗载体。
近期,浙江大学周民/路静团队在在国际期刊Journal of Extracellular Vesicles上发表了其研究成果Nose-to-Brain Delivery of Chlorella Vulgaris Extracellular Vesicles for Antidepressant Effects。该研究成功开发了一种名为EVs@IN的新型鼻脑递送系统,通过将细胞外囊泡(EVs)与菊粉(IN)凝胶相结合,以解决药物鼻腔滞留时间短与入脑效率低的难题,为开发快速起效、低副作用的抗抑郁新策略提供全新解决方案。

论文第一作者为浙江大学博士生金康裕、王若溪和硕士生陈冰,浙江大学周民教授和浙江大学医学院附属第一医院路静研究员为论文的通讯作者。
为解决鼻腔滞留时间短的问题,研究成功开发了一种基于菊粉水凝胶的鼻腔递送系统(EVs@IN)。形态学分析显示EVs(可流动液体)、IN(非流动凝胶)与EVs@IN(半流动,倒置试管保形)的特征转变,证实EVs物理嵌入凝胶基质(图1f);傅里叶变换红外光谱(FTIR)验证了封装过程中凝胶基质结构的完整性(图1g);Zeta电位分析表明EVs@IN表面负电荷部分被掩蔽但仍保持适中电位(图1h)。EVs@IN具备了理想的鼻用制剂性能:在室温下呈半流动状态便于给药,在鼻腔环境中转为弹性凝胶实现长效滞留(图1i),且具有剪切变稀特性确保给药顺畅(图1j);兼顾给药便利性,解决鼻用制剂长效性与实用性的核心矛盾。

图1 EVs@IN的制备与结构表征

图2 鼻内给药后EVs@IN的体内分布与滞留情况
为明确EVs转运机制,免疫荧光检测发现,PKH26标记的EVs与小胶质细胞、星胶细胞及神经元三种细胞标志物均存在共定位(图3c-k),这表明神经元及多种神经胶质细胞均能摄取EVs。综上,EVs经鼻给药后可通过嗅觉神经环路穿透血脑屏障进入CNS,并与脑内多种脑细胞发生靶向相互作用。
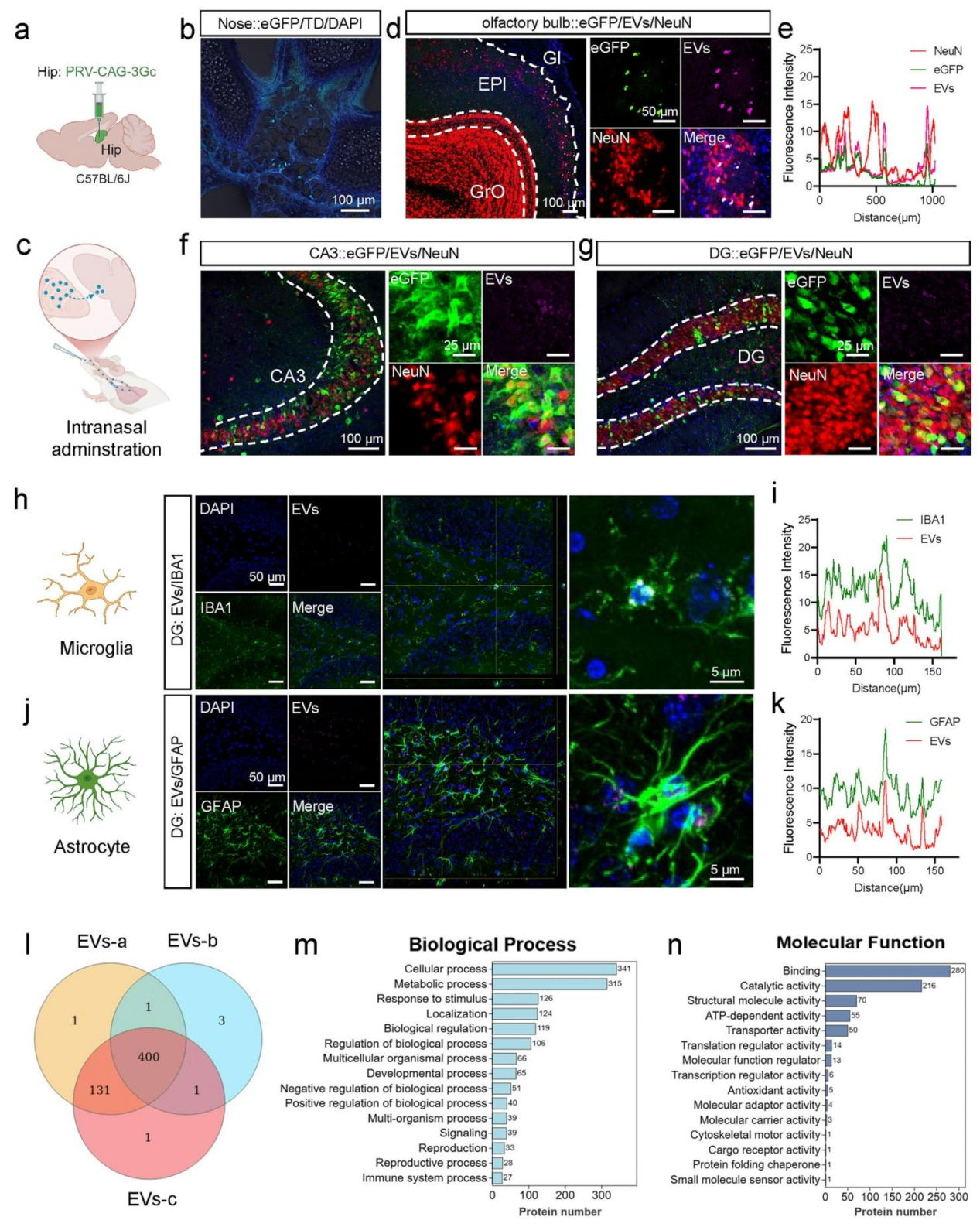
图3 EVs经鼻给药可直接进入大脑并作用于不同神经胶质细胞或神经元
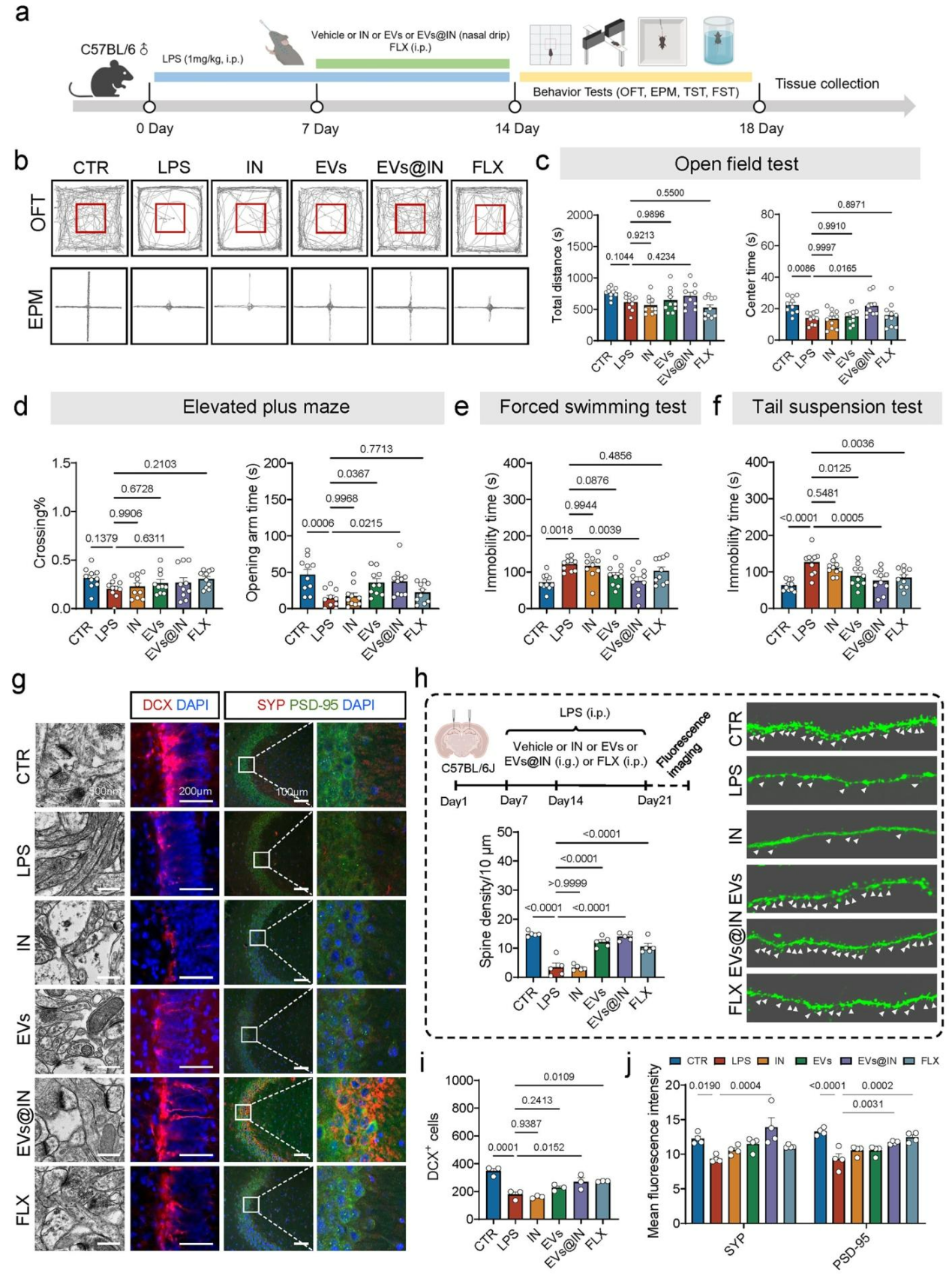
图4 EVs@IN缓解LPS诱导的抑郁样和焦虑样行为
为探究EVs@IN缓解抑郁样/焦虑样行为的机制,对海马体组织进行RNA测序显示,与LPS组相比,EVs@IN组存在41个差异基因(图5a),Reactome分析提示差异基因富集于突触功能、能量代谢及补体激活通路(含补体C3/C5,图5b)。鉴于补体C3的异常激活是神经疾病的关键因素。研究发现,EVs及EVs@IN能显著下调神经毒性星形胶质细胞标志物C3与Gbp2,而不影响诱导因子C1qa和神经保护标志物S100a10的表达,提示其具有特异性抑制神经毒性的潜力(图5c),这证实EVs@IN通过精准调控补体C3抑制神经毒性星形胶质细胞活化。综上,EVs@IN改善神经可塑性与调控补体系统的双重作用机制,缓解抑郁样和焦虑样行为。
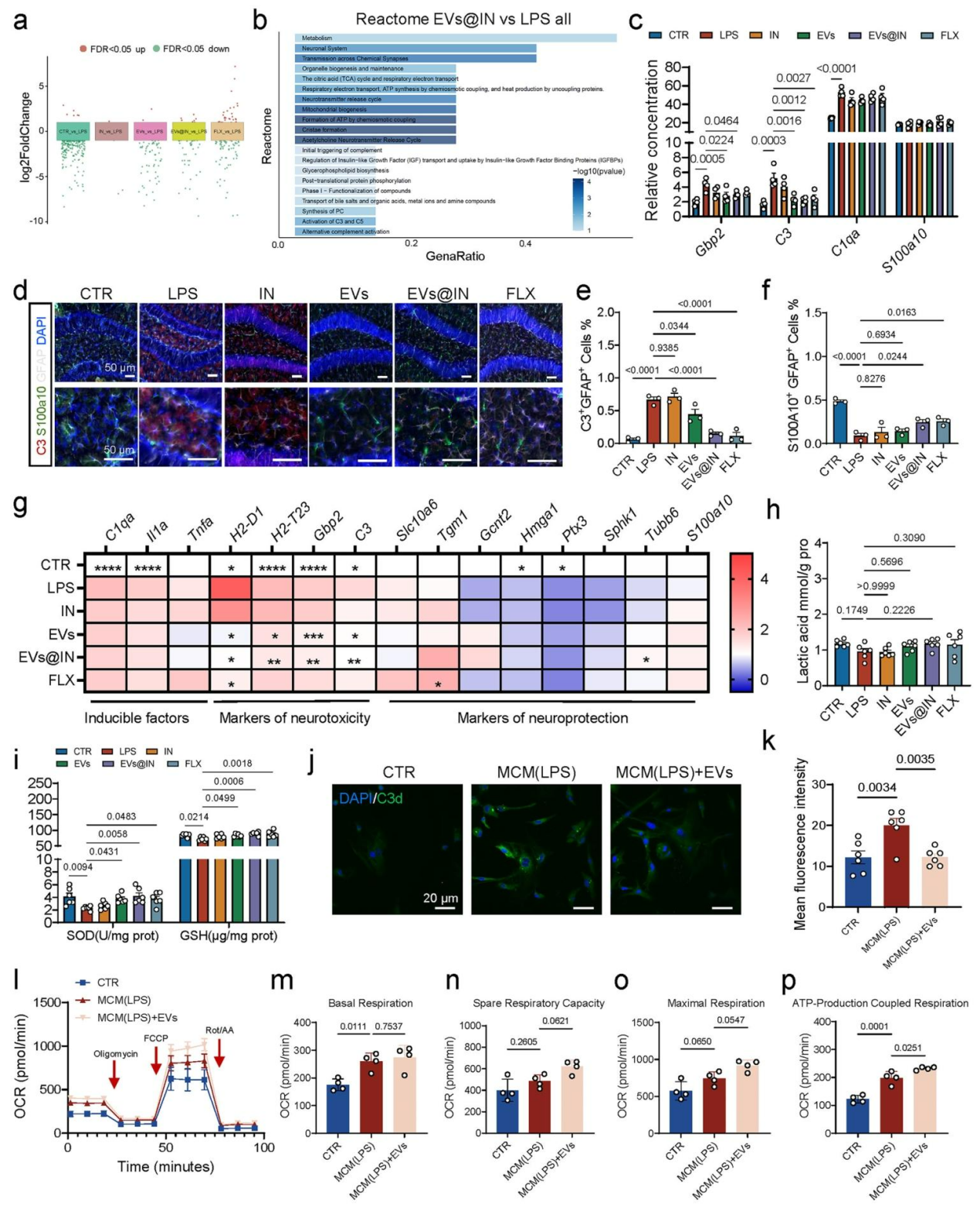
图5 EVs@IN参与调控星形胶质细胞亚型及关键补体系统功能
过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC-1α)是线粒体生物发生和氧化代谢的关键调控因子,可激活核因子erythroid2相关因子2(Nrf2)以减少活性氧生成,保护神经免受损伤。为探究氧化应激缓解机制,qPCR分析显示,LPS处理显著抑制Ppargc1a和Nfe2l2基因表达,而EVs@IN能有效逆转这一趋势。体外实验证实,EVs能显著增强星形胶质细胞的ATP生成偶联呼吸(图5l-p)并提升HT22神经元细胞的备用呼吸能力(图6a-f)。这表明EVs@IN通过激活PGC-1α-Nrf2通路缓解氧化应激,并调控星形胶质细胞表型转化。为进一步验证EVs@IN的抗抑郁效应,构建慢性不可预测温和应激CUMS模型。与此前结果一致,鼻内给予EVs@IN1周后,可显著逆转CUMS诱导的焦虑样和抑郁样行为(图6g-l)。
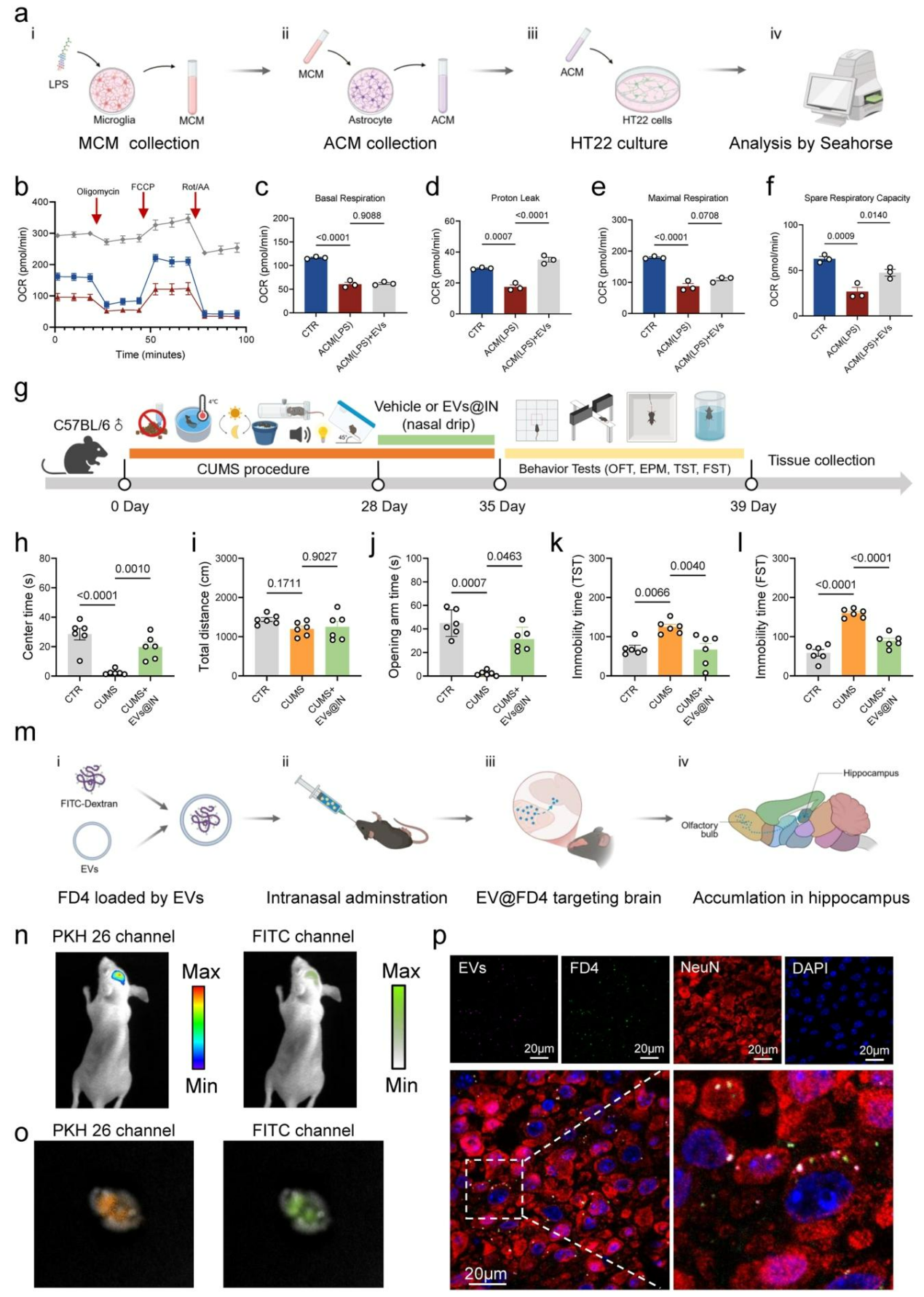
图6 EVs可作为鼻脑递送的药物载体
本文使用的工具病毒布林凯斯均可提供:

同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。