吗啡等阿片类药物会引发过度活跃的神经行为效应,在啮齿动物模型中尤为显著,但背后的神经回路和分子机制长期不明确。未定带(ZI)脑区85%以上为GABA能神经元,参与疼痛调节、运动控制等多种生理过程,且表达μ、δ、κ三种阿片受体(MOR、DOR、KOR)。已有解剖学证据表明扣带回皮质可直接投射到ZI。
2025年12月1日,浙江大学医学院李晓明教授、严敏教授、复旦大学李玥研究员和浙江大学黄慧倩副研究员团队合作在Advanced Science上发表题为“Delta Opioid Receptors within the Cortico-Thalamic Circuitry Underlie Hyperactivity Induced by High-Dose Morphine”的研究论文,首次揭示扣带回皮质(Cg)向未定带中间吻尾区(ZIm)的谷氨酸能投射是高剂量吗啡引起运动亢进的关键神经环路,并发现该效应由未定带内δ阿片受体(DOR)介导,为阿片类药物副作用的精准干预提供了新靶点。

本文第一作者为浙江大学医学院李春悦博士(现任职于复旦大学附属华山医院),通讯作者为浙江大学医学院李晓明教授、严敏教授、复旦大学李玥研究员、浙江大学黄慧倩副研究员。同时该研究得到了复旦大学王以政院士、上海交通大学袁逖飞教授的大力支持,以及国家自然科学基金、科技创新2030重大项目等支持。
为了阐明Cg与ZI的突触连接,研究向Vglut2-Cre小鼠Cg单侧注射顺行性非跨突触示踪剂AAV9-DIO-mGFP-Synaptophysin-mRuby,观察到阳性轴突终末主要定位于ZIm(图1A-B)。mGFP-Synaptophysin-mRuby轴突终末与ZIm内GABA和谷氨酸的共定位情况,结果显示ZIm中约50%的GABA能神经元与上述轴突终末存在共定位,而谷氨酸能神经元的共定位比例仅为20%左右。为了验证该连接,向WT小鼠Cg注射AAV2/1-Cre,同侧ZIm注射AAV9-DIO-mCherry。三重原位杂交显示,ZIm中50% DsRed mRNA(检测mCherry mRNA)阳性神经元与gad2 mRNA重叠,仅1%与vglut2 mRNA重叠(图1C)。定量分析表明,ZIm内gad2+神经元占86.4%,vglut2+神经元仅9.5%(图1D-E),与既往研究一致,提示Cg谷氨酸能输入主要靶向ZIm的GABA能神经元,形成自上而下的抑制性调控回路。进一步向Gad2-Cre和Vglut2-Cre小鼠ZIm注射辅助病毒混合物AAV-DIO-N2cG与AAV-DIO-EGFP-T2A-TVA,两周后注射CVS-EnvA-AG-ldTomato,免疫组化染色显示Gad2-Cre小鼠Cg中58.14%标记神经元为谷氨酸阳性,Vglut2-Cre小鼠Cg中51.31%为谷氨酸阳性。综上,Cg的谷氨酸能神经元向ZIm形成密集投射,且优先靶向GABA能神经元。
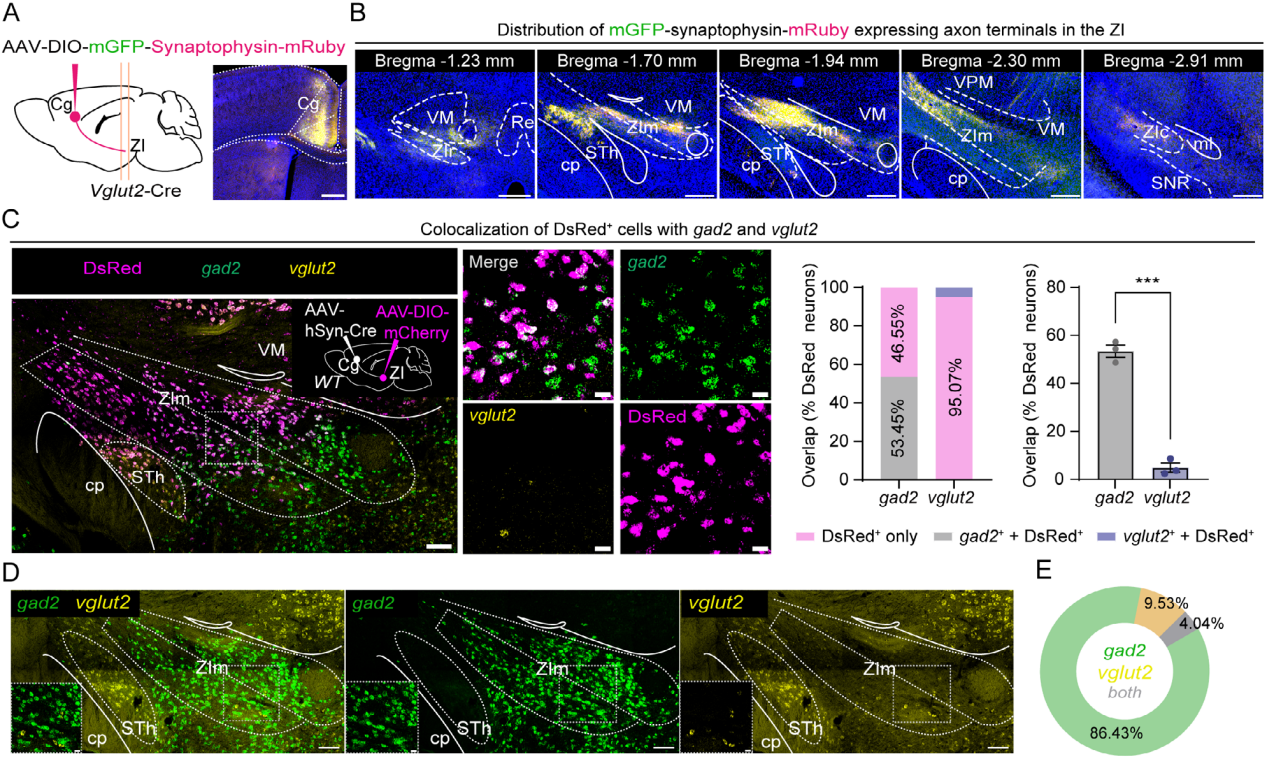
图1 Cg谷氨酸能神经元与ZIm神经元形成突触连接
为了探究吗啡对Cg-ZIm通路的影响,向小鼠腹腔注射吗啡(15 mg/kg)或生理盐水。检测显示,吗啡处理后Cg和ZIm的c-Fos表达量显著高于生理盐水对照组(图2A-D),其他与吗啡相关的脑区也出现c-Fos升高。为了验证c-Fos升高是否关联神经元活性增强,在WT小鼠中通过两种方式表达GCaMP7b以记录通路群体活性:①向ZIm注射rAAV2-Retro-Cre,同侧Cg注射AAV9-DIO-GCaMP7b(图2E);②向Cg注射AAV1-Cre,同侧ZIm注射AAV9-DIO-GCaMP7b(图2K),结果显示吗啡组较生理盐水组显著增强Cg-ZIm通路神经元活性(图2F、G、L、M),且提升小鼠自发运动活性(图2H、N),钙信号升高与小鼠运动速度呈显著正相关(图2I、J、O、P)。上述数据表明,Cg-ZIm通路参与吗啡诱导的过度活跃。
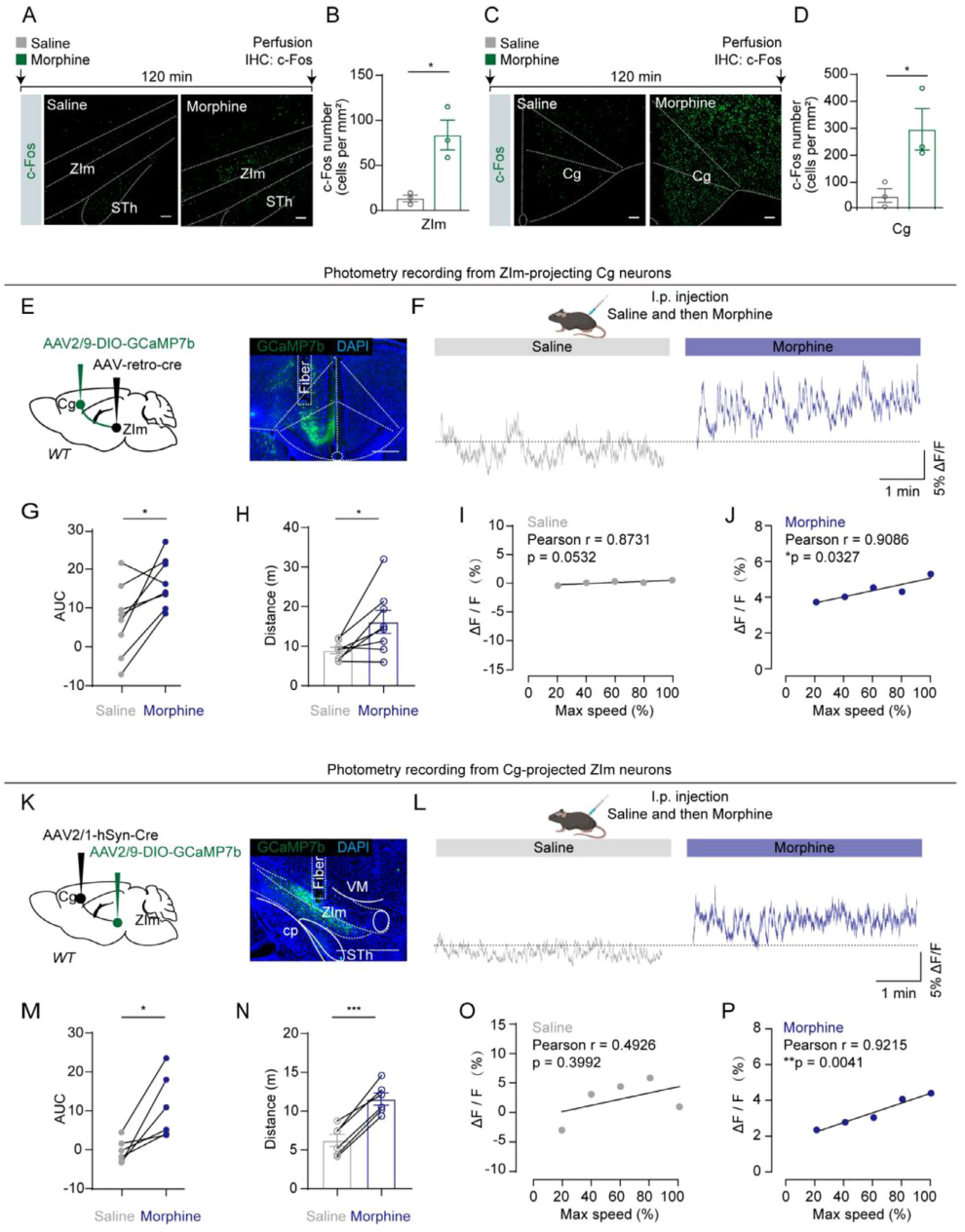
图2 Cg-ZIm通路参与吗啡诱导的运动亢进
为了评估Cg-ZIm通路在急性吗啡诱导过度运动中的作用,旷场实验(OFT)中通过双侧ZIm注射rAAV2-Retro-Cre、双侧Cg注射AAV9-DIO-hM4Di-mCherry。腹腔注射CNO(4 mg/kg)30分钟后给予吗啡,观察10分钟(图3A)。结果显示,CNO可有效抑制Cg中hM4Di-mCherry+神经元(图3B-C),且抑制投射至ZIm的Cg神经元后,吗啡诱导的旷场运动距离显著减少,但单独抑制不影响小鼠基础运动能力(图3D-E)。化学遗传选择性抑制接受Cg投射的ZIm神经元,结果吗啡诱导的运动距离显著减少;向Gad2-Cre小鼠双侧ZIm注射AAV9-DIO-hM4Di-mCherry,化学遗传学抑制该类神经元后,吗啡诱导的过度运动显著减弱。
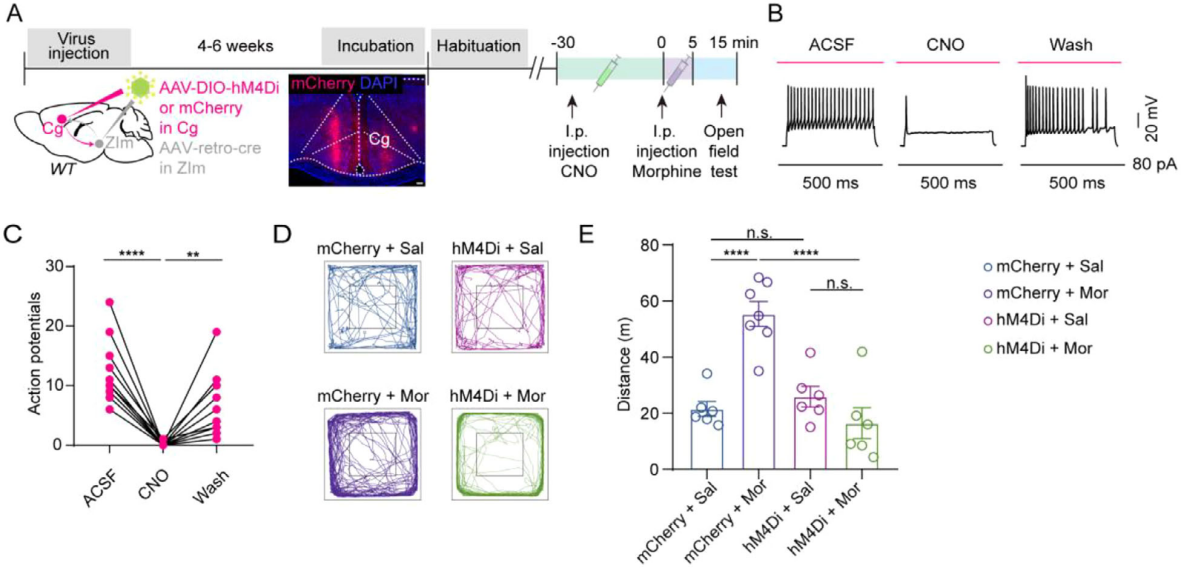
图3 化学遗传学抑制Cg-ZIm通路可减轻急性吗啡高活动性
慢性吗啡给药可诱导行为敏化、成瘾及依赖等适应性行为。为明确Cg-ZIm通路在慢性吗啡作用中的作用,WT小鼠每日注射吗啡(剂量10-50mg/kg递增)前30分钟,化学遗传学抑制投射至ZIm的Cg神经元(图4A)。结果显示,该抑制可减弱吗啡诱导的过度运动(图4C),且不影响小鼠体重(图4B)、吗啡奖赏效应(图4D)、戒断症状(图4E、F)及镇痛效果(图4G),表明Cg-ZIm通路特异性调控吗啡诱导的过度运动。综上,Cg-ZIm通路的内源性活性对急性和慢性吗啡诱导的过度运动均有特异性调控作用。Cg区谷氨酸能神经元-ZIm区GABA能神经元(CgGlu-ZImGABA)通路是介导吗啡诱导过度运动的核心功能回路。
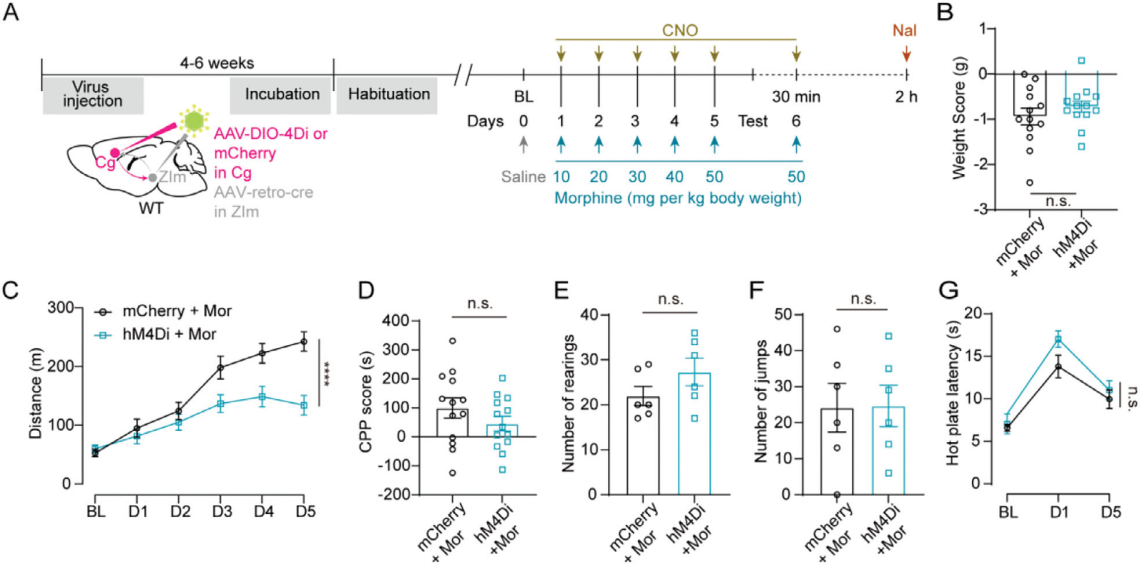
图4 化学遗传学抑制Cg-ZIm通路可选择性减轻慢性吗啡高活动性
为了探究Cg-ZIm通路的运动调控作用,向WT小鼠双侧Cg注射AAV9-ChR2-mCherry,并在ZIm区阳性轴突终末照射蓝光以激活通路(图5A、C)。急性脑切片实验中,光脉冲(20Hz、5ms、6-8mW)可稳定诱发ChR2-mCherry阳性Cg神经元产生动作电位(图5B)。旷场实验显示,光遗传学激活Cg-ZIm通路,可显著提高小鼠运动速度和总运动距离(图5E-F)。进一步探究显示向双侧Cg注射AAV1-Cre、双侧ZIm注射AAV9-DIO-ChR2-mCherry(图5G-H),或向双侧ZIm注射rAAV2-Retro-Cre、双侧Cg注射AAV9-DIO-ChR2-mCherry(图5J-K),分别激活Cg-ZIm通路的突触前或突触后神经元,均能增加小鼠旷场运动能力(图5I、L)。作为对照,光遗传学激活初级运动皮层(M1/M2)向ZIm的投射,对小鼠运动行为无显著影响(图5M-O)。综上,激活Cg-ZIm通路可诱发WT小鼠过度运动。
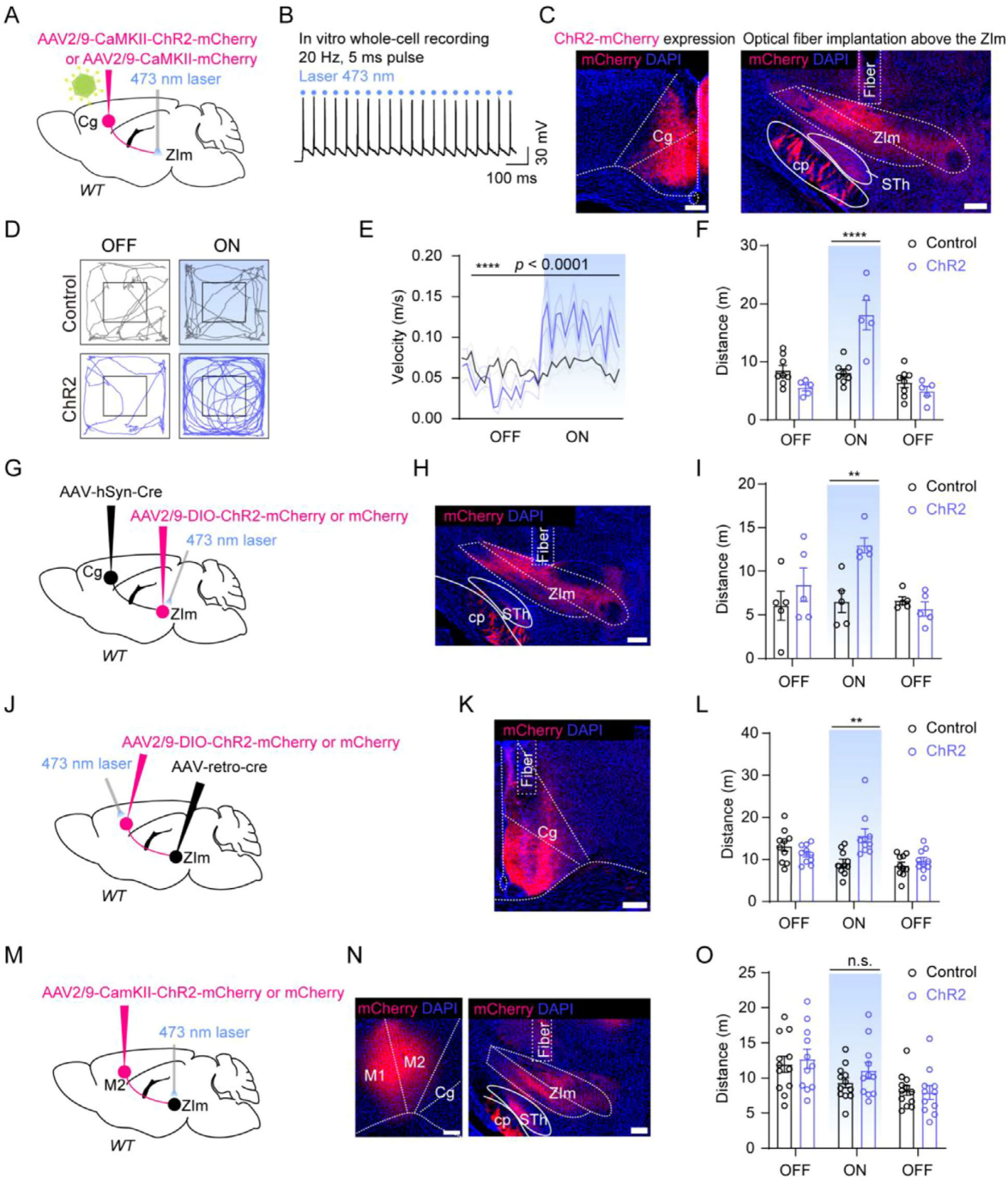
图5 Cg–ZIm通路的激活模拟了吗啡注射的效果
已知ZI存在三种阿片受体 ,为探究功能向Cg注射AAV1-Cre、同侧ZIm注射AAV9-DIO-mCherry(图6A),原位杂交与免疫荧光染色显示:约30.3%的DsRed阳性细胞表达DOR编码基因Oprd1(图6B-C),54.1%表达MOR编码基因oprm1,21.3%表达KOR编码基因oprk1。高剂量吗啡(15 mg/kg)下,DOR拮抗剂(ICI174864)和化学遗传学抑制Cg-ZIm通路均产生显著行为学效应(图6D-F)。吗啡激活的ZIm区c-Fos阳性神经元中47.9%表达Oprd1,ZIm区Oprd1阳性神经元中36.6%被吗啡激活(图6G-H),且与MOR、KOR的重叠比例更低,证实ZIm区DOR的核心介导作用。
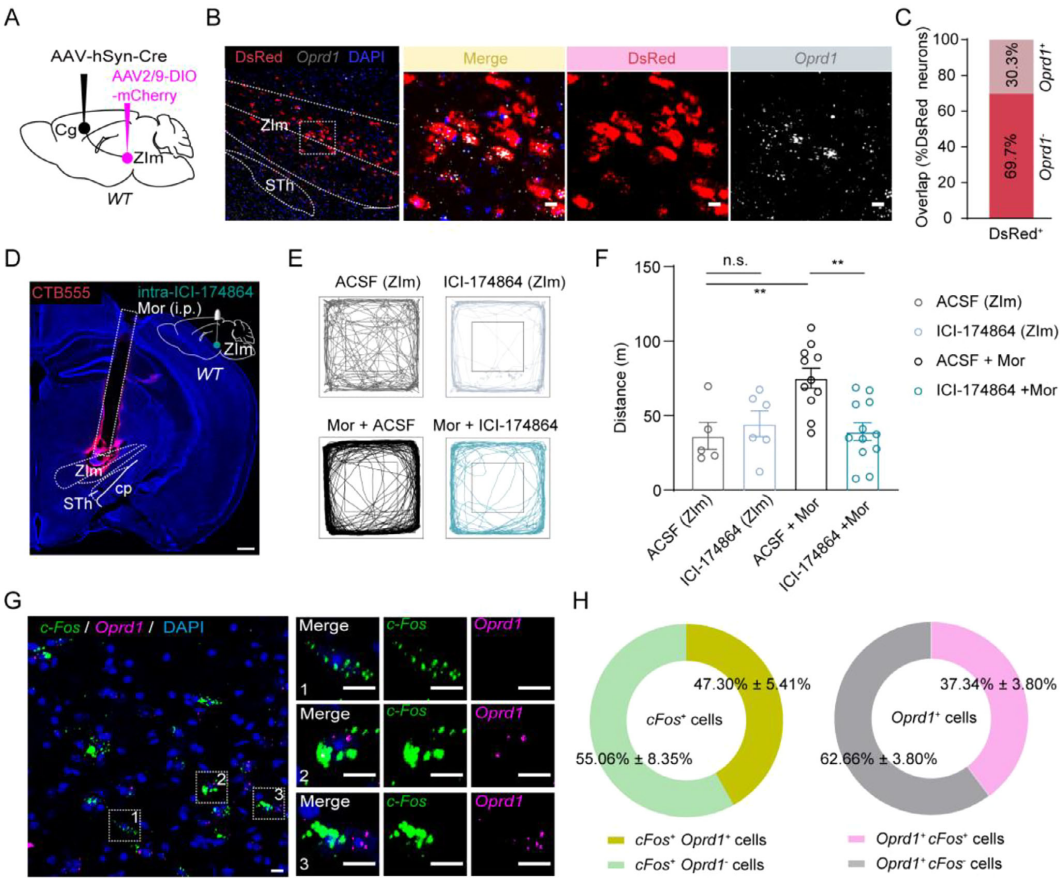
图6 DOR拮抗剂可预防高剂量吗啡诱导的过度活动
为了证实DOR拮抗剂的作用靶点,向Cg注射 AAV1-Cre、ZIm 注射 AAV5-DIO-DOR-shRNA-EGFP,特异性敲低接受Cg投射的ZIm神经元的DOR(图7A-D)。行为学实验显示,敲低后DOR拮抗剂无法再减弱吗啡诱导的过度运动(图7E-G),表明接受Cg投射的ZIm神经元上的DOR是吗啡诱导过度运动的关键介导因子。
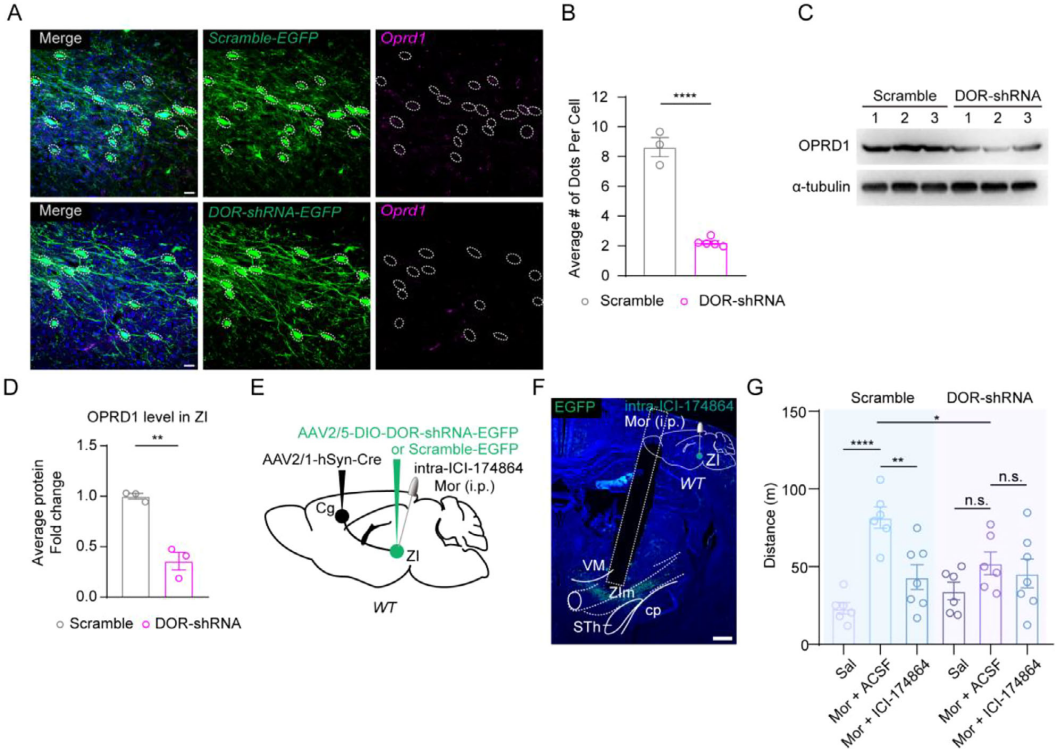
图7 敲低DOR可有效阻断ICI174864对高剂量吗啡诱导的过度运动所产生的抑制作用
本研究明确了Cg-ZIm兴奋性通路和ZIm区突触后DOR是调控高剂量吗啡诱导过度活跃的核心回路与关键分子,揭示了吗啡精神运动效应的特异性调控机制。该发现对优化吗啡临床应用、解决阿片类药物相关神经适应问题具有重要价值。
本文使用的工具病毒布林凯斯均可提供:
同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。