老年群体及神经系统疾病患者易出现认知障碍,麻醉/手术诱导的POCD(术后认知功能障碍)是高发术后并发症,术后几周发病率10%–54%,可增加远期健康风险及社会家庭负担,但POCD发病机制尚未明确。肝脏是血液蛋白主要来源,其分泌的血液蛋白可通过外周-中枢通讯调控大脑功能,这类蛋白失衡与认知障碍相关,但麻醉/手术影响的关键外周调控蛋白及来源器官尚不明确。补体C3作为核心免疫因子,脑内源性C3过度激活参与AD病理,而外周C3对中枢认知功能的影响仍不清楚。
2025年11月12日,同济大学熊利泽、黄新伟团队联合北京大学王东信团队在Advanced Science发表题为Inhibiting Liver-Derived C3 Protein Rescues Anesthesia/Surgery-Induced Cognitive Impairment, Synaptic Disorders, and Microglial Phagocytosis的研究论文。本研究通过人类样本与POCD模型小鼠的多器官蛋白组学、转录组学分析,筛选麻醉/手术诱导认知障碍的外周靶点。麻醉/手术诱发肝脏C3启动子低甲基化促使肝源C3上调并释放带到血液,通过受损的血脑屏障进入海马,激活C3aR和小胶质细胞吞噬作用,导致突触损伤与认知障碍。功能实验证实,抑制肝脏C3可逆转上述病理过程与认知损伤,临床数据也表明围手术期血清C3水平与POCD发生密切相关。

为明确手术创伤引发的肝脏和血浆蛋白质组变化,研究以18月龄小鼠为对象(对照组与手术组各6只),对配对肝脏和血浆样本开展蛋白质组检测(图1a)。结果显示,两组小鼠肝脏(图1b)和血浆(图1f)蛋白质谱经无监督聚类均呈现显著分离,分别鉴定出157种(图1c)和212种(图1g)差异蛋白质。WGCNA分析表明,肝脏棕色模块(相关系数=0.92,P<1E-200)和血浆绿松石模块(相关系数=0.99,P<1E-200)与手术关联性最强,各自包含对应下调和上调差异蛋白质,且这些蛋白与手术组及所属模块高度相关(|相关系数|>0.90,P<1E-05)(图1d、1e、1h、1i)。进一步筛选出C3、HP、ITIH4和SAA1 4种在肝脏和血浆中均上调的蛋白质,它们与手术组呈一致正相关(图1j)。结合HPA和GTEx数据库分析证实,肝脏是这4种蛋白质的主要来源器官(图1k)。HP、ITIH4和SAA1作为主要的急性期生物标志物蛋白质,可能对脑损伤等创伤性刺激快速上调,因此其在手术创伤后肝脏和血液中的上调符合预期。综上,本研究首次描绘了老年小鼠手术创伤后肝脏和血液的蛋白质组特征,并确定C3、HP、ITIH4和SAA1这4种肝脏来源的血液蛋白质对手术创伤存在强烈应答。
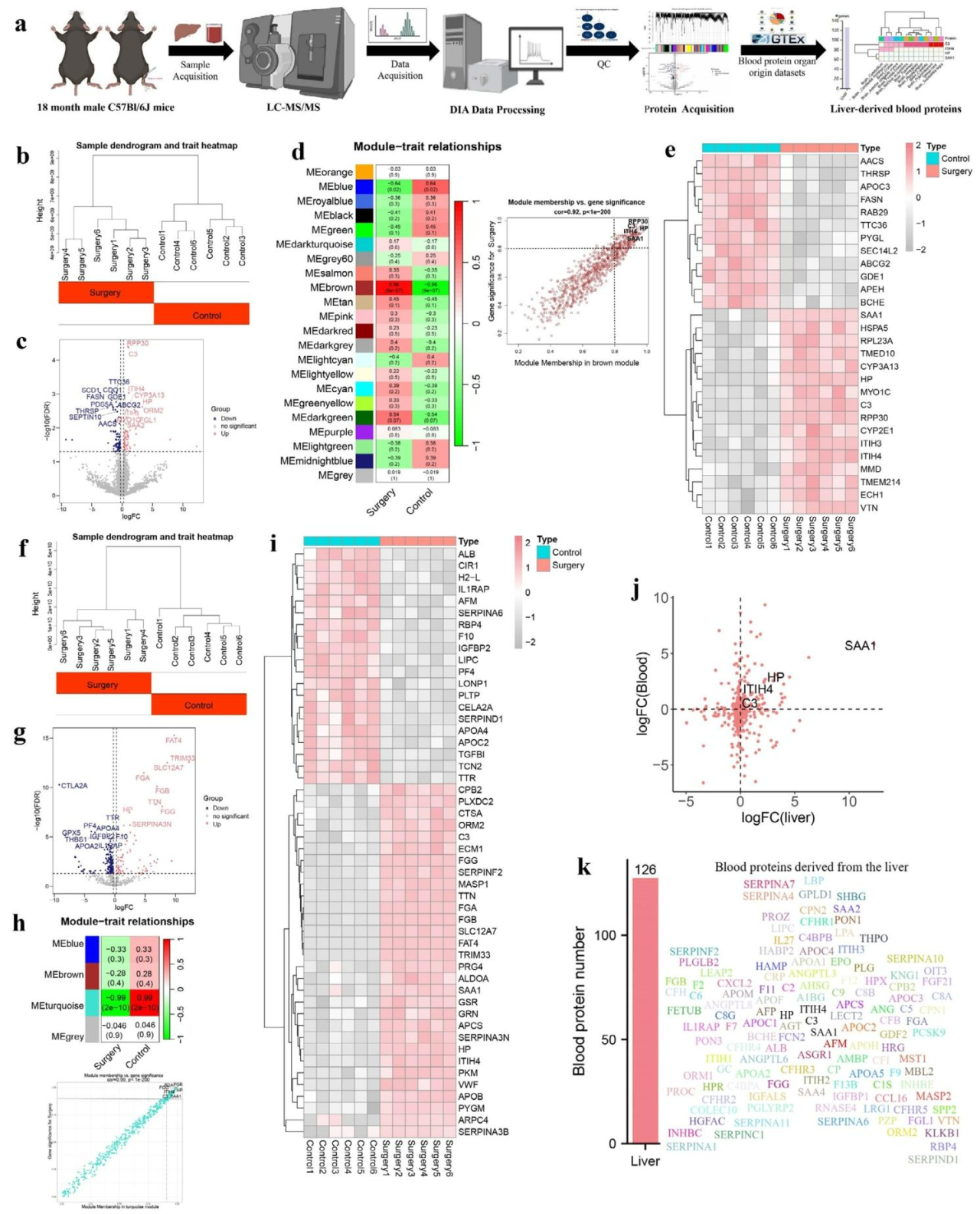
图1 鉴定老年小鼠中受麻醉/手术干扰的肝脏来源血液蛋白质
尽管已有研究报道AD患者脑内C3升高并参与突触和神经元丢失及认知障碍,但外周C3是否参与认知障碍及其相关病理过程尚不明确。为明确麻醉/手术后哪些器官的C3水平发生变化,本研究采用剖腹术和胫骨骨折内固定术两种POCD模型(图2a)检测小鼠多器官C3 mRNA及蛋白质水平,结果显示,麻醉/手术1天后,肝脏、血清和脑内C3蛋白水平显著升高,其他外周器官无明显变化,且qPCR结果中仅肝脏C3mRNA同步上调(图2b-e)。这提示海马区C3蛋白质的改变很可能来源于外周。免疫荧光染色表明,手术1天后,多个脑区C3水平升高,CA1区最为显著;此外海马区星形胶质细胞、小胶质细胞和神经元的C3荧光强度均增加(图2f-h)。为明确肝脏、血清和海马区C3变化的因果关系,检测麻醉/手术多个时间点的C3变化轨迹;Westernblot结果显示,手术组小鼠肝脏C3蛋白水平在1h、3h、6h、1天和3天显著高于对照组,7天恢复正常,血清C3变化趋势一致(图2i-l、2m),且肝脏C3 mRNA在术后1天、3天显著上调并于7天恢复(图2e)。这提示血清与海马区C3变化可能主要源于肝脏。结合既往麻醉/手术可通过启动子甲基化调控转录的研究,表明麻醉/手术诱导的肝脏C3上调可能与基因启动子低甲基化相关。
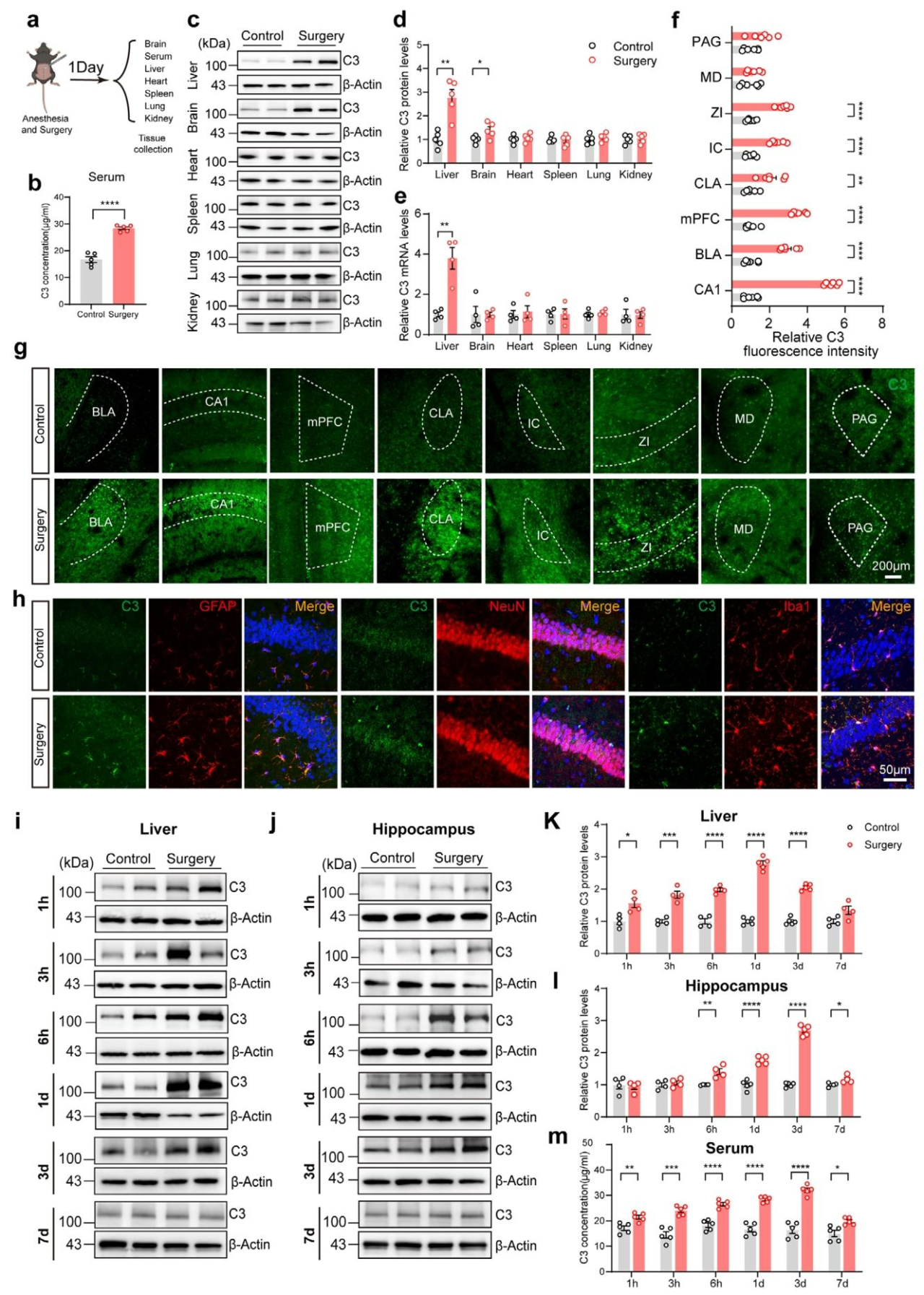
图2 麻醉/手术升高老年小鼠肝脏、血液和脑内的C3蛋白质水平
血脑屏障(BBB)作为阻止血液来源物质进入脑内的天然屏障,其破坏与认知障碍相关。本研究通过透射电子显微镜(TEM)观察发现,麻醉/手术可导致老年小鼠海马区BBB结构不连续,紧密连接(TJs)呈时间依赖性损伤(6h出现损伤、3天最严重、7天开始恢复)(图3a,b),且Westernblot验证海马区TJ关键蛋白(ZO-1、Occludin)在术后1天表达下降50%,证实BBB被破坏(图3c-e)。为验证BBB受损时外周C3能否入脑,将生物素标记的重组C3(≈0.45kDa)尾静脉注射至WT和C3-/-小鼠,分为麻醉/手术组和非麻醉/手术组(图3f)。免疫荧光及WB结果显示,仅手术组皮质、海马区检测到重组C3,非手术组无阳性信号(图3f-i)。进一步采用iSLET系统——一种通过内质网锚定邻近生物素化实现肝脏特异性分泌蛋白标记的验证技术,通过尾静脉注射表达Sec61β-TurboID的AAV病毒,随后进行生物素处理标记肝脏分泌蛋白(图3j),证实肝脏分泌蛋白被有效生物素化且存在于血液中(图3k)。免疫沉淀结果显示,手术组肝脏来源的生物素化C3升高,且仅在手术组海马区检测到该蛋白(图3l,m)。综上,这些发现表明,仅当BBB受损时,大量外周C3才会进入中枢神经系统(CNS)。麻醉/手术不仅诱导BBB破裂,还导致血液中肝脏来源的C3蛋白质升高,这两种手术干预的双重作用最终促进C3进入脑内。
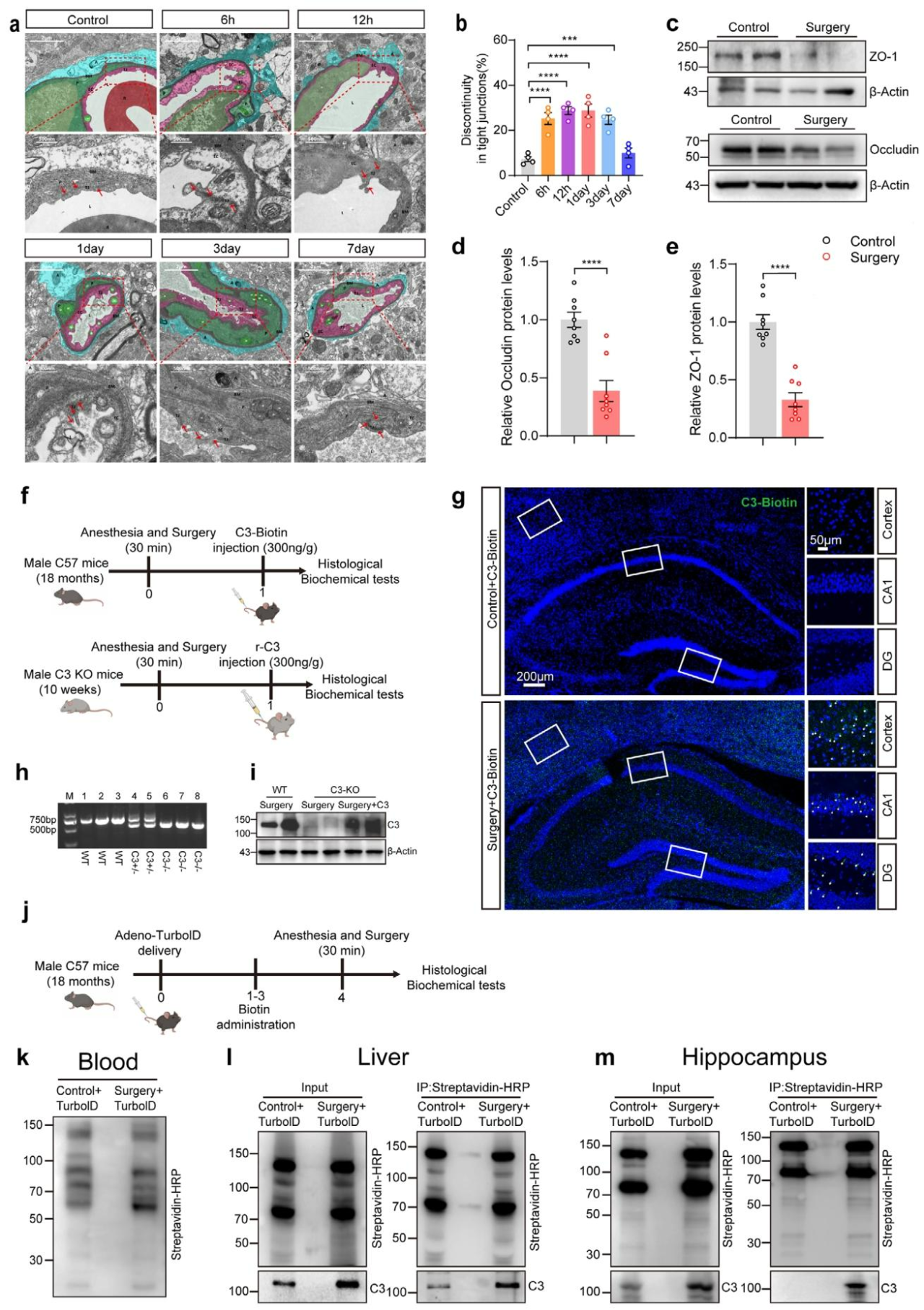
图3 外周C3在麻醉/手术诱导血脑屏障破坏的前提下进入脑内
为明确肝脏来源C3对中枢神经系统(CNS)C3水平的调控作用,本研究首先采用Albumin-CreERT2:C3loxp/loxp双转基因小鼠,经7天他莫昔芬注射删除肝脏来源C3(cKO小鼠)(图4a,b)。麻醉/手术1天后,cKO小鼠肝脏、血清及海马区C3水平持续低于WT小鼠,其他外周器官C3水平无受影响(图4c-f)。尾静脉注射重组腺相关病毒rAAV2/8-mCherry-shRNAC3特异性敲低18月龄小鼠肝脏C3(图4g),3周后免疫荧光证实病毒仅特异性转染肝脏(图4h),且显著降低肝脏、血清及海马区C3蛋白水平,仅抑制肝脏C3转录(图4i-l),表明肝脏可调控麻醉/手术后续海马区C3水平。行为学测试显示,旷场试验中四组小鼠无显著差异(图4m-o),而rAAV-shRNAC3注射可减轻巴恩斯迷宫、恐惧条件反射试验(FC)中麻醉/手术诱导的认知障碍(图4p-s),且莫里斯水迷宫(MWM)中该组小鼠认知表现显著优于对照组(图4t-w)。这提示敲低肝脏来源C3可改善麻醉/手术诱导的认知功能损伤,证实其参与该病理过程。
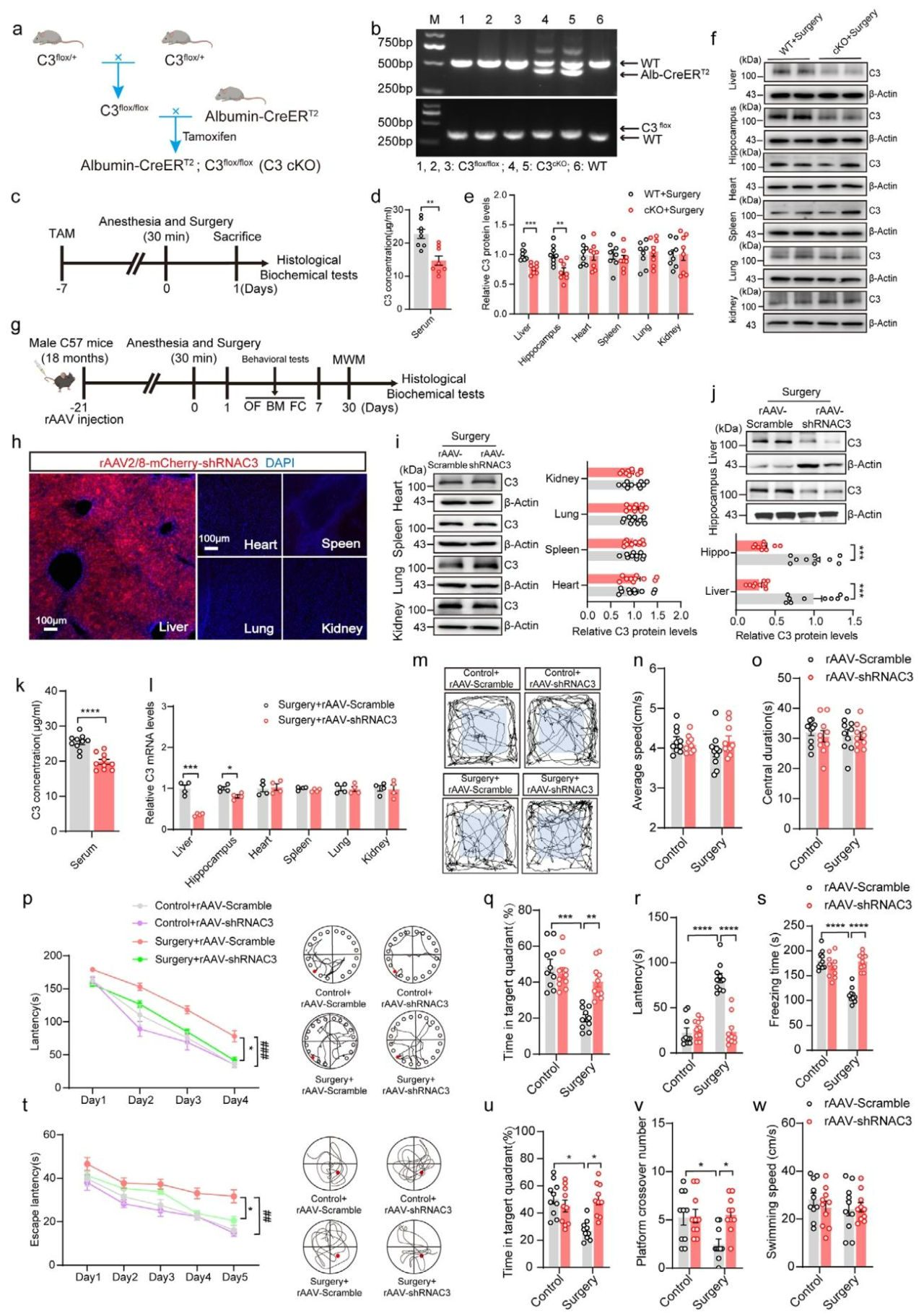
图4 敲低肝脏来源的C3减轻麻醉/手术诱导的认知障碍
突触完整性、活性及可塑性对学习记忆至关重要,已有研究表明脑内C3会破坏树突形态与神经元网络功能,且C3KO小鼠可免受衰老相关的海马区突触丢失和认知衰退影响。据此我们提出假设:麻醉/手术可能通过增加海马区肝脏来源的C3(在BBB受损条件下进入中枢)损伤突触。为验证该假设,本研究采用光纤记录、电生理学及免疫荧光技术,评估四组小鼠海马区突触结构与功能(图5a)。首先在恐惧条件反射试验中追踪海马区在体神经活性,结果显示:注射rAAV-Scramble的手术组小鼠神经元钙活性显著低于对照组,而注射rAAV-shRNAC3的手术组钙活性与对照组相似且显著高于前者(图5b-e)。电生理学检测显示,注射rAAV-Scramble的手术组海马区长时程增强(LTP)诱导与维持能力下降,平均场兴奋性突触后电位(fEPSPs)水平降低,其他三组无此现象(图5f-h)。免疫荧光结果显示,向海马区注射rAAV-CAG-DIO-mCherry靶向标记神经元后,注射rAAV-Scramble的手术组树突棘密度显著低于对照组,而注射rAAV-shRNAC3的手术组树突棘密度较前者升高,突触形态与对照组相近(图5i,j)。上述结果证实:麻醉/手术破坏BBB后,肝脏来源的C3可进入中枢并损伤突触结构与功能,抑制肝脏来源C3可挽救麻醉/手术诱导的神经活性受损、突触完整性破坏及可塑性下降等障碍。
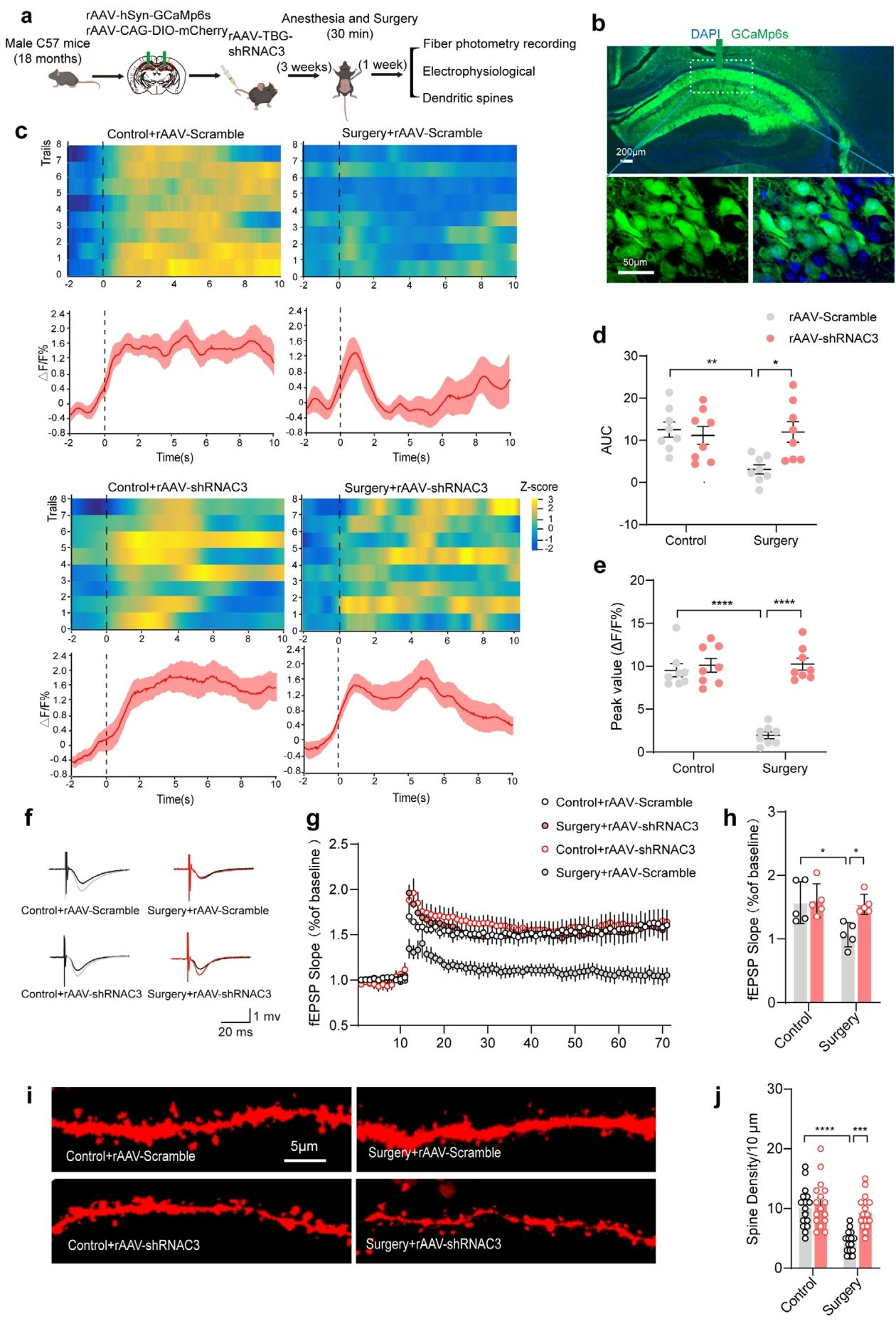
图5 敲低肝脏来源的C3挽救麻醉/手术诱导的突触功能障碍
为明确海马区肝脏来源C3的下游信号对认知功能的影响,本研究对注射rAAV-Scramble和rAAV-shRNAC3的小鼠海马区样本进行scRNA-seq和批量RNA测序,鉴定出小胶质细胞、星形胶质细胞等10种细胞类型,两组细胞比例无显著差异(图6a);但抑制肝脏来源C3可诱导海马区细胞特异性基因表达变化(图6b)。单细胞功能分析显示,干预后小胶质细胞的神经炎症与吞噬通路活性下调,而星形胶质细胞的突触功能与学习记忆通路活性上调(图6c);rAAV-shRNAC3组小胶质细胞的吞噬作用、NIK/NF-κB信号传导等炎症相关活性显著降低(图6d),关键吞噬相关基因C3aR(认知障碍驱动因子)在小胶质细胞、星形胶质细胞及少突胶质前体细胞(OPCs)中下调(图6e),而海马区C3基因仅在极少数小胶质细胞和单核细胞中低水平表达(图6f),且批量测序证实rAAV-shRNAC3组海马区C3aR mRNA水平降低,C3 mRNA及CR3、C5aR无显著变化(图6g)。这提示抑制肝脏来源C3可选择性下调小胶质细胞C3aR表达。结合已有研究,胶质细胞C3减少可抑制C3-C3aR信号介导的胶质细胞激活,预防突触丢失与认知障碍。机制验证显示,麻醉/手术后外周C3与海马区C3aR共定位(图6h),小胶质细胞C3aR上调、CD68+溶酶体增多(吞噬激活)(图6i,l,j,m),且Syn+PSD95+突触密度降低(图6k,n,o);而抑制肝脏来源C3可逆转上述现象。综上,麻醉/手术通过肝脏来源C3入脑激活C3-C3aR信号,促进小胶质细胞异常吞噬突触,抑制肝脏来源C3可减轻该病理过程。
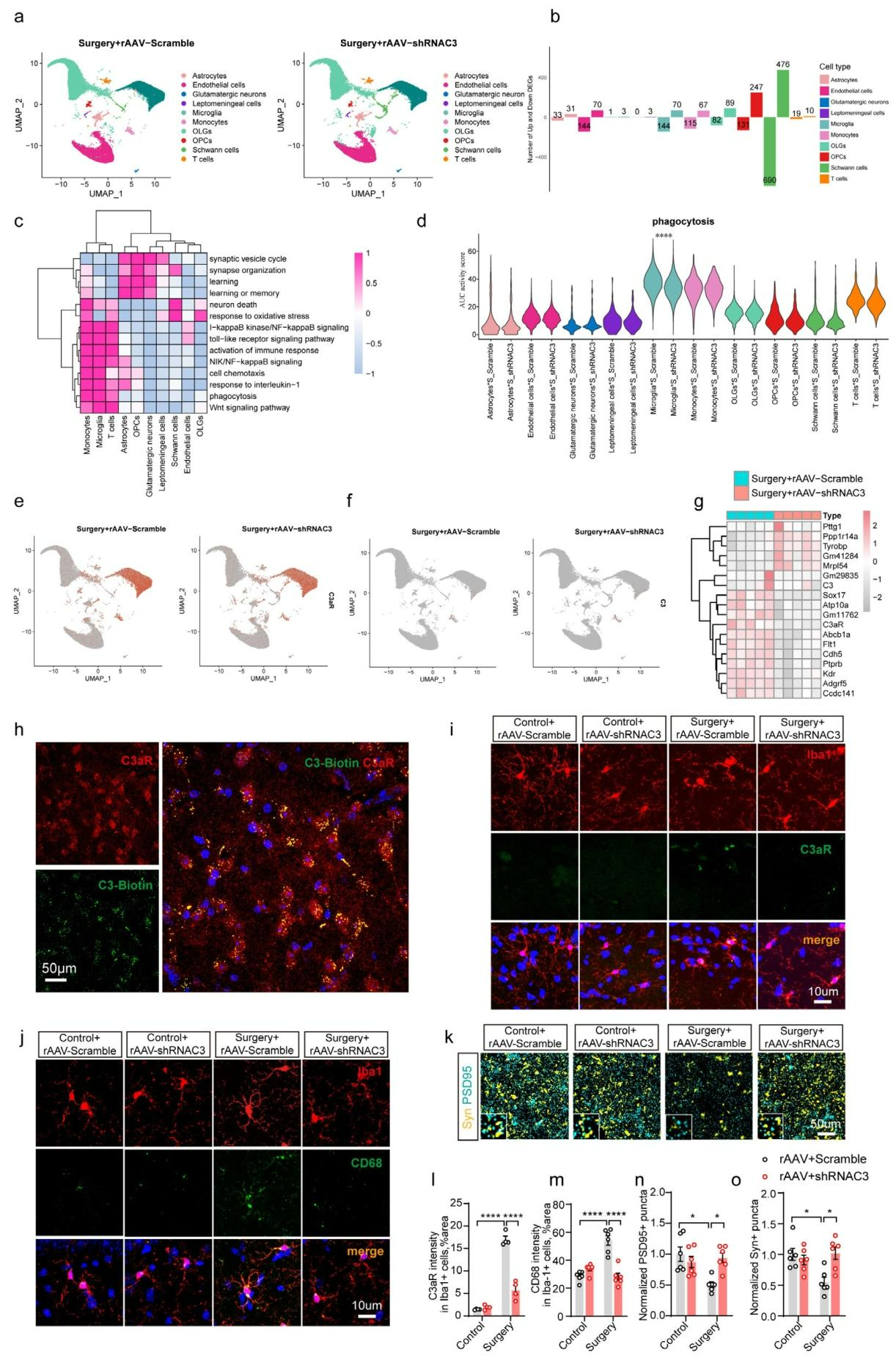
图6 抑制肝脏来源的C3减弱麻醉/手术诱导的C3aR激活和小胶质细胞吞噬作用
为探究围手术期血清补体C3与老年患者术后认知障碍(POCD)的关联性,我们纳入57例全身麻醉择期手术患者(非POCD组32例、POCD组25例),所有受试者术前无认知障碍(MMSE评分>27)且术后1周内无谵妄发生,两组在年龄、性别、教育程度等基线临床特征上无显著差异(图7a、b)。ELISA检测结果显示,非POCD与POCD患者术后血清C3浓度均较术前显著升高,提示麻醉/手术可诱导血清C3水平上调(图7c)。Spearman相关性分析表明,所有患者的术前、术后血清C3水平均与术后认知指数(认知状态电话访谈评分)呈显著负相关(-0.53≤R<-0.42,P<0.05),且血清C3的术后与术前变化差值(delta值)也呈负相关趋势(R=-0.23,P=0.09),提示C3水平变化与术后认知功能不佳密切相关(图7d-f)。组间差异分析进一步显示,POCD患者的术前、术后血清C3浓度及C3delta值均显著高于非POCD患者(图7g、h)。ROC曲线分析证实,术后1天血清C3水平(临界值1.495e+06ng/mL)与C3delta值(临界值4.715e+05)对POCD具有良好的预测效能(图7i、j)。综上,本研究表明围手术期血清C3水平升高与老年患者POCD发生相关,术后1天血清C3水平及C3delta值可作为POCD的潜在预测指标。
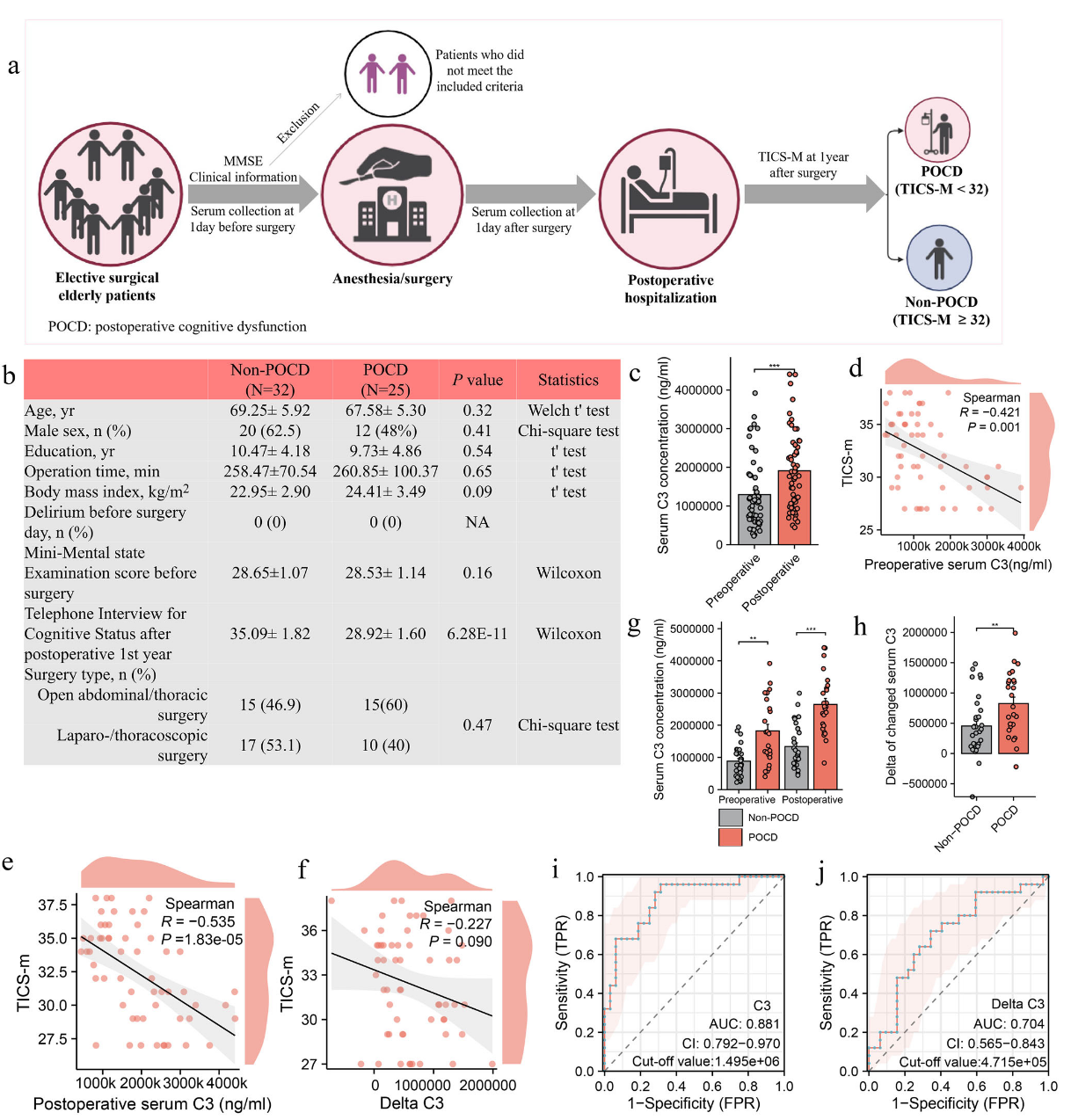
图7 围手术期血清C3蛋白质变化与术后认知障碍相关
本研究不仅揭示了外周肝脏来源的C3蛋白是介导麻醉/手术认知障碍的关键因素,阐明了其从外周入脑并导致海马突触损伤的完整通路,更重要的是发现了血清C3在围手术期的动态变化对POCD具有预测能力。这一发现为POCD的早期预警、机制解释(特别是慢性肝病患者的高风险现象)及针对外周器官的干预新策略提供了直接依据。
本文使用的工具病毒布林凯斯均可提供:

同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。