胰腺导管腺癌(PDAC)患者常伴随难以控制的疼痛和抑郁共病,严重影响生活质量和生存期,但其中枢机制不明。神经—肿瘤交互作用及代谢重编程在PDAC共病中扮演重要角色,但其调控神经功能障碍的具体机制仍需探究。m⁶A修饰及甲基转移酶14(METTL14)在癌症和疼痛、抑郁调控中具有潜在作用,S-腺苷甲硫氨酸(SAM)作为其关键底物也参与癌症进展,然而中枢神经系统中METTL14介导的表观基因组修饰是否参与PDAC诱导的共病,目前仍不清楚。
2025年11月4日,中山大学谢敬敦团队在Neuron上发表了题为METTL14 integrates tumor-derived SAM to drive parabrachial epigenetic rewiring in pancreatic cancer的研究文章。该研究揭示了PDAC诱发疼痛-抑郁共病的新机制:PDAC使小鼠LPBN谷氨酸能神经元(LPBNGlu)中METTL14表达上调,并与肿瘤来源的SAM协同增强肾上腺髓质素(ADM)的m⁶A修饰并上调其表达,进而促进LPBNGlu神经元过度兴奋及LPBNGlu→PVTGlu/LHGlu环路激活,最终促成共病。靶向抑制或敲除LPBNGlu神经元中的METTL14,或通过甲硫氨酸限制饮食降低SAM水平,能缓解共病症状及抑制肿瘤生长。

中山大学肿瘤防治中心谢敬敦教授为独立通讯作者,杨晓华、王欣桐、陆伟成和叶青青为论文共同第一作者。
研究通过胰腺内注射表达荧光素酶的K8484细胞建立原位PDAC模型(图1A-C),发现荷瘤小鼠表现出持续的疼痛样行为(图1D)和抑郁样行为(图1E)。由于术后4周时雌雄小鼠的共病状态均趋于稳定,后续实验聚焦于该时间点,并以雄性小鼠为主要研究对象。进一步通过c-Fos染色确定LPBN是肿瘤诱导神经激活的主要脑区,而非其他相关脑区(图1G)。该脑区m⁶A甲基转移酶METTL14的RNA及蛋白表达特异性上调且富集(图1H-J),METTL14表达水平与PDAC小鼠的疼痛样和抑郁样行为均呈强正相关(图1K)。细胞特异性分析进一步表明METTL14主要表达于神经元(图1L),且在LPBN谷氨酸能神经元中特异性富集(图1M)。这表明LPBNGlu神经元中的METTL14在PDAC共病中起关键作用。
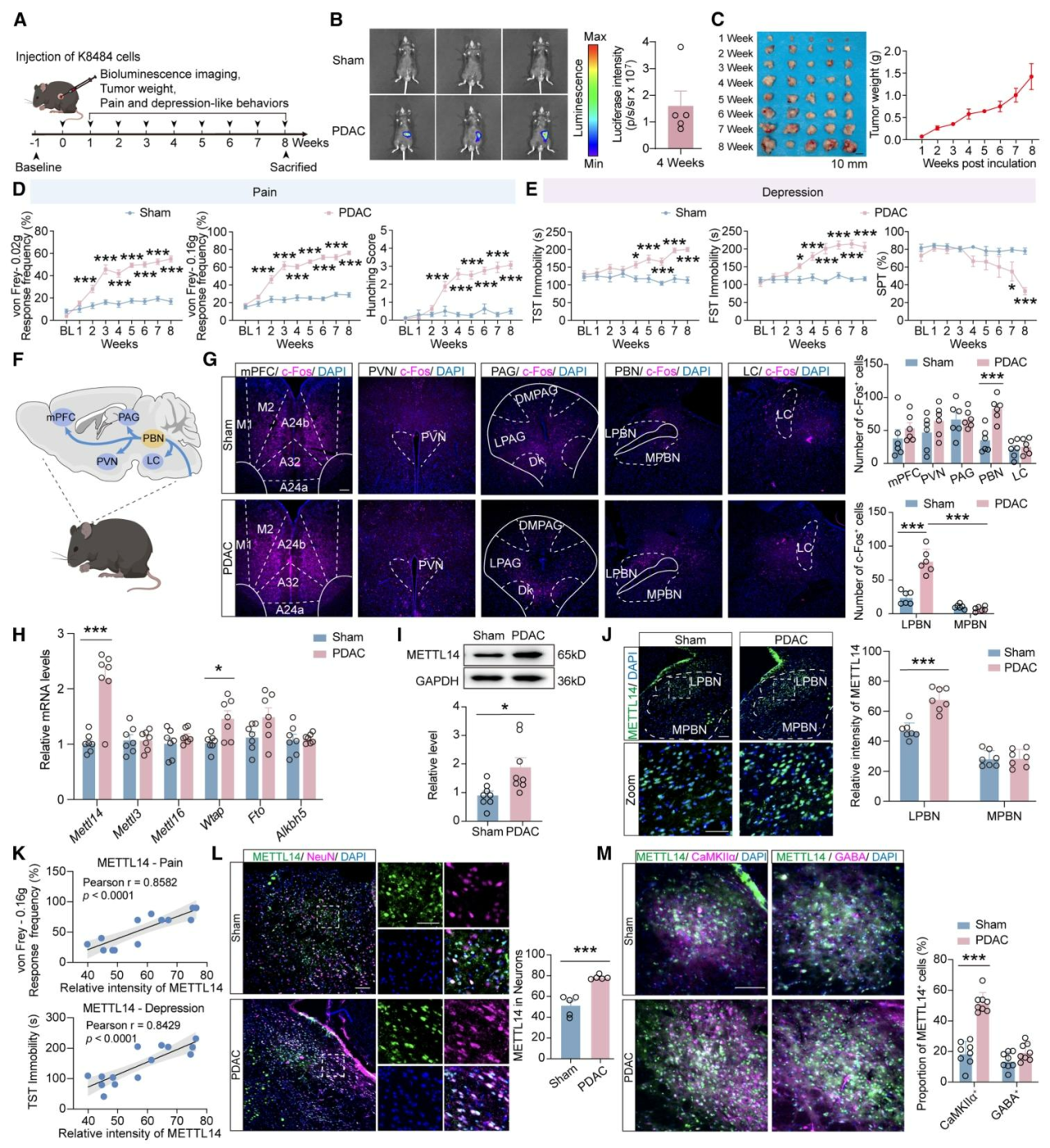
图1 PDAC小鼠表现出严重的疼痛-抑郁共病,且LPBNGlu神经元中METTL14表达升高
研究为探究LPBNGlu神经元中METTL14在PDAC诱导共病中的功能特异性,先构建Mettl14flox/flox(Mettl14f/f)小鼠,通过向其LPBN注射AAV-CaMKIIα-Cre-DsRed病毒构建Mettl14条件性敲除(Mettl14-cKO)小鼠(图2A),证实Cre介导的敲除可显著减少LPBNGlu神经元中的METTL14(图2B-C),且该敲除能显著减轻PDAC诱导的伤害性感受反应和抑郁样行为(图2D-E)。随后向正常小鼠LPBN注射AAV-CaMKIIα-Cre-DsRed与AAV-DIO-Mettl14-mCherry的混合病毒(图2F-H),发现与空载对照(AAV-DIO-mCherry)相比,METTL14过表达可诱导正常小鼠出现腹部机械痛觉过敏、弓背评分升高及TST、FST中不动时间延长、SPT中蔗糖偏好度降低等疼痛-抑郁共病相关行为(图2I-J),综上表明LPBNGlu神经元中的METTL14在PDAC诱导的疼痛-抑郁共病发生发展中起关键作用。
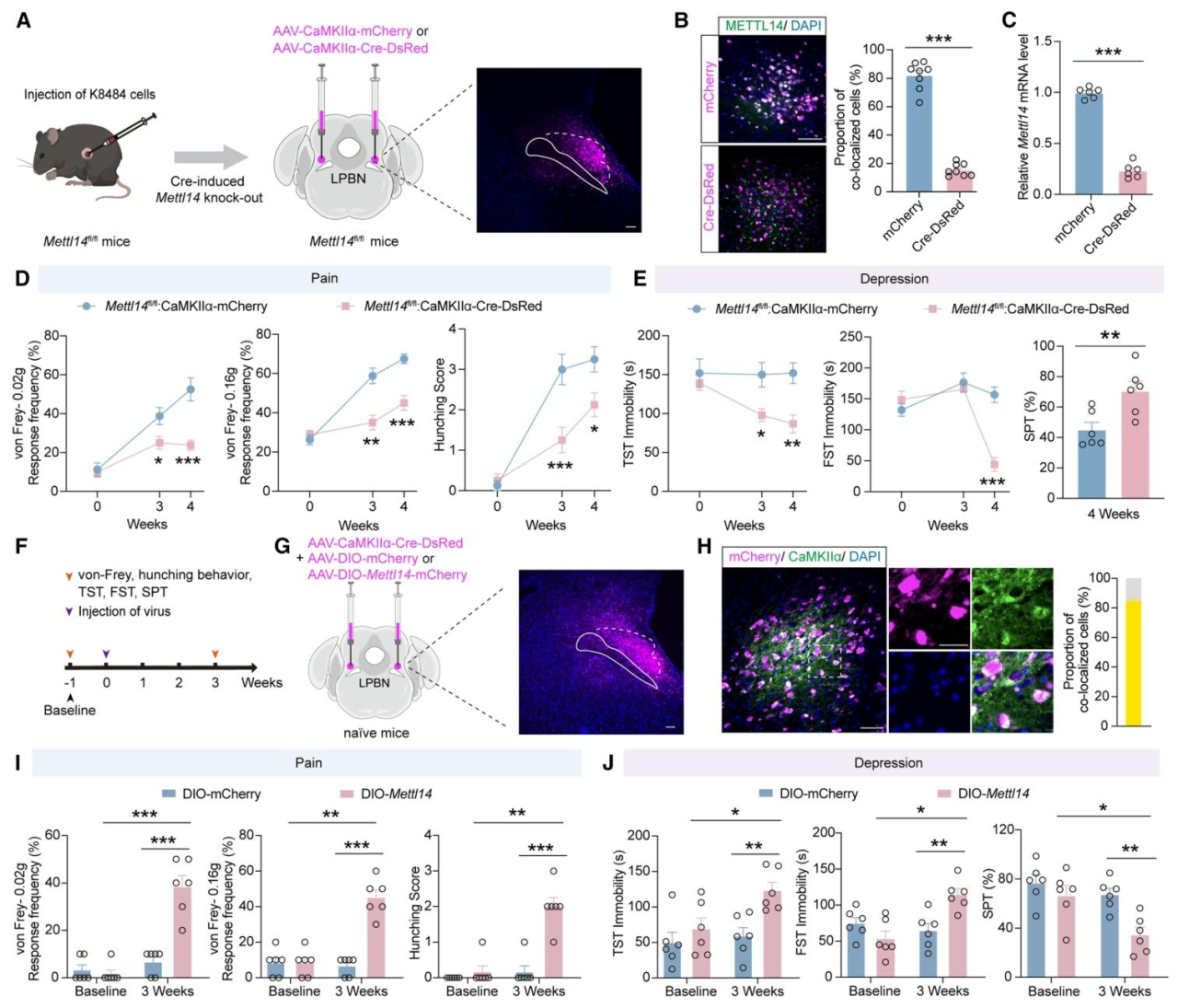
图2 LPBNGlu神经元中的METTL14促进PDAC诱导的疼痛-抑郁共病
为探究LPBNGlu神经元中METTL14参与PDAC诱导共病的机制,研究先对PDAC组与对照组小鼠LPBN进行RNA测序(RNA-seq),发现PDAC条件下与行为调控、突触翻译相关通路富集(图3A),Mettl14-cKO小鼠LPBN中有2177个差异表达基因(图B)。GO富集分析显示,METTL14可通过调控与G蛋白偶联受体信号传导中的胞质钙离子动态、钙离子转运、疼痛感觉相关的通路,影响LPBN的神经活性(图3C)。随后光纤photometry记录发现,PDAC小鼠LPBN谷氨酸能神经元自发性钙信号及von-Frey和TST刺激下的钙瞬变均显著增强(图3D-G);全细胞膜片钳记录证实该类神经元在自发和诱发水平均内在过度兴奋(图3H-K)。向PDAC小鼠LPBN共注射AAV-CaMKIIα-Cre与AAV-DIO-hM4Di-mCherry并腹腔注射CNO抑制该类神经元活性后,其伤害性感受过敏和抑郁样行为均显著改善(图3L-M),且肿瘤生长延缓。综上表明LPBNGlu神经元过度兴奋既介导PDAC诱导的疼痛-抑郁共病,又能促进外周肿瘤生长。
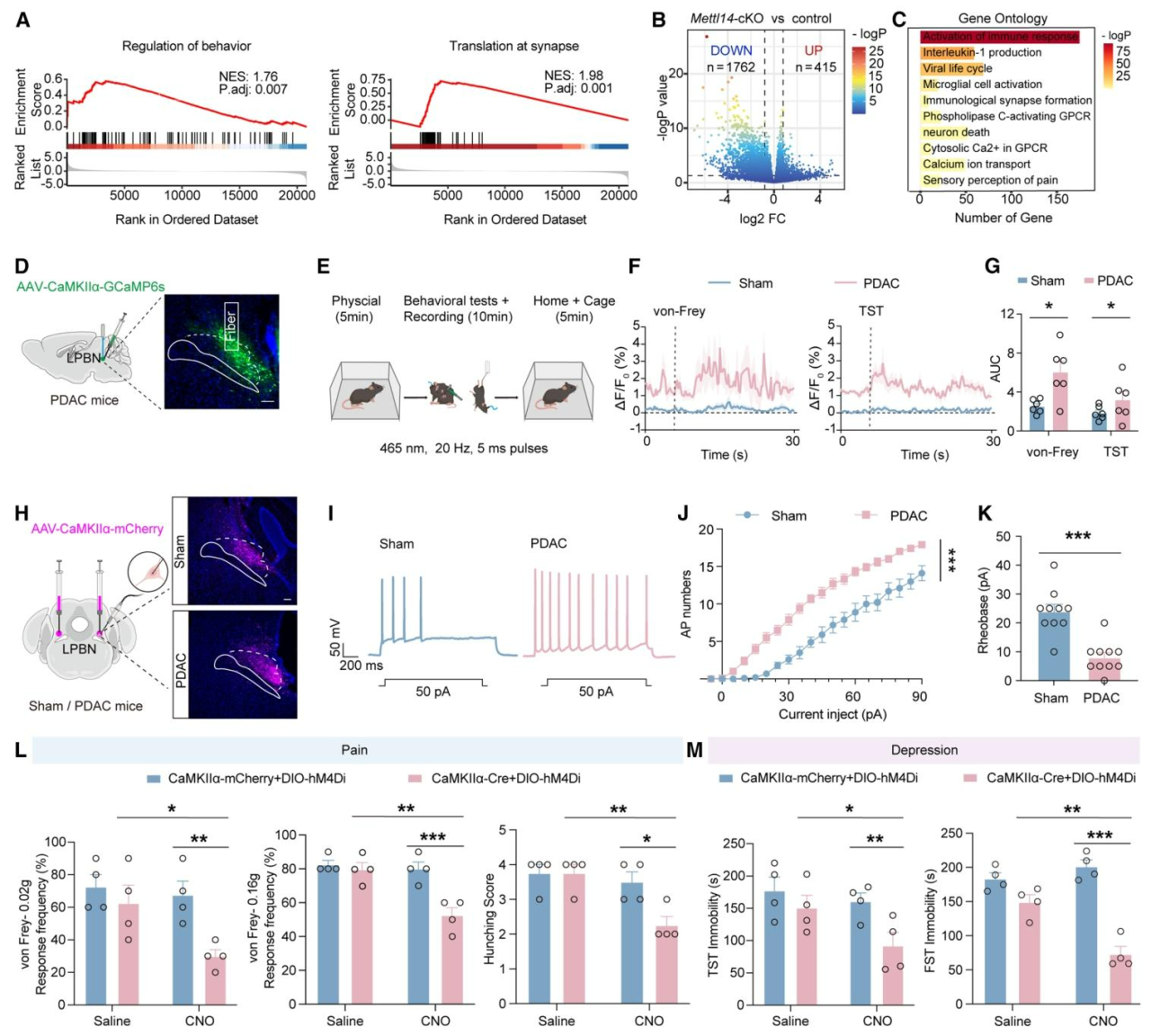
图3 LPBNGlu神经元过度兴奋参与METTL14介导的疼痛-抑郁共病
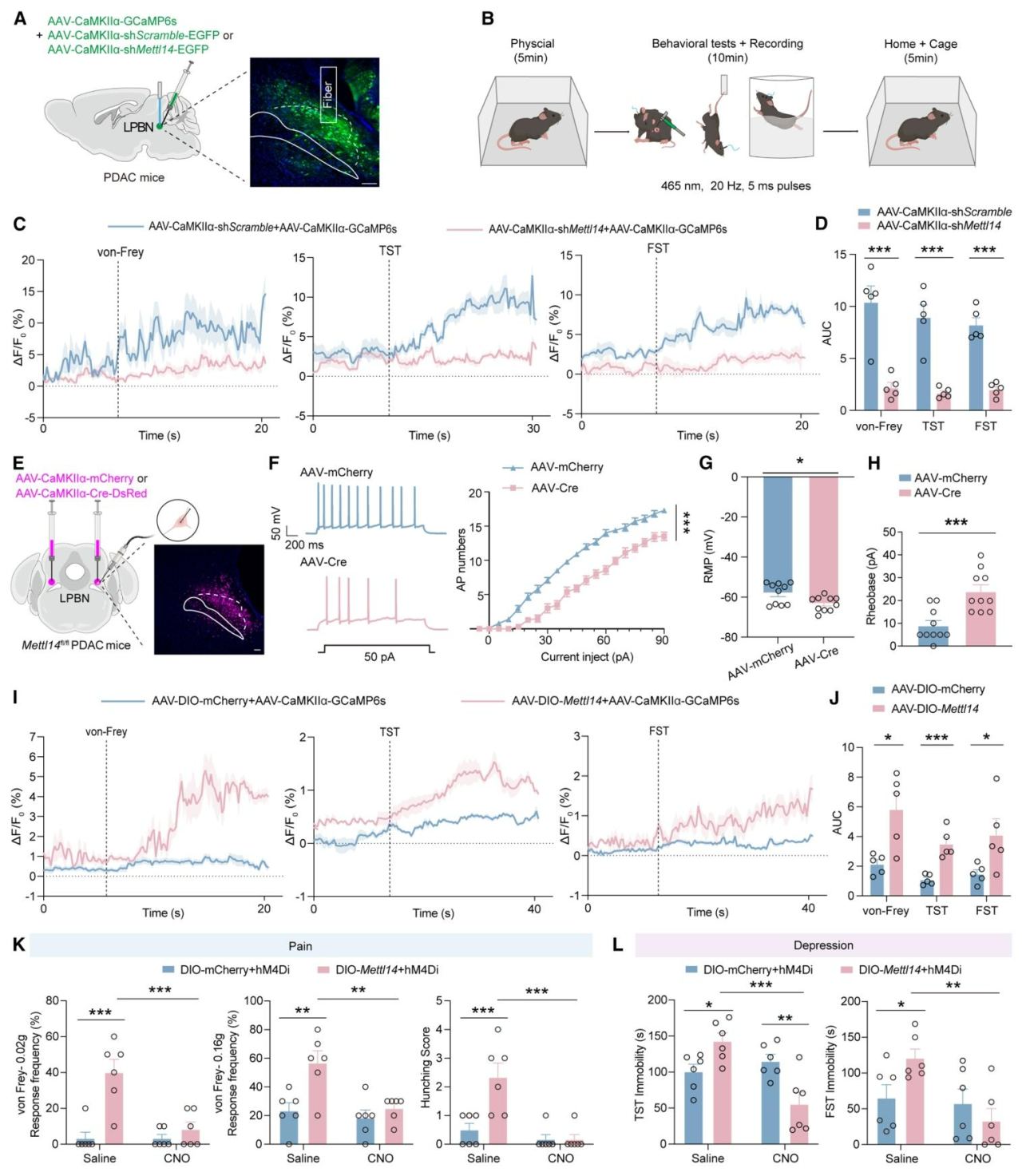
图4 LPBNGlu神经元中的METTL14调控神经元兴奋性并参与疼痛-抑郁共病

图5 LPBNGlu神经元中,METTL14介导m⁶A修饰ADM驱动疼痛-抑郁共病
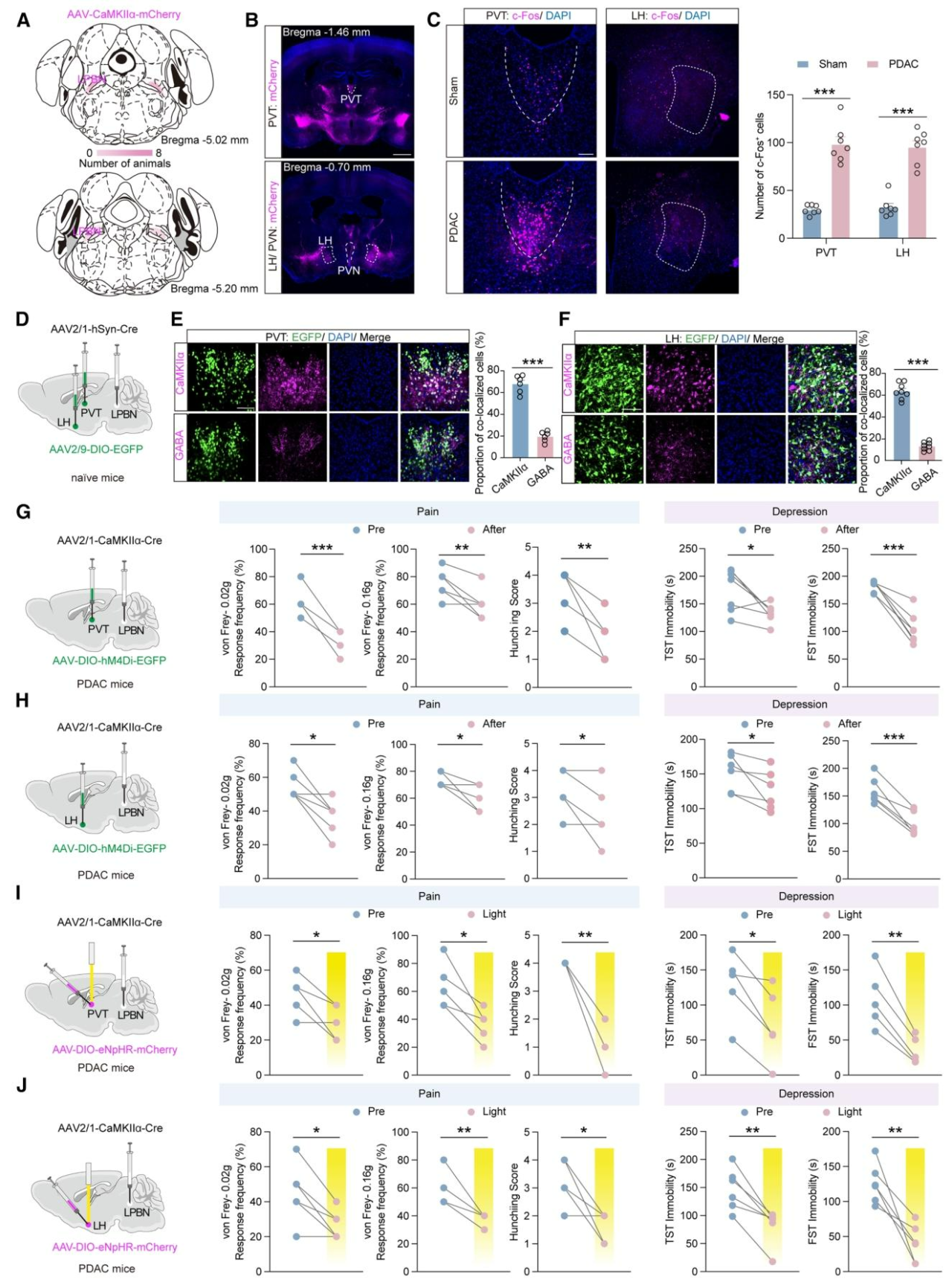
图6 LPBNGlu→PVTGlu/LHGlu环路调控PDAC诱导的疼痛-抑郁共病
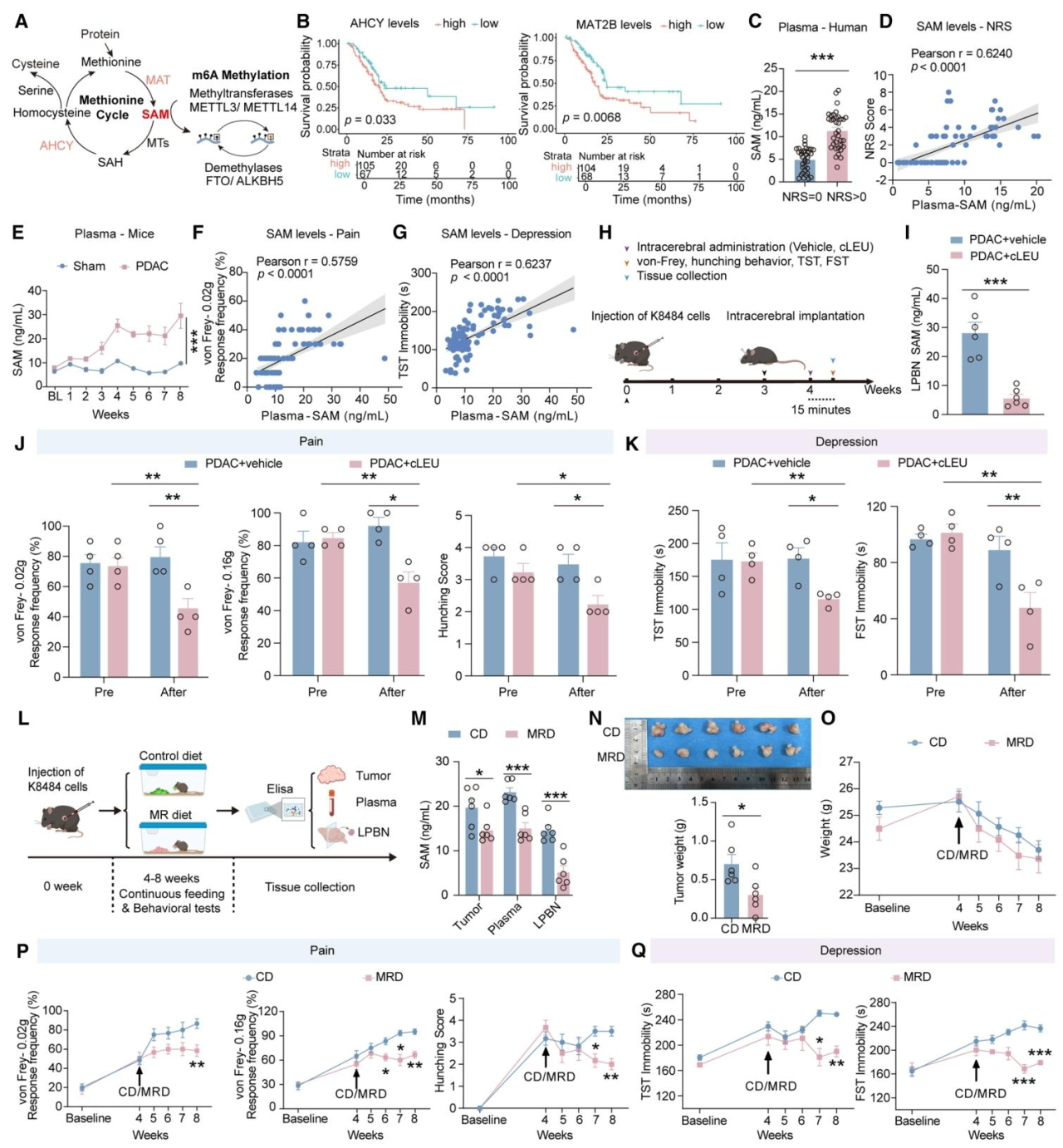
图7 S-腺苷甲硫氨酸(SAM)代谢异常参与PDAC诱导的疼痛-抑郁共病
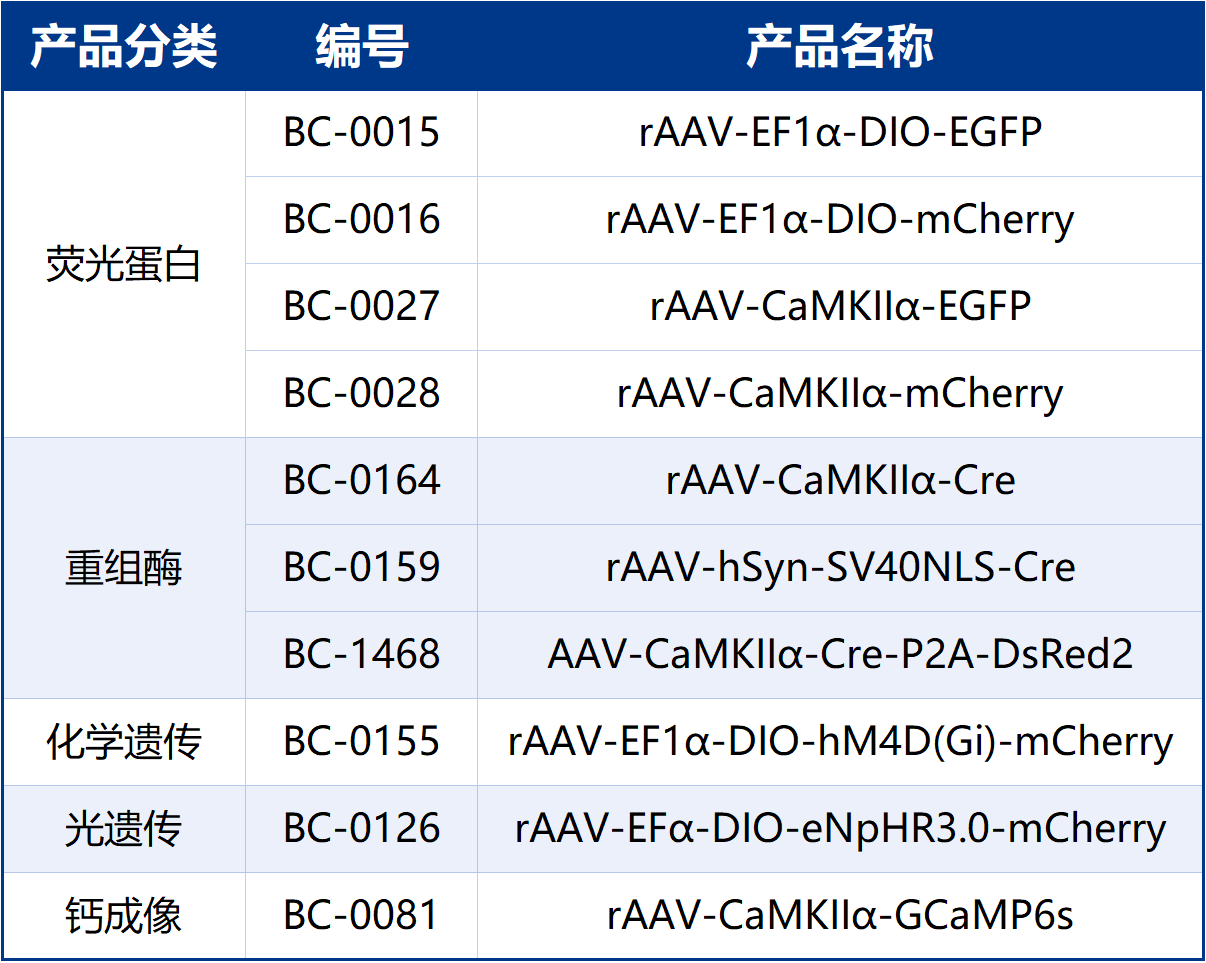
本文使用的工具病毒布林凯斯均可提供:
同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。