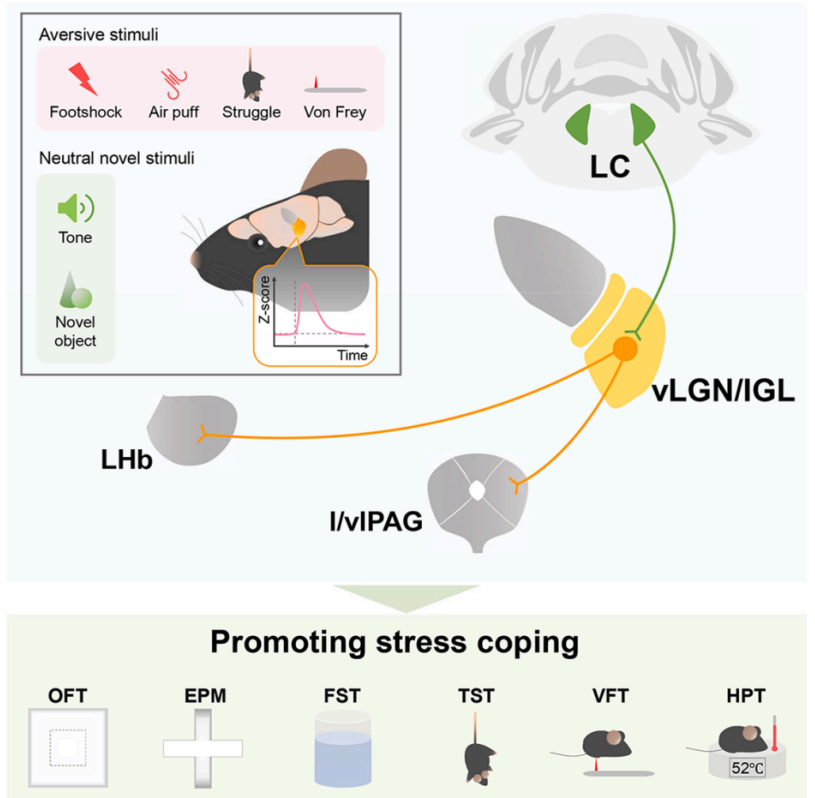
适应性应激响应是进化保守的生存机制,健康个体可通过灵活的应对策略维持内稳态,而应对能力受损会增加抑郁等应激相关疾病风险,但相关神经环路尚未明确。传统认为腹外侧膝状体核/膝状体间叶(vLGN/IGL)仅参与视觉处理(如光调节唤醒、视觉防御行为),但近年研究发现其接收蓝斑核(LC)、中缝背核(DRN)等应激调控核团投射,提示其可能具备多感官整合与应激调控功能,成为本研究的核心探索对象。

2025年11月5日,暨南大学任超然团队在Neuron上发表题为“Multisensory integration in the mouse ventral visual thalamus mediates stress coping via locus coeruleus-related circuits”相关文章,证实vLGN/IGL是整合多感官刺激的关键枢纽;该区域通过接收LC释放谷氨酸的兴奋性输入,对厌恶刺激(如足底电击)和中性新异刺激(如听觉音调)产生响应,进而介导应激应对行为;LC-vLGN/IGL通路通过向外侧缰核(LHb)、外侧/腹外侧导水管周围灰质(l/vlPAG)等下游脑区的差异化投射,分别调控情绪和疼痛相关行为。
暨南大学任超然研究员、陶倩教授、黄鲁研究员以及黄晓丹副研究员为该论文共同通讯作者。暨南大学黄晓丹副研究员、博士后刘显玮、博士研究生徐晓淮和博士后胡峥芳为论文的共同第一作者。该研究得到国家自然科学基金、国家科技创新2030“脑科学与类脑研究”重大专项、广东省自然科学基金等多个科研基金支持。
为了探究vLGN/IGL神经元对不同效价刺激的响应,向C57BL/6J小鼠vLGN/IGL注射编码GCaMP7s的AAV,通过光纤记录监测群体活动(图1A)。评估神经元对厌恶刺激的响应,发现足底电击、气流喷射、伤害性机械/热刺激均能强烈激活vLGN/IGL神经元(图1B-E);小鼠悬尾挣扎时,该神经元也显著激活,进一步证实其对厌恶环境的敏感性(图1F)。检测中性刺激响应时,中性听觉音调(75dB,500ms)首次刺激引发神经元显著兴奋,重复刺激后兴奋减弱(图1G);新物体探索中,小鼠靠近物体时vLGN/IGL神经元钙活动增强,随后逐渐下降(图1H),表明其对新异性刺激敏感。对比来看,小鼠摄取自然奖励(2%蔗糖水,20μL)时,vLGN/IGL活动无显著变化(图1I),凸显其对厌恶/中性新异刺激的选择性敏感。
为了明确响应特性,在头部固定小鼠中开展在体电生理记录(图1J),结果显示vLGN/IGL中约79%神经元被厌恶刺激(如气流喷射)或中性新异刺激(如音调)激活(图1K),且约98%响应神经元对两种刺激均有响应。基于既往研究证实vLGN/IGL存在兴奋/抑制性神经元亚型,进一步记录vGAT+(主要抑制性)和CaMKIIα+(主要兴奋性)神经元,发现约80%的两种神经元被厌恶/中性新异刺激激活,且约97% vGAT+神经元、96% CaMKIIα+神经元对两种刺激均有响应。综上,vLGN/IGL神经元对厌恶应激源和中性新异刺激均具有强烈响应能力。
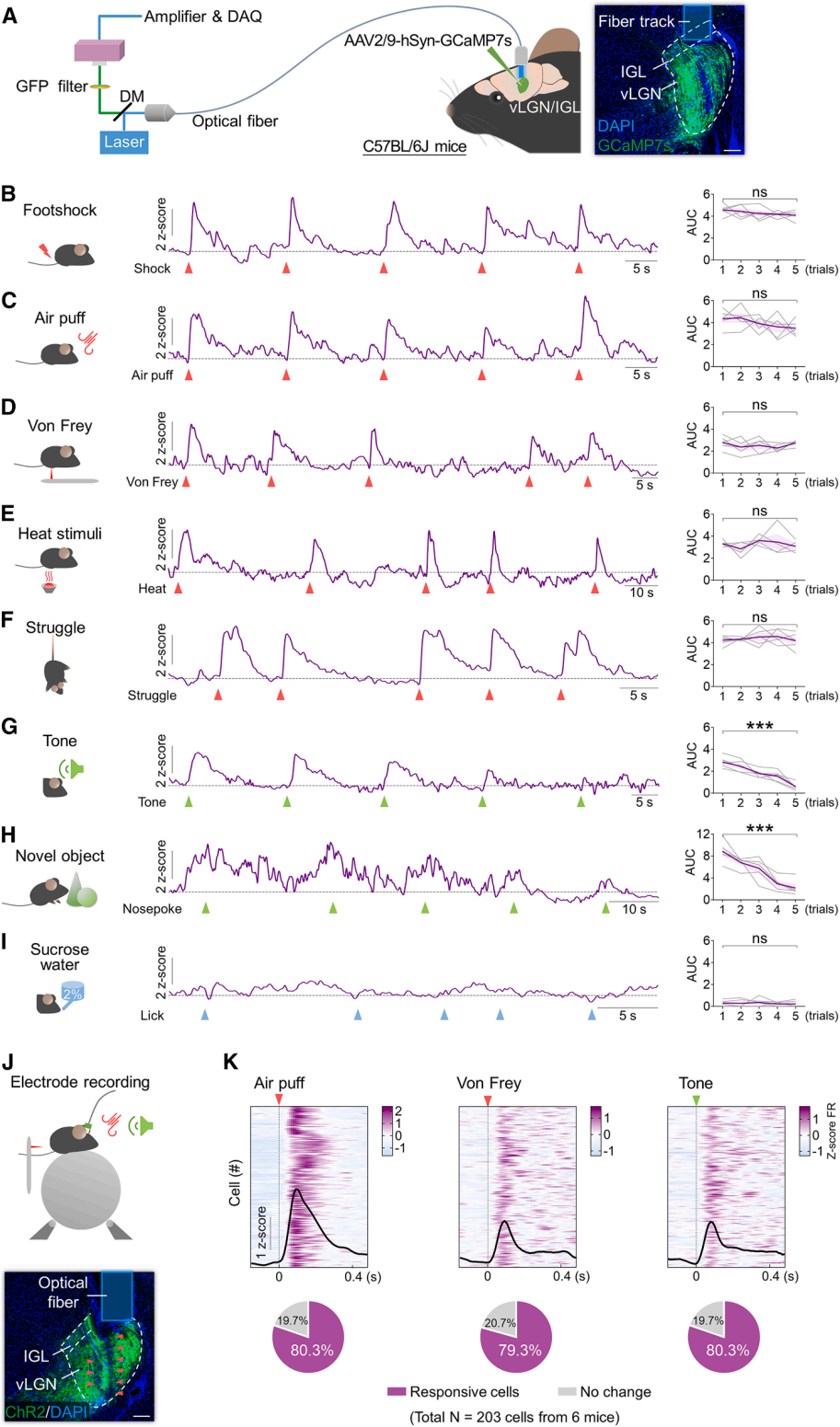
图1 vLGN/IGL神经元可被厌恶和中性新刺激激活
为了明确vLGN/IGL接收厌恶与中性新异刺激信号的潜在输入通路,采用逆行跨单突触追踪技术,向vLGN/IGL注射编码TVA和RVG的AAV(辅助病毒)(图2A),再注射EnvA假型RV-ΔG-EGFP狂犬病病毒(图2A-C),实现突触前神经元单突触逆行标记。结果显示除已知视网膜输入(图2D)外,EGFP标记神经元还存在于视觉处理区(sSC、VC、APN)及情绪应激调控区(DRN、LC)(图2D)。
为了确定介导vLGN/IGL激活的通路,记录其神经元活动时选择性沉默各候选通路突触传递:向vLGN/IGL注射rAAV2/2-Retro-Cre,逆行标记视网膜、sSC、VC、APN、DRN或LC的投射神经元(图2E-J),再转染Cre依赖的TetTox病毒阻断突触释放(图2E-J);同时在vLGN/IGL表达GCaMP7s并植入光纤用于钙成像(图2E-J)。结果显示,沉默视网膜、sSC、VC、APN、DRN输入对vLGN/IGL响应无显著影响(图2E-I);而沉默LC-vLGN/IGL输入显著减弱该响应(图2J)。综上,LC输入对驱动vLGN/IGL被厌恶与中性新异刺激激活至关重要。
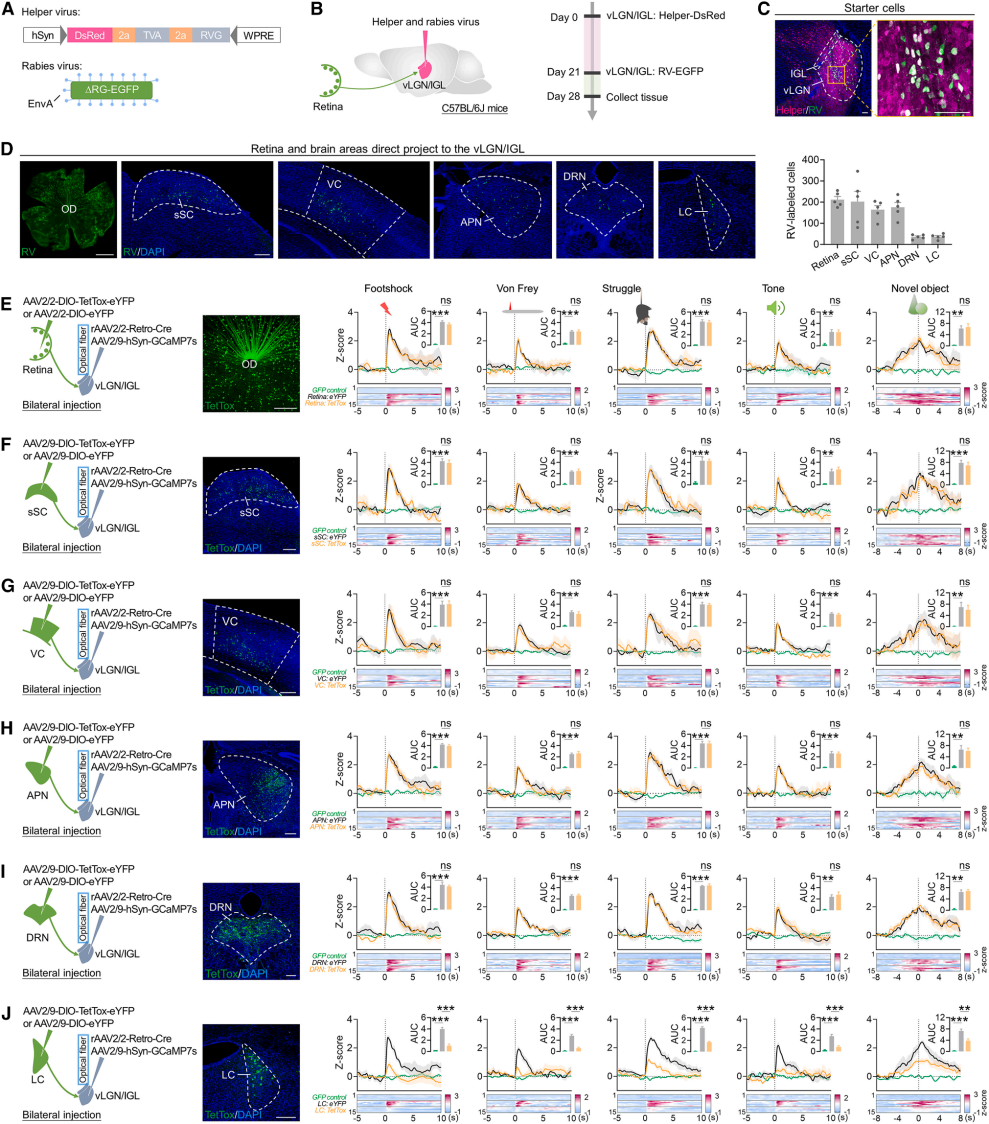
图2 失活vLGN/IGL投射的LC神经元会减弱由厌恶和中性新刺激引发的vLGN/IGL神经元激活
为了明确LC-vLGN/IGL通路功能连接,向C57BL/6J小鼠vLGN/IGL注射rAAV2/2-Retro-Cre,向LC注射含ChR2和eYFP的Cre依赖型病毒(图3A)。光刺激LC-vLGN/IGL投射后,vLGN/IGL神经元中48%出现兴奋性突触后电流(EPSC)图3B-C);EPSC可被电压门控钠通道阻滞剂(TTX)阻断、钾通道阻滞剂(4-AP)恢复(图3D),证明LC通过直接投射传递兴奋性输入。20Hz光刺激诱导的持续性内向电流类似α1肾上腺素能受体(α1AR)激活效应(图3E),且同时加用α1AR特异性拮抗剂(Doxa)与AMPA/红藻氨酸受体拮抗剂(NBQX)可完全消除EPSC(图3E),提示部分LC神经元在vLGN/IGL突触共释放谷氨酸与去甲肾上腺素。
共标记实验显示,约64.2% eYFP标记的LC-vLGN/IGL神经元同时呈谷氨酸与TH阳性,证实部分LC神经元通过共释放两种递质直接支配vLGN/IGL。已有研究表明LC神经元对显著性刺激的响应特性,结合LC-vLGN/IGL激活的必要性(图2J)及兴奋性投射关系(图3D),研究人员假设该LC神经元可被厌恶/中性新异刺激激活。光纤光度法检测显示,两种刺激均能增强其钙活动(图3F),验证假设。综上,投射至vLGN/IGL的LC神经元同样可被厌恶刺激和中性新异刺激激活。进一步探究递质作用,利用基因编码的GPCR激活型去甲肾上腺素荧光探针(GRAB-NE)和谷氨酸荧光探针(iGluSnFR)监测发现,厌恶/中性新异刺激两种刺激均使vLGN/IGL中去甲肾上腺素与谷氨酸水平升高(图3G-H)。颅内注射Doxa对vLGN/IGL神经元活性无显著影响,而注射NBQX显著抑制其激活(图3I-J),表明谷氨酸是驱动该神经元响应的关键递质。
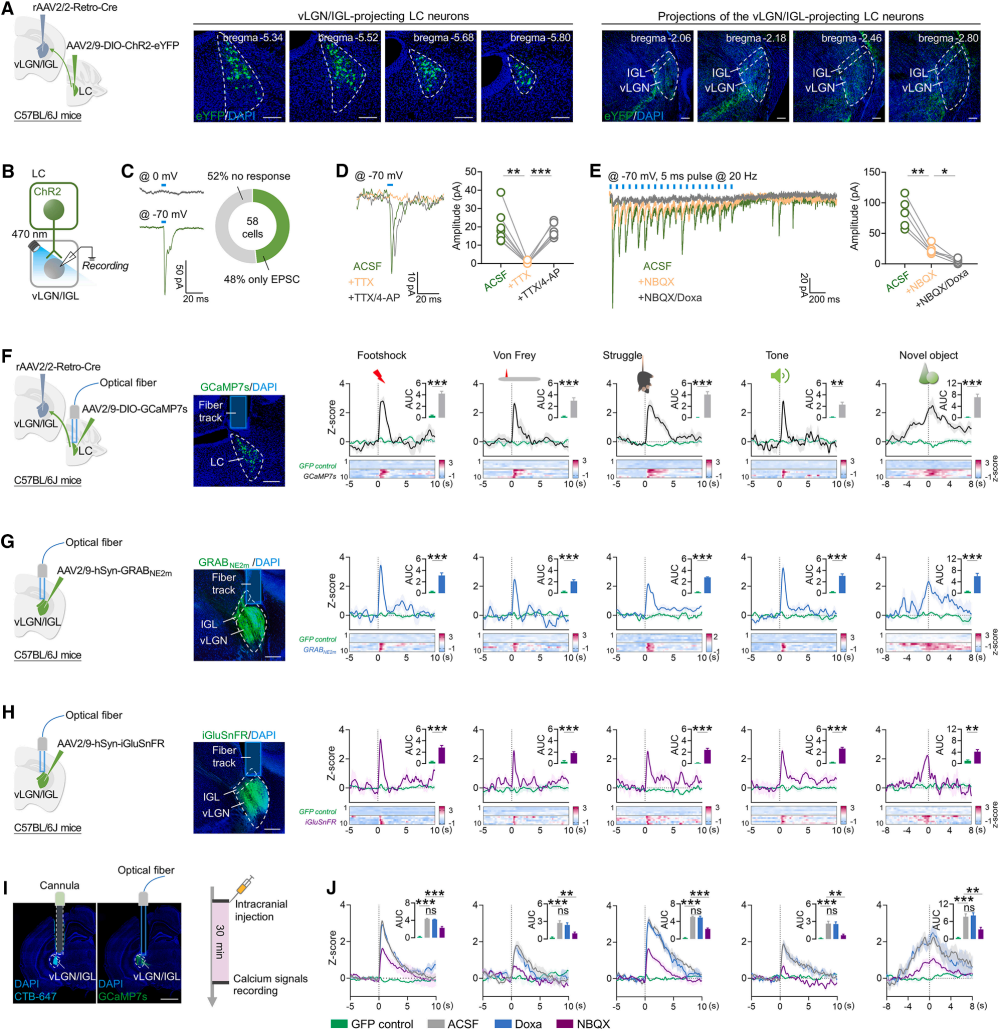
图3 厌恶刺激和中性新异刺激会激活vLGN/IGL投射的LC神经元
鉴于LC-vLGN/IGL通路神经元被应激相关刺激激活(图1、图3F),探究其对压力应对行为的调控作用。首先用化学遗传学在应激任务中抑制LC-vLGN/IGL投射(图4A):向C57BL/6J小鼠vLGN/IGL双侧注射rAAV2/2-Retro-Cre,向LC注射Cre依赖型AAV2/9-DIO-hM4Di-mCherry(图4B-C),并在vLGN/IGL上方植套管(图4B)。两周后,行为测试前30分钟向vLGN/IGL输注CNO(图4A),结果显示旷场实验(OFT)中心时间、高架十字迷宫(EPM)开臂探索时间减少,强迫游泳测试(FST)/悬尾测试(TST)不动时间增加,纤毛机械刺激针实验(VFT)机械阈值、热板实验(HPT)热撤回潜伏期降低,疼痛刺激撤回速度减慢(图4D),表明抑制该投射损害应激应对行为。
为了验证通路作用,向LC注射AAV2/1-Cre,向vLGN/IGL突触后神经元感染AAV2/9-DIO-hM4Di-mCherry(图4E-F),抑制接收LC直接输入的vLGN/IGL神经元(图4A),结果同样损害应激应对行为(图4G),证实LC-vLGN/IGL通路激活对促进应激应对策略是必需的。用shRNA敲低技术减少LC-vLGN/IGL神经元释放去甲肾上腺素或谷氨酸(图4H),发现野生型小鼠中,减少谷氨酸释放显著增加抑郁/焦虑样行为、降低疼痛阈值、减慢疼痛撤回速度(图4I),而减少去甲肾上腺素释放无显著影响(图4I),强调vLGN/IGL内谷氨酸释放对应激应对行为的关键介导作用。
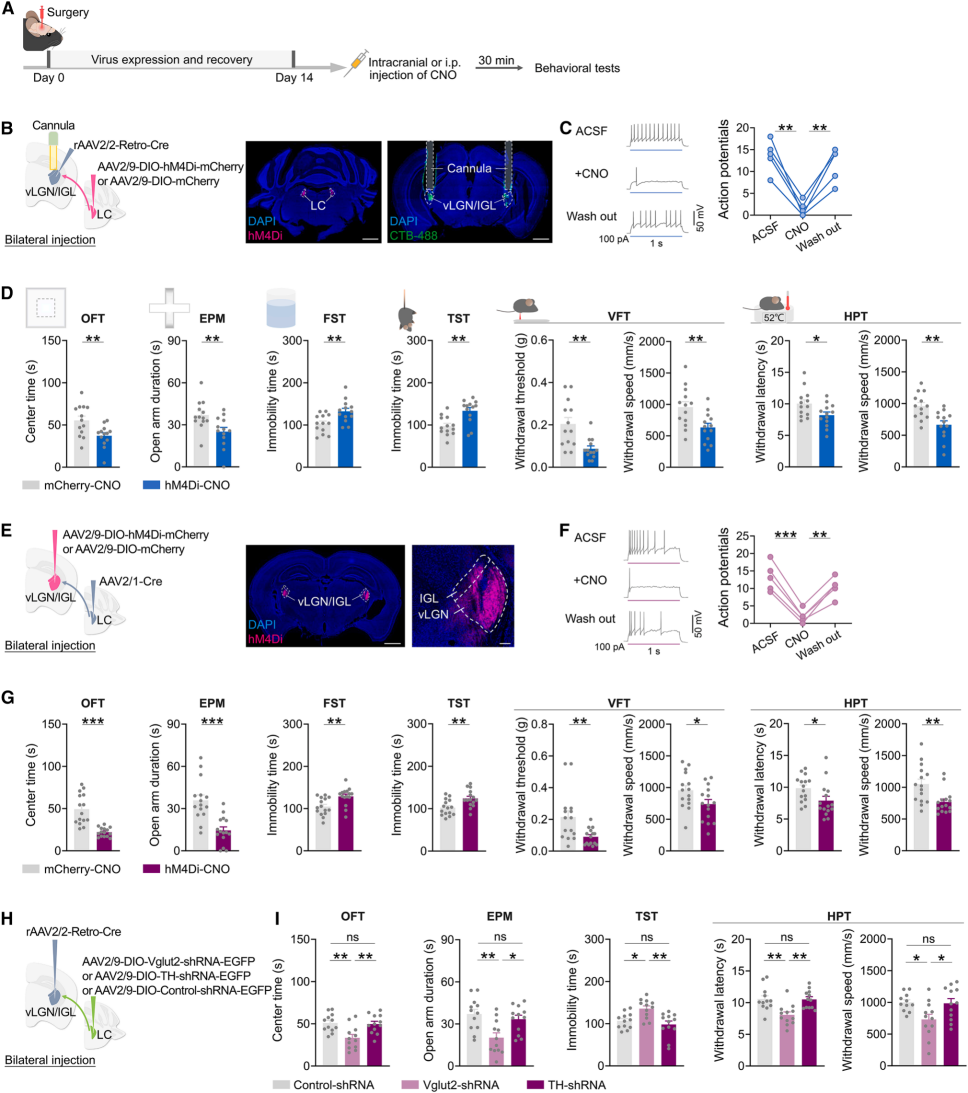
图4 LC-vLGN/IGL通路激活是应对压力行为的必要条件
鉴于应激应对受损与抑郁症等精神疾病相关,且此前证实LC-vLGN/IGL通路激活对应激应对至关重要(图4),研究人员探究抑制该通路对应激韧性的影响。首先对小鼠实施3天亚阈值应激(每日20次0.8mA足底电击+1小时束缚;图5A),该方案通常不诱导对照小鼠抑郁样行为(图5C)。结果显示,应激期间化学遗传学抑制LC-vLGN/IGL投射神经元或其直接支配的vLGN/IGL神经元,会显著加剧抑郁样行为、降低疼痛阈值、减慢疼痛退缩速度(图5B-5E)。此外,减少LC-vLGN/IGL神经元的谷氨酸释放,会显著增加小鼠亚阈值应激易感性,而减少去甲肾上腺素释放对应激韧性无影响(图5F-G)。采用1天亚阈值社交挫败模型(图5H),结果显示抑制上述两类神经元会显著增加小鼠社交应激易感性(图5I)。综上,LC-vLGN/IGL通路对维持动物应激刺激韧性至关重要。
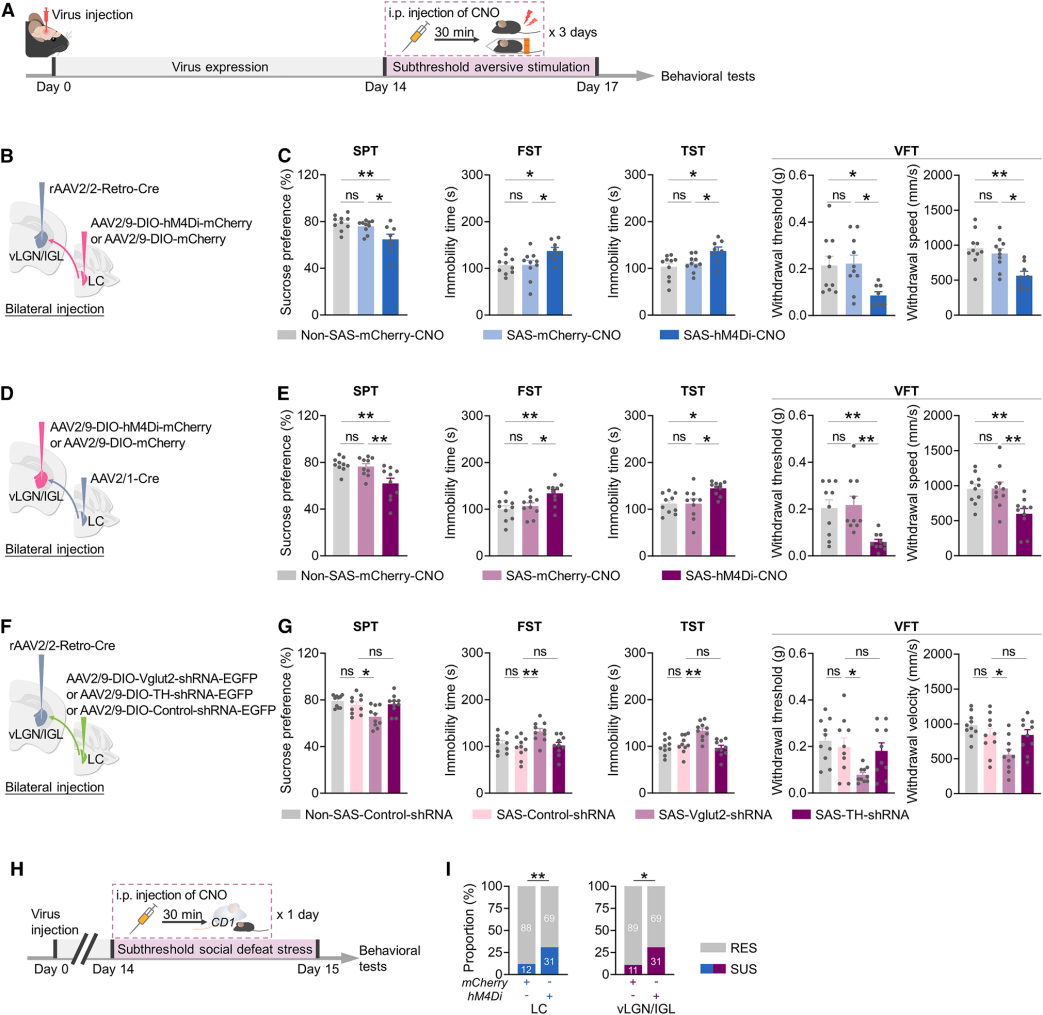
图5 LC-vLGN/IGL通路介导行为韧性
接收LC直接输入的vLGN/IGL神经元投射至LHb、Re、l/vlPAG等下游脑区,提示该通路传递的多感官信息或通过调控这些脑区影响行为韧性。为了明确通路行为输出机制,用光纤记录上述脑区内vLGN/IGL神经元轴突末梢钙信号(图6A-6D),发现三个投射均会被厌恶/中性新异刺激激活(图6B-6D)。亚阈值厌恶刺激期间,特异性化学遗传学抑制各脑区末梢(图6E):抑制LHb投射末梢显著加剧抑郁/焦虑样行为,不影响疼痛相关行为(图6F);抑制l/vlPAG投射末梢显著降低疼痛阈值、减慢疼痛退缩速度,不影响情绪相关行为(图6G);抑制Re投射末梢对两类行为均无显著影响(图6H)。结果表明,LC-vLGN/IGL通路通过向特定下游脑区的特化投射调控不同行为域,对行为韧性起关键调控作用。
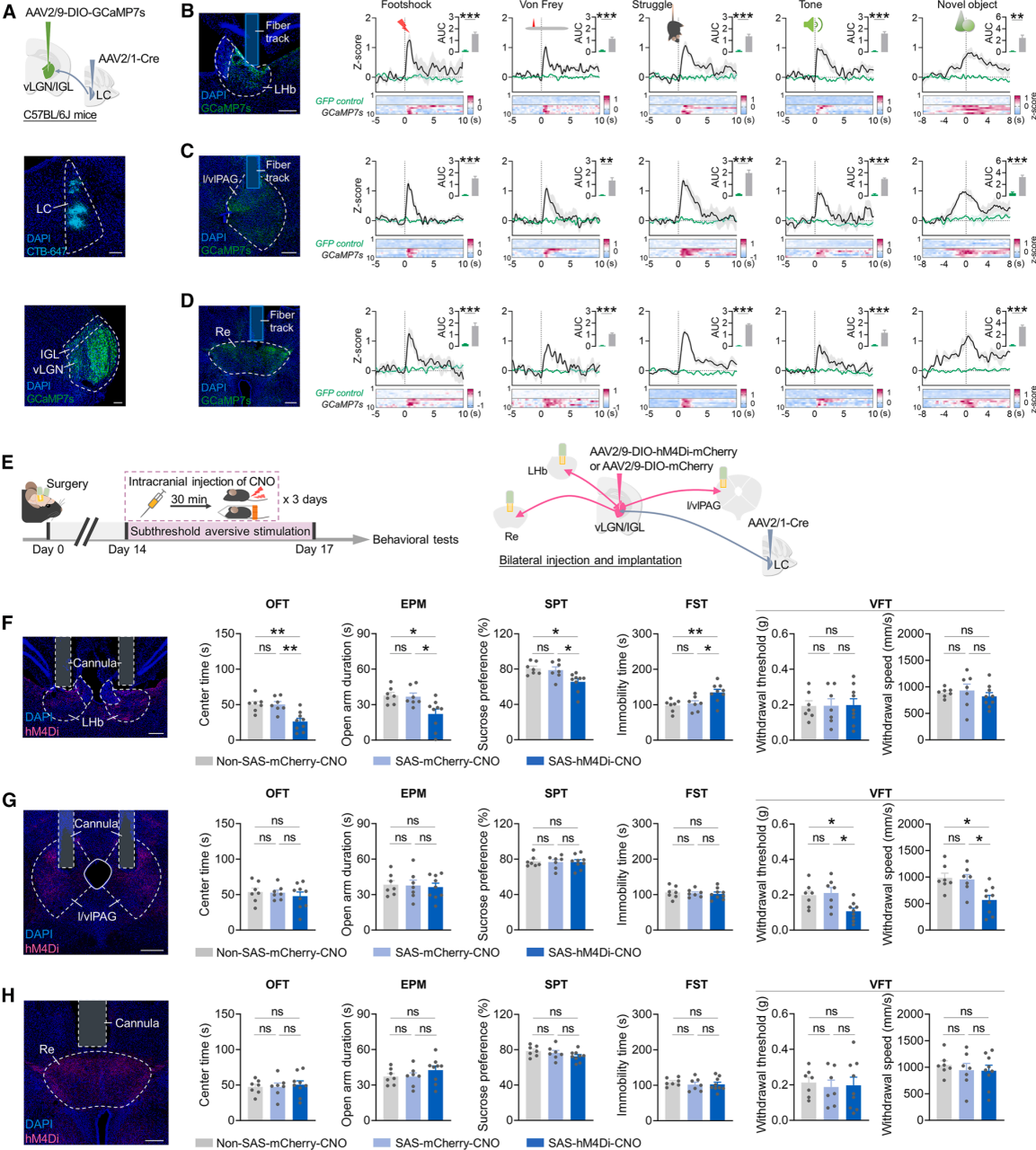
图6 LC-vLGN/IGL通路通过向特定行为领域投射差异信号,调控行为韧性
基于此前抑制LC-vLGN/IGL通路损害应激应对、增加应激易感性的发现(图4、图5),研究人员探究激活该通路能否增强应激应对行为。首先,向vLGN/IGL注射rAAV2/2-Retro-Cre,向LC注射编码hM3Dq的AAV,靶向调控LC-vLGN/IGL神经元(图7A-B)。病毒表达2周后,行为测试前30分钟腹腔注射CNO激活神经元(图7C),结果显示OFT中心时间↑、EPM开臂探索↑、FST/TST不动时间↓、VFT机械阈值↑、HPT热撤回潜伏期↑、疼痛刺激退缩速度↑(图7D)。为了明确通路作用,向LC注射AAV2/1-Cre,向vLGN/IGL注射AAV2/9-DIO-hM3Dq-EGFP,激活vLGN/IGL突触后神经元(图7A、7E),同样促进应激应对行为(图7F-G)。此外,经历4周慢性厌恶应激的小鼠中,激活LC-vLGN/IGL神经元或其直接支配的vLGN/IGL神经元,均显著缓解慢性应激诱导的抑郁样症状。综上,激活LC-vLGN/IGL通路足以在多个行为域促进小鼠应激应对行为。
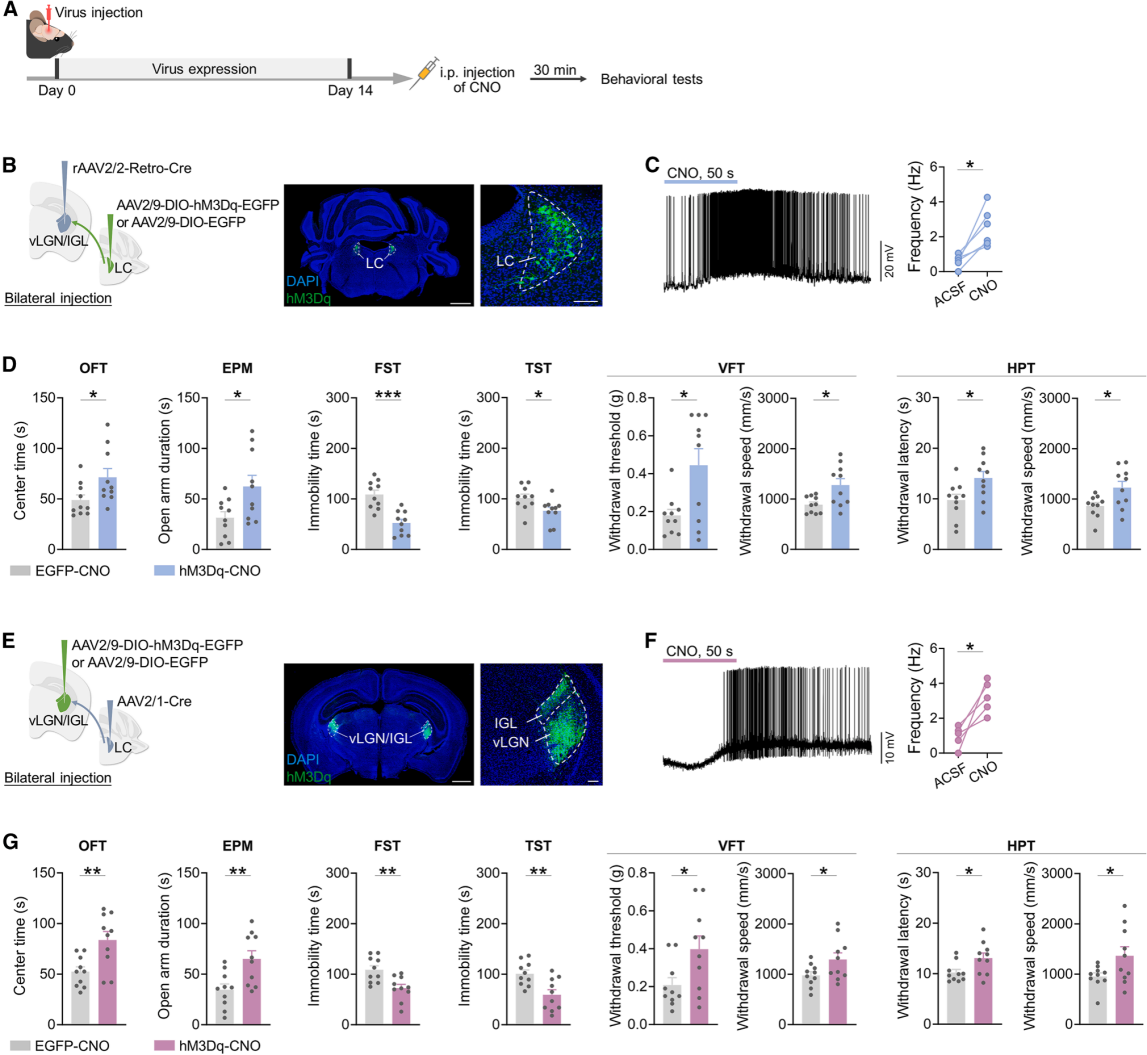
图7 LC-vLGN/IGL通路激活促进应激应对行为
鉴于中性新异刺激可激活vLGN/IGL及LC-vLGN/IGL神经元(图1G、1H、1K、3F),且LC-vLGN/IGL通路激活能促进应激应对行为(图7),研究人员探究含该类刺激的环境富集(EE)处理是否增强小鼠应激应对行为(图8A)。为了评估EE处理对应激应对行为的影响,暴露2小时EE环境的小鼠,其接收LC直接输入的vLGN/IGL神经元活性显著增强(图8B);小鼠接受每日2小时、持续1天/1周/2周的EE处理(图8C),结果显示EE处理对小鼠应激应对行为的改善效果,和处理的持续时间正相关(图8D)。且2周EE处理后,该类vLGN/IGL神经元电流诱发动作电位增加,mEPSC频率与振幅升高(图8E-8G),提示长期EE可促进应激应对行为,伴随vLGN/IGL神经元兴奋性增强。EE处理期间化学遗传学抑制LC-vLGN/IGL神经元(图8H),EE诱导的应激应对增强效应消失(图8I);抑制接收LC直接输入的vLGN/IGL神经元(图8H),应激应对改善效果显著减弱(图8J),综上表明LC-vLGN/IGL通路是EE促进应激应对行为的关键介导通路。
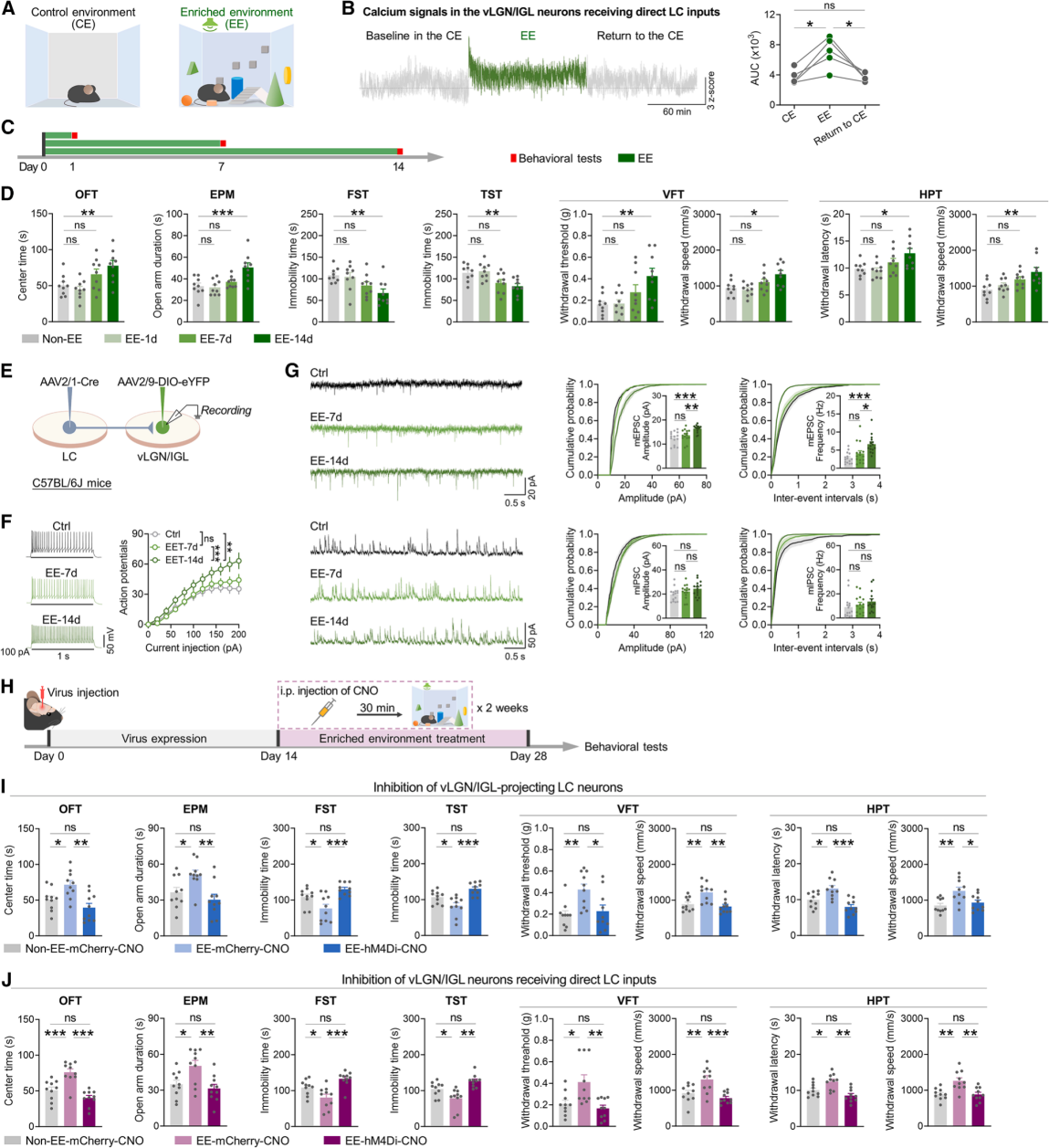
图8 EE处理通过LC-vLGN/IGL通路促进压力应对行为
本文首次建立 “LC-vLGN/IGL轴” 作为感官整合-应激应对的核心环路,为应激相关疾病提供新的神经机制框架;确立vLGN/IGL为应激干预靶点,环境富集为非药物干预手段,且明确谷氨酸信号为关键分子。
本文使用的工具病毒布林凯斯均可提供:
同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。