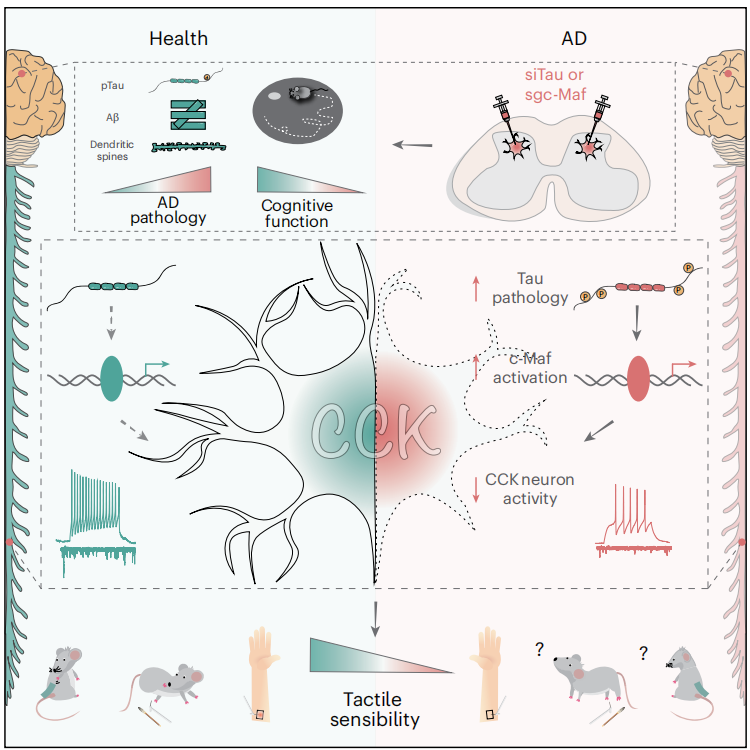
阿尔茨海默病(AD)是全球影响约5000万人的渐进性神经退行性疾病,因人口老龄化患病率激增,现有药物仅能部分延缓早期进展,缺乏有效治疗手段,故亟需发现无创早期诊断标志物。有研究提示AD早期可能存在触觉工作记忆损伤(如角度辨别准确性下降),但触觉缺陷作为AD早期指标的直接证据及机制尚未明确。

2025年11月18日,华中科技大学同济医学院朱铃强/刘丹/鲁友明教授团队在Nature Neuroscience上发表题为“Spinal cord Tau pathology induces tactile deficits and cognitive impairment in Alzheimer’s disease via dysregulation of CCK neurons”研究论文,聚焦AD中触觉缺陷与认知障碍的关联机制,发现 AD 患者及 AD 模型小鼠存在触觉功能损伤,且损伤程度与蒙特利尔认知评估(MoCA)评分呈负相关、与脊髓Tau病理呈正相关;并证实脊髓中异常高磷酸化的Tau通过激活转录因子c-Maf,从而抑制CCK神经元的活性,为AD早期诊断(以触觉缺陷为无创生物标志物)和治疗(靶向Tau或c-Maf)提供新方向。
华中科技大学同济医学院朱铃强教授,刘丹教授和鲁友明教授为论文通讯作者。华中科技大学同济医学院基础医学院周杨博士后、李文恋博士和刘志强博士为论文共同第一作者。同时感谢波士顿大学满恒业教授,辛辛那提儿童医院郭子园教授,武汉科技大学曾燕教授,中国人民解放军总医院贾建军教授和张红红教授团队的支持和指导。该研究得到“科技创新2030-脑科学与类脑科学”重大专项,国家自然科学基金,青年拔尖人才支持计划,华中科技大学学术前沿青年团队和湖北省自然科学基金杰出青年项目,昌平国家实验室科研任务专项等多个科研基金支持。
研究人员对216名≥65岁参与者(健康对照组HC 93人、轻度认知障碍组MCI 97人、阿尔茨海默病组AD 26人)进行触觉检测,依据蒙特利尔认知评估(MoCA)评分分组(HC 25-30分、MCI 19-24分、AD 0-18分),采用冯・弗雷(Von Frey)刺激前臂,测试无害(0.4g、0.6g)及有害(2.0g、4.0g)机械刺激敏感性(图1a)。结果显示,MCI与AD患者对无害刺激的响应率显著降低,触觉阈值高于HC组,且阈值与MoCA评分呈负相关(图1b-d);但三组对有害刺激的响应无显著差异,视觉模拟评分(VAS,用于评估疼痛强度)与刺激力度正相关(图1e-g)。小腿部位检测结果一致,触觉异常比例为:MCI患者前臂63.9%、小腿66.3%,AD患者前臂73.1%、小腿82.4%,证实MCI与AD患者触觉损伤但痛觉正常。
随后通过行为学实验检测3×Tg转基因AD小鼠(携带APPswe/PSEN1-M146V和MAPT-P301L突变)的轻触觉功能(图1h)。粘性胶带测试中,2-7月龄3×Tg小鼠对背部胶带的响应次数(啃咬、抓挠、抖毛)显著少于野生型(WT)小鼠(图1i);Von Frey刺激足底、轻刷无毛皮肤的测试中,3×Tg小鼠对无害刺激的敏感性持续降低(图1j-k)。3月龄时,68.4%的3×Tg小鼠在三项触觉测试中均异常(图1l),且此时未出现认知障碍及AD相关病理(4月龄后才出现),故选用3月龄小鼠进行后续实验。此外,3×Tg小鼠对有害机械刺激、急性化学性瘙痒、热/冷刺激、急性化学性疼痛的响应均正常,运动协调能力与WT小鼠相当,表明其仅轻触觉感知下降。
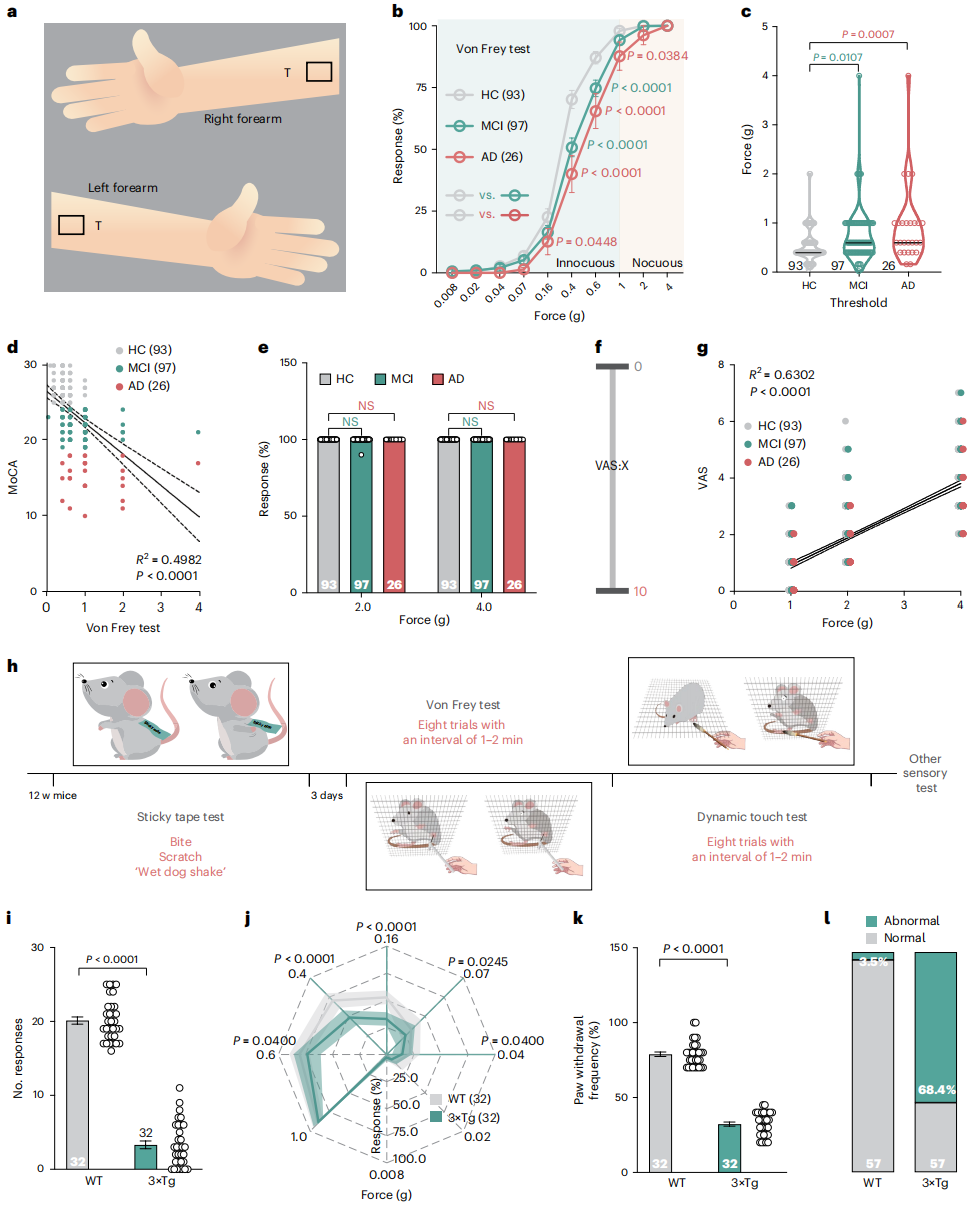
图1 早期AD患者及模型小鼠的触觉缺陷
脊髓是轻触觉信号整合传递至大脑的核心中转站。AD患者脊髓中已发现Aβ沉积与Tau病理共存,首先明确二者在AD早期触觉缺陷中的作用。3×Tg小鼠脊髓前/后角T231、S262等位点Tau磷酸化水平升高,与AD患者脊髓Tau过度磷酸化一致(图2a-b),荟萃分析证实脊髓Tau病理与AD强相关。抗TOC1抗体(一种可特异性识别Tau二聚体及更高阶寡聚体的单克隆抗体)免疫染色显示,AD患者及PS19小鼠(Tau-P301S突变型)脊髓背角III-IV层存在异常Tau聚集(图2c-d),AD患者样本TOC1免疫反应性及Tau聚集水平显著高于其他神经系统疾病(OND)患者(图2e-f)。Tau病理仅局限于脊髓神经元(小胶质细胞/星形胶质细胞无),大脑认知区、皮质脊髓投射通路及外周传入神经中均未检测到,且3×Tg/PS19小鼠脊髓Aβ42、Aβ40及寡聚化Aβ水平与WT小鼠无差异,提示AD早期触觉缺陷由Tau病理而非Aβ沉积导致。
进一步在三种小鼠模型验证:仅含Tau病理的PS19、rTg4510小鼠(Tau-P301L突变型)出现多毛/无毛皮肤触觉脱敏,仅含Aβ沉积的APP/PS1小鼠(APP695swe/PS1-dE9突变型)触觉正常;PS19、rTg4510小鼠脊髓后角存在Tau病理,APP/PS1小鼠无(图2d、g-j),且所有小鼠的痛觉、瘙痒感知及运动协调能力均正常。PS19小鼠定量分析显示脊髓全段Tau磷酸化(T231、S262等)及总Tau水平升高(图2g-j),通过加权公式定量Tau病理(pTau)值,与粘性胶带、Von Frey及动态触觉测试结果呈负相关(图2k-n),证实脊髓Tau病理是AD模型小鼠触觉异常的关键诱因。
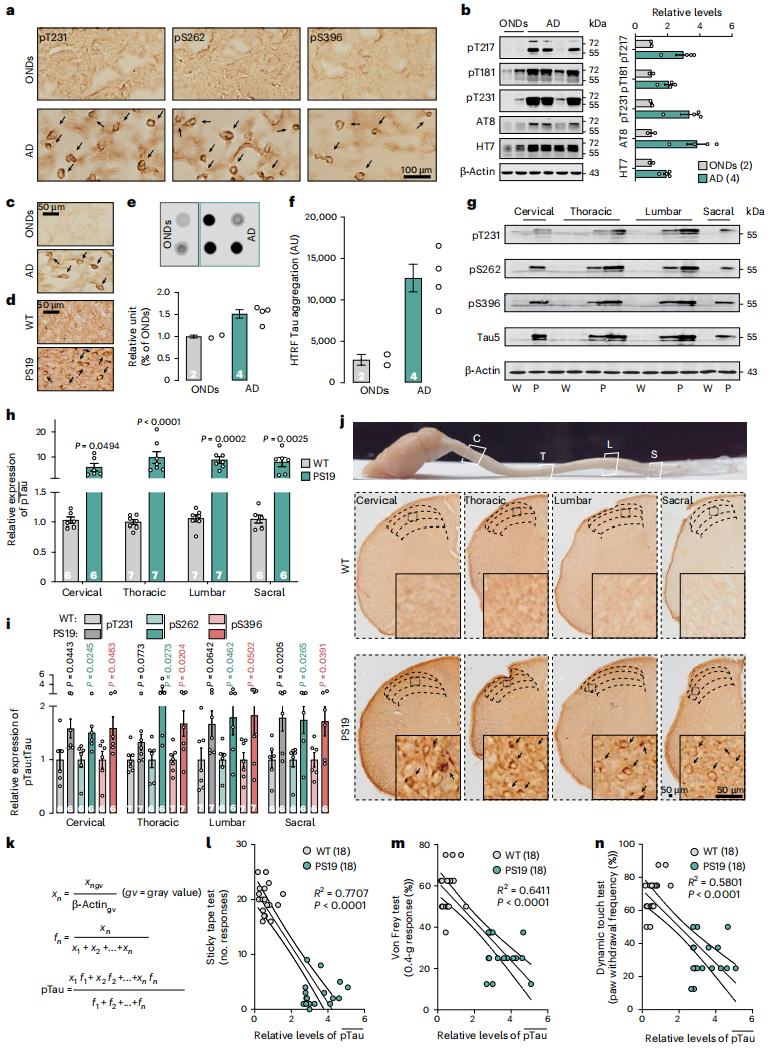
图2 PS19小鼠脊髓中Tau蛋白病理改变与触觉缺陷相关
为了探究Tau病理损害触觉的机制,研究对PS19小鼠与WT小鼠腰段脊髓(L1-L4)背角进行单核RNA测序(snRNA-seq),识别出8种谷氨酸能神经元、7种GABAergic神经元及7种非神经元细胞,两类小鼠细胞比例无差异(图3a)。借助AUCell工具计算神经原纤维缠结(NFT)相关基因(NRG)转录组变化,发现神经元NRG表达高于非神经元细胞(图3b),且PS19小鼠中NRG异常在CCK、PKCγ(Prkcg编码)、Meis2表达神经元中最显著(图3b-c),其他神经元(如PKCγ)呈分散异常。PS19小鼠与AD患者的CCK神经元中,T231、S262位点及AT8(pS202/pT205)位点Tau过度磷酸化水平显著高于其他神经元(图3d),且该Tau病理富集于脊髓背角IIiv-IV层(无害触觉信号整合传递关键区)(图3e)。c-FOS标记显示,PS19小鼠该层神经元在触觉测试中活性降低(图3f-i),且CCK神经元等6类神经元的活性调节基因(ARG)表达下调最显著(图3j),但暂无法确定CCK神经元中Tau病理是NRG异常与ARG下调的直接原因。
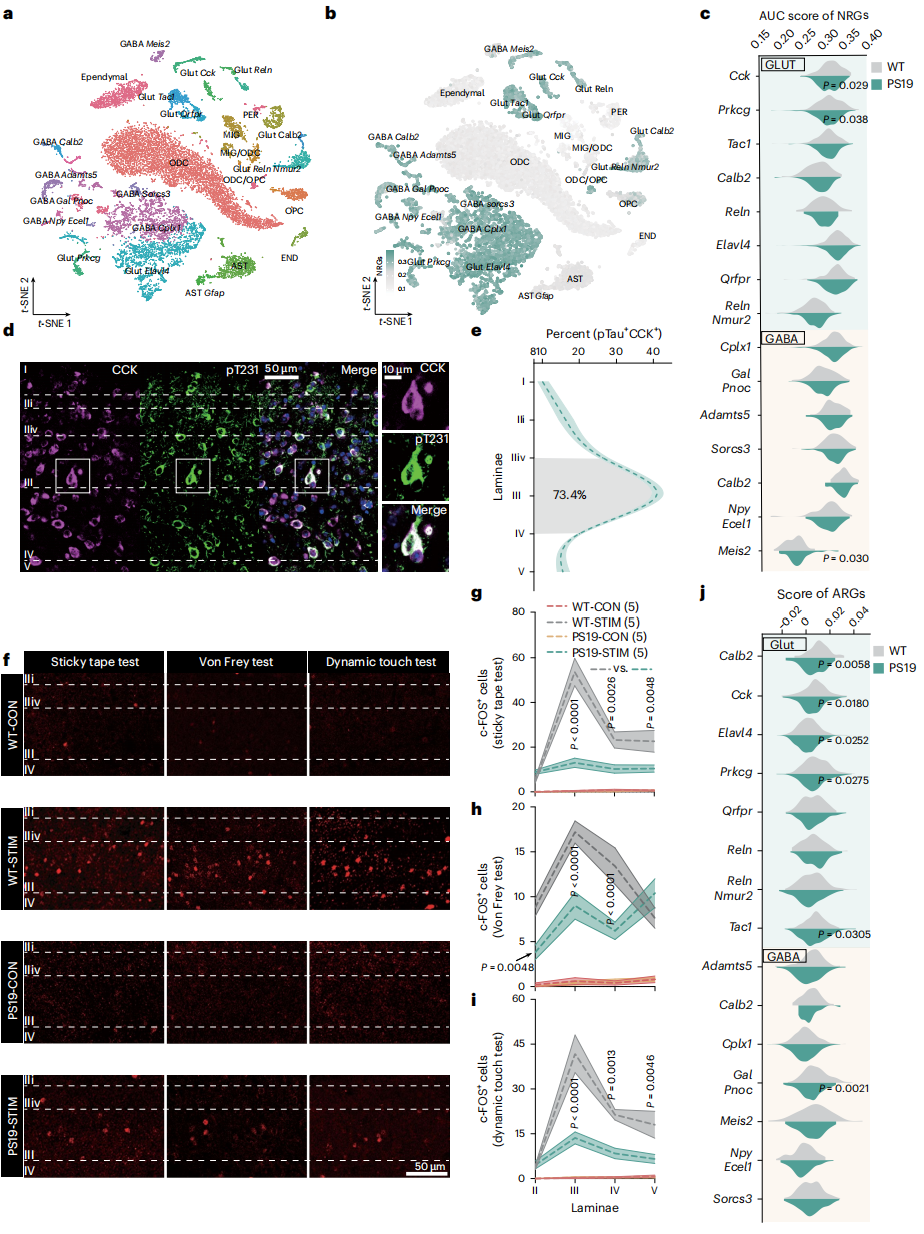
图3 Tau病理学使AD中脊髓CCK神经元失活
为了观察自由活动小鼠脊髓CCK神经元活性,研究将CCK-Cre与PS19小鼠杂交获得PS19;CCK-Cre小鼠,向其与CCK-Cre小鼠脊髓后角注射rAAV9-hSyn-DIO-jGCaMP8s病毒,使钙指示剂jGCaMP8s特异性表达于CCK神经元。钙成像显示,CCK神经元可被Von Frey刺激激活(图4a-b)。随后向PS19;CCK-Cre小鼠脊髓背角双侧注射rAAV2/9-hSyn-DIO-sihTau-mCherry(siTau,Tau沉默病毒)或对照病毒mCherry(图4c),结果显示沉默Tau可完全恢复其粘性胶带、Von Frey及动态触觉测试表现(图4d-f)。电生理记录证实,siTau小鼠CCK神经元的自发兴奋性突触后电流(sEPSC)振幅与频率均较对照小鼠恢复(图4g-k),符合突触前囊泡释放及突触后结构修复特征,且其他感觉模态不受影响。上述数据表明,脊髓后角CCK神经元因Tau病理失活是AD触觉功能障碍的诱因之一。综上,特异性抑制脊髓CCK神经元中的Tau病理,或为恢复AD患者触觉感知及突触功能的潜在策略。
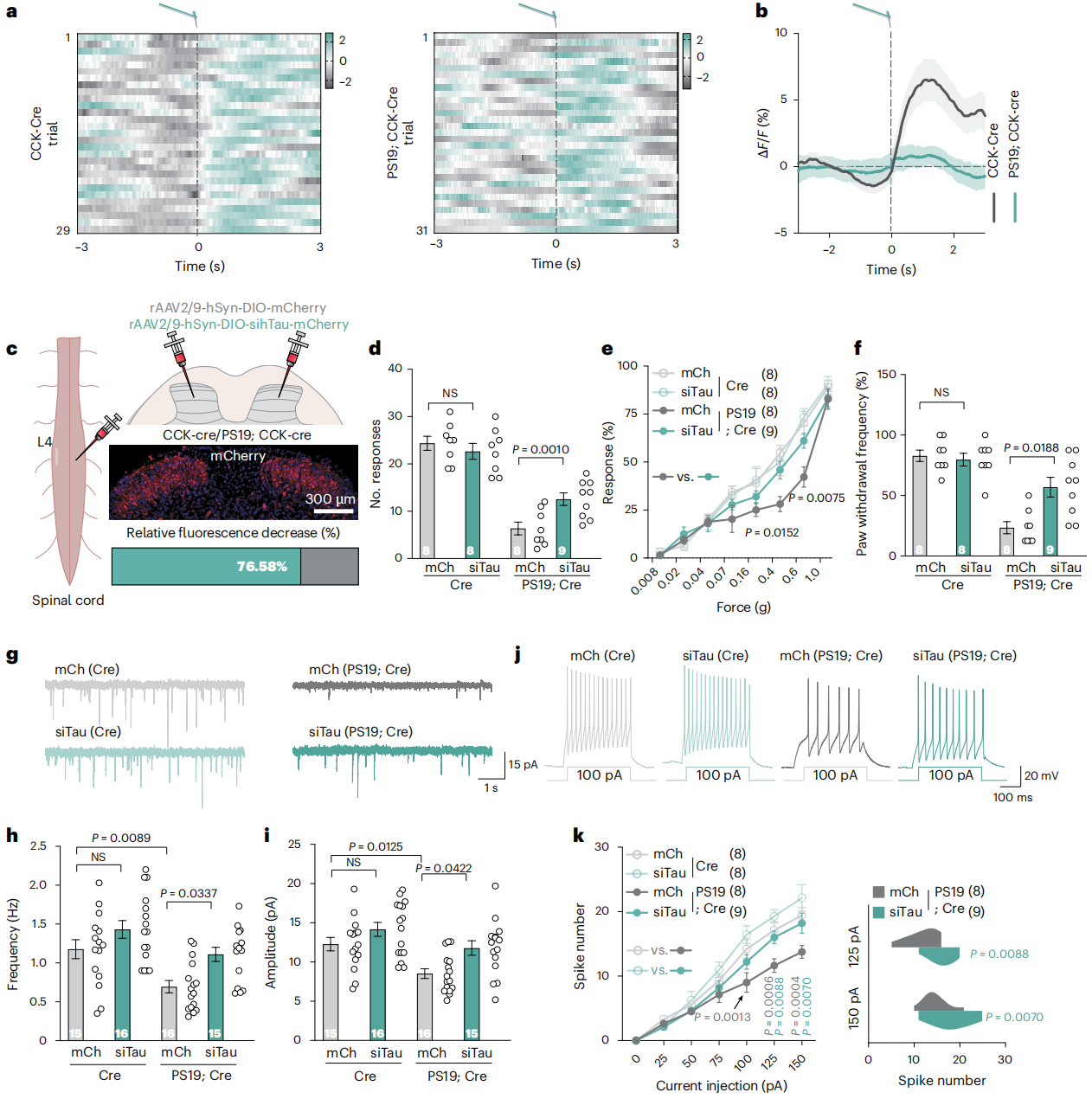
图4 沉默CCK 神经元中Tau可恢复AD的触觉
针对PS19小鼠脊髓CCK神经元活性降低的现象,研究向PS19;CCK-Cre小鼠脊髓双侧注射Cre依赖型rAAV2/9-hSyn-DIO-hM3D(Gq)-eGFP病毒,使hM3D(Gq)特异性表达于CCK神经元(图5a)。给予CNO激活该神经元后,小鼠触觉响应部分改善(图5b-i),且不影响其他感觉及运动功能(图5j-s)。
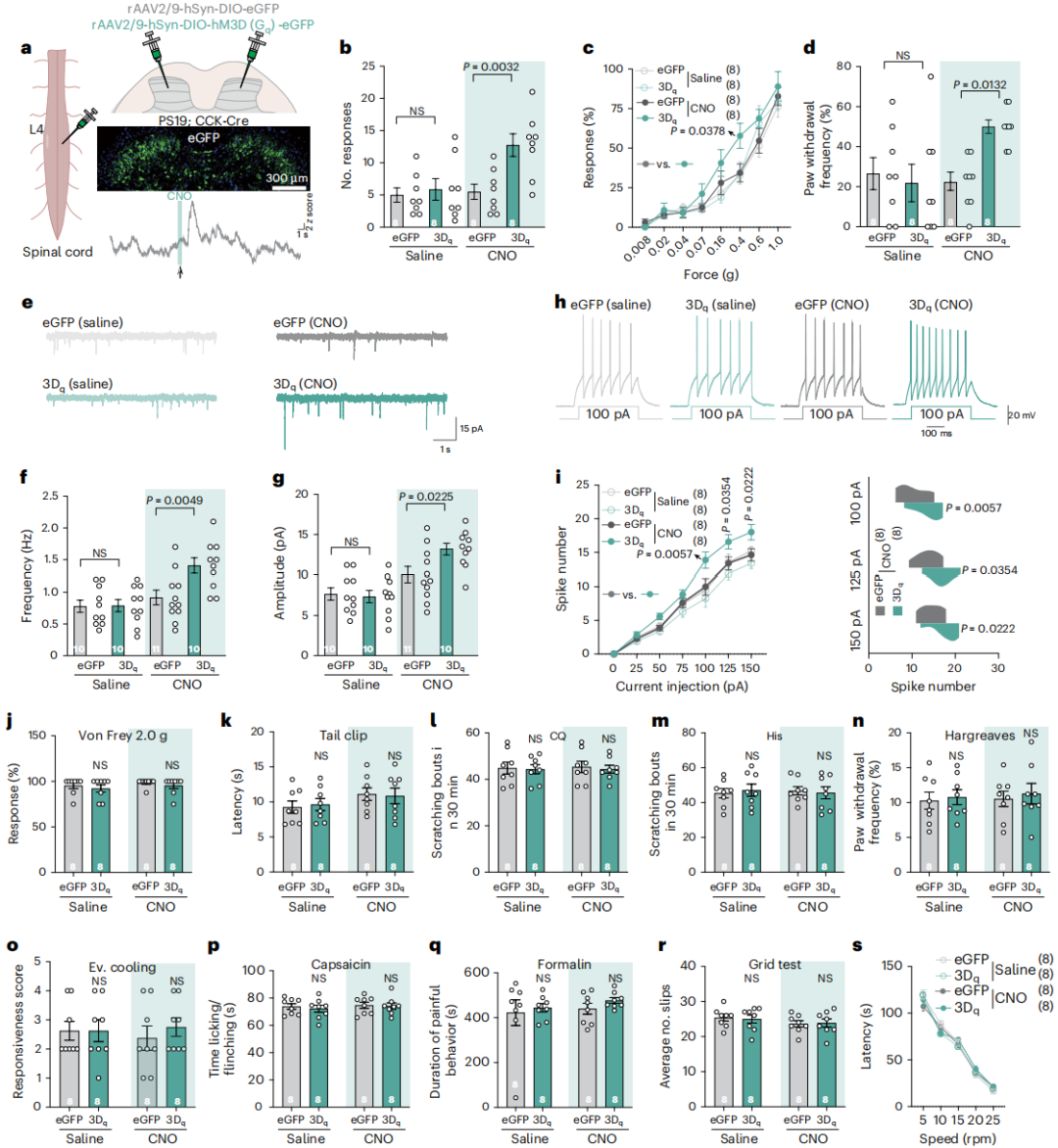
图5 化学遗传学激活CCK神经元可逆转了AD小鼠的触觉损伤
为了探究机制,分析snRNA-seq数据发现CCK神经元中多个活性及突触相关基因异常,通过Python单细胞调控网络推断与聚类(pySCENIC)流程筛选出10个关键调控子(图6a-c),其中c-Maf因以下特性成为核心靶点:(1)参与感觉神经元及脊髓背角III/IV层神经元发育;(2)调控子在CCK神经元中高度富集;(3)PS19小鼠与AD患者脊髓背角IIiv-IV层CCK神经元中c-Maf表达升高(图6d);(4)与pTau水平正相关(图6e);(5)调控皮质网络兴奋性。进一步证实,c-Maf转录调控Dlg2、Nrn1等活性相关基因,而这些基因在PS19小鼠脊髓CCK神经元中存在异常表达(图6f-h),且Tau病理可调控c-Maf及其下游靶标表达。为了进一步明确c-Maf在AD小鼠触觉缺陷中的关键作用,向PS19;CCK-Cre小鼠注射靶向c-Maf的dCas9-KRAB/sgRNA慢病毒(图6i),可恢复其触觉测试表现(图6j-l)及CCK神经元sEPSC振幅与频率(图6m-q),且不影响其他感觉及运动。综上,抑制脊髓后角CCK神经元中的c-Maf可恢复触觉感知与突触功能,证实其在Tau病理诱导的AD触觉缺陷中起关键作用。
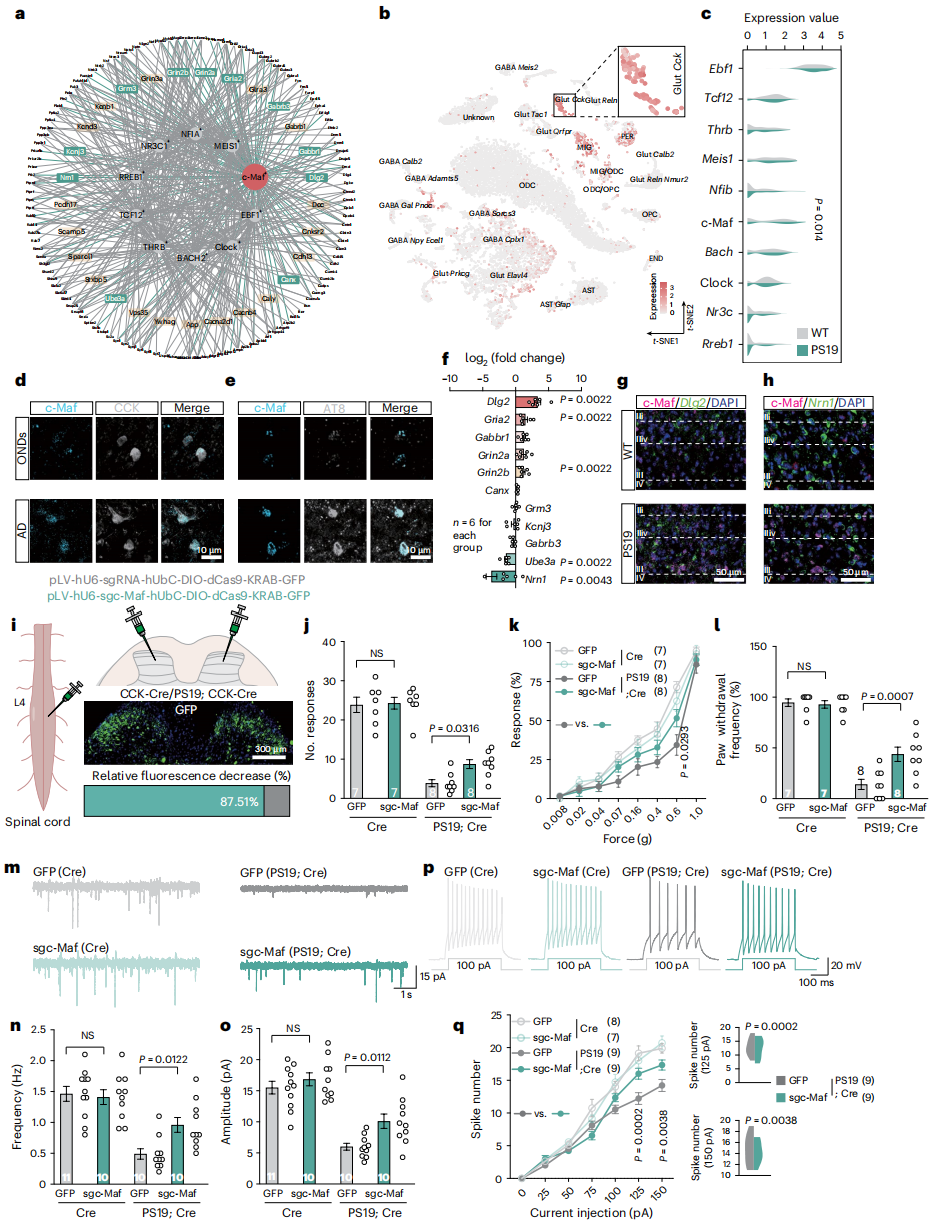
图6 CCK神经元中c-Maf调控子介导Tau病理学诱导的触觉缺陷
已证实脊髓CCK神经元中Tau病理及Maf转录诱发触觉缺陷,研究进一步探究其与AD进展的关联:3月龄3×Tg小鼠按触觉表现分为正常组(NRM)和异常组(ABN)(图1l),6月龄时ABN组在莫里斯水迷宫和巴恩斯迷宫测试中认知表现更差(图7a-d),旷场与高架十字迷宫行为无差异;且ABN组海马区树突棘密度降低、Tau病理更重、Aβ斑块更多(图7e-g),证实触觉缺陷与AD进展密切相关。
为了验证早期干预触觉损伤的作用,将CCK-Cre与3×Tg小鼠杂交获得3×Tg;CCK-Cre小鼠,3月龄时向脊髓CCK神经元注射siTau病毒,结果显示其粘性胶带、Von Frey及动态触觉测试响应完全恢复(图7h-j),6月龄时莫里斯水迷宫和巴恩斯迷宫表现更优(图7k-n),12月龄时海马区树突棘密度升高、pTau强度降低、Aβ斑块减少(图7o-q)。感染c-Maf沉默病毒(sgc-Maf)的CCK-AD小鼠也呈现类似改善效果(图7r-aa)。构建更接近生理的模型,向3月龄Mapt(编码Tau蛋白的基因)敲除的CCK-Cre小鼠脊髓注射含人源野生型Tau(1N4R亚型,模拟Tau病理沉积)的AAV,2个月后出现触觉异常,3个月后出现学习记忆缺陷;相同模型过表达c-Maf也出现类似效应。综上,特异性沉默脊髓CCK神经元中的Tau或c-Maf干预触觉缺陷,可有效延缓AD进展。
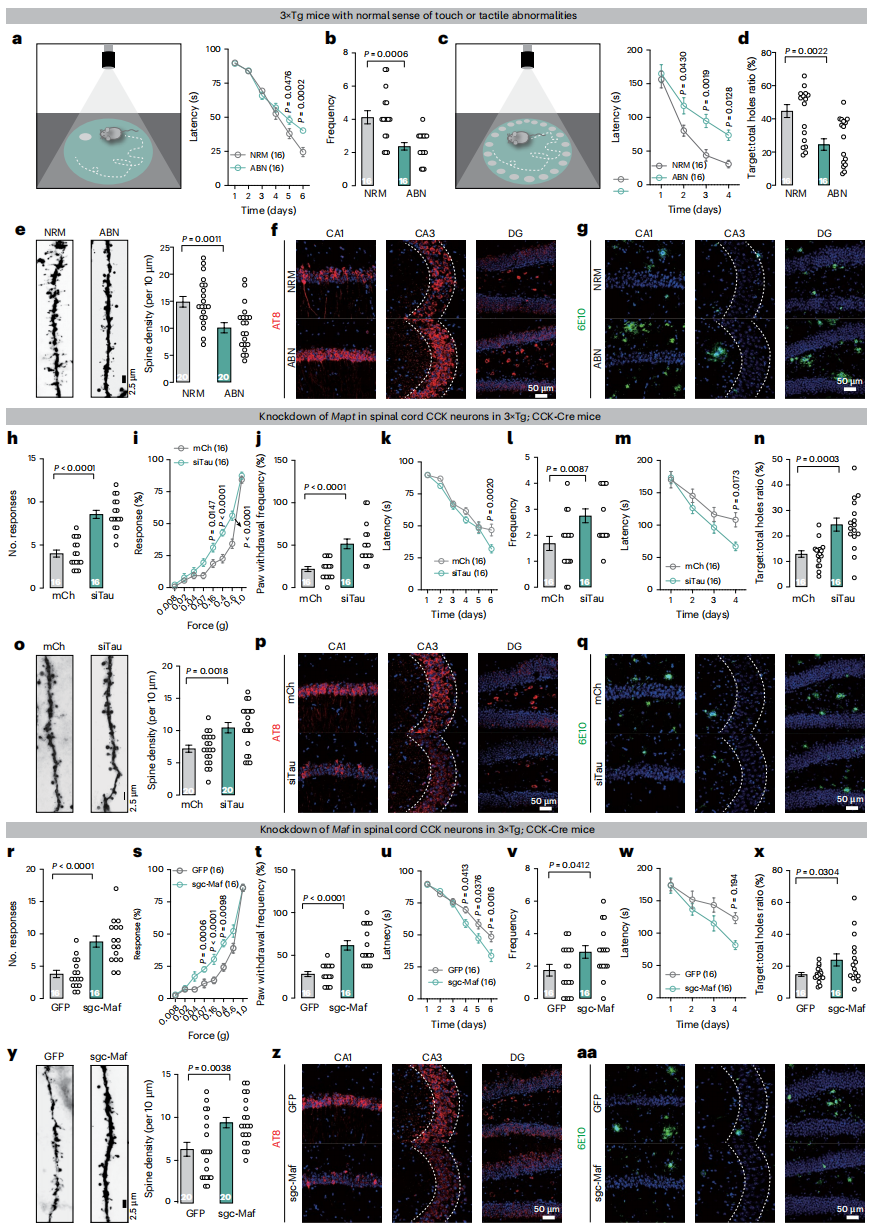
图7 沉默CCK神经元中Tau或c-Maf可延缓AD的进展
AD中,脊髓CCK神经元的Tau病理通过异常激活c-Maf,抑制神经元活性和突触传递,进而导致触觉缺陷和认知障碍,形成“外周感官损伤-中枢认知障碍”的关联通路。触觉阈值可作为AD认知障碍进展的无创生物标志物,其与MoCA评分的高相关性为临床早期筛查提供依据。靶向脊髓CCK神经元中的 Tau或c-Maf,可同时改善触觉缺陷和认知障碍,为AD治疗提供了“外周干预中枢”的新策略,避免直接作用于大脑可能的副作用。
本文使用的工具病毒布林凯斯均可提供:
同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。