2025年9月22日,浙江中医药大学陈忠教授团队在Nature Neuroscience上发表了文章“A bottom-up septal inhibitory circuit mediates anticipatory control of drinking”,该研究揭示小鼠体内存在一条从内侧隔核(MS)到穹窿下器(SFO)的抑制性神经通路,该通路由MS的γ-氨基丁酸(GABA)能神经元(MSᵛᴳᴬᵀ神经元)主导,通过整合口腔信号与胃肠道信号编码水饱足信号。口腔信号解决 “饮水节奏”问题(避免喝太快),胃肠道信号解决“饮水总量”问题(避免喝太多)——二者结合,既防止短时间过量摄入,又能精准判断“何时该停”,完美匹配“预期性调控”需求。

该研究的第一作者为浙江中医药大学的博士后徐玲钰,浙江大学硕士研究生孙瑜浩、新加坡国立大学黄陈元博士以及浙江中医药大学郑艳榕研究员为共同第一作者,浙江中医药大学陈忠教授为本研究通讯作者。本研究也得到了浙江中医药大学汪仪研究员、浙江大学药学院廖杰研究员的支持与指导。
鉴于SFO是饮水调控的“渴觉中枢”,且其瞬时反应与饮水行为存在时间关系,首先探究其上游输入。逆行示踪显示多个脑区向SFO发送单突触输入,与既往研究一致。随后利用TRAP2转基因小鼠,通过FosTrap实验(注射4-羟基他莫昔芬),对脱水、复水状态下SFO上游脑区神经元进行c-Fos标记,实现特定刺激激活神经元的永久性基因追踪(图1a-b)。在SFO传入图谱中,MS的Fos⁺神经元在水饱组、渴觉组均增加,但分属MS不同亚群且均投射至SFO。关键是,与笼养对照组相比,水饱组MS区激活倍数最高(图1c-d);既往数据也证实,MS是终板层外向SFO提供输入的主要脑区。为了明确响应水饱信号的神经元类型,原位杂交实验显示:水饱小鼠的MSᵛᴳᴬᵀ神经元被明显激活(图1e-f),提示其可能编码水饱信号并参与终止饮水。这与早期研究一致——哺乳动物中MS对水饱感知至关重要,损毁隔区会导致剧渴症,表现为渴觉亢进、液体摄入过量。
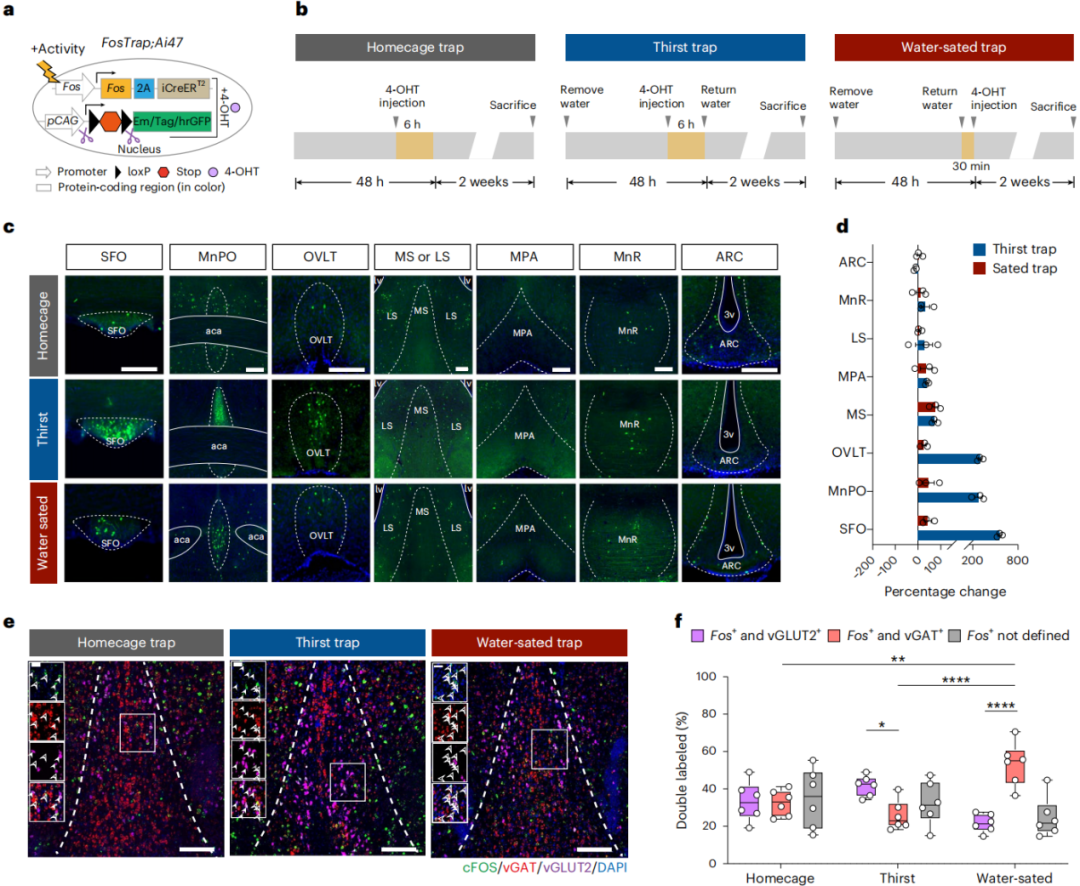
图1 MS神经元的激活剖面对体液变化有反应
目前认为,饮水快速预期反应含两环节:一是实时追踪,检测口腔内液体摄入情况;二是延迟信号,作为次级反馈机制,可能由外周输入(如机械牵拉信号、渗透压感受器信号)产生。但这些预系统信号(指尚未引发体液稳态(如血渗透压、血容量)变化,却能提前调控饮水行为的外周信号)与中枢的连接通路尚不明确。光纤记录与双光子成像结果表明,MSᵛᴳᴬᵀ神经元或在整合不同预系统信息并传至SFO中起重要作用。
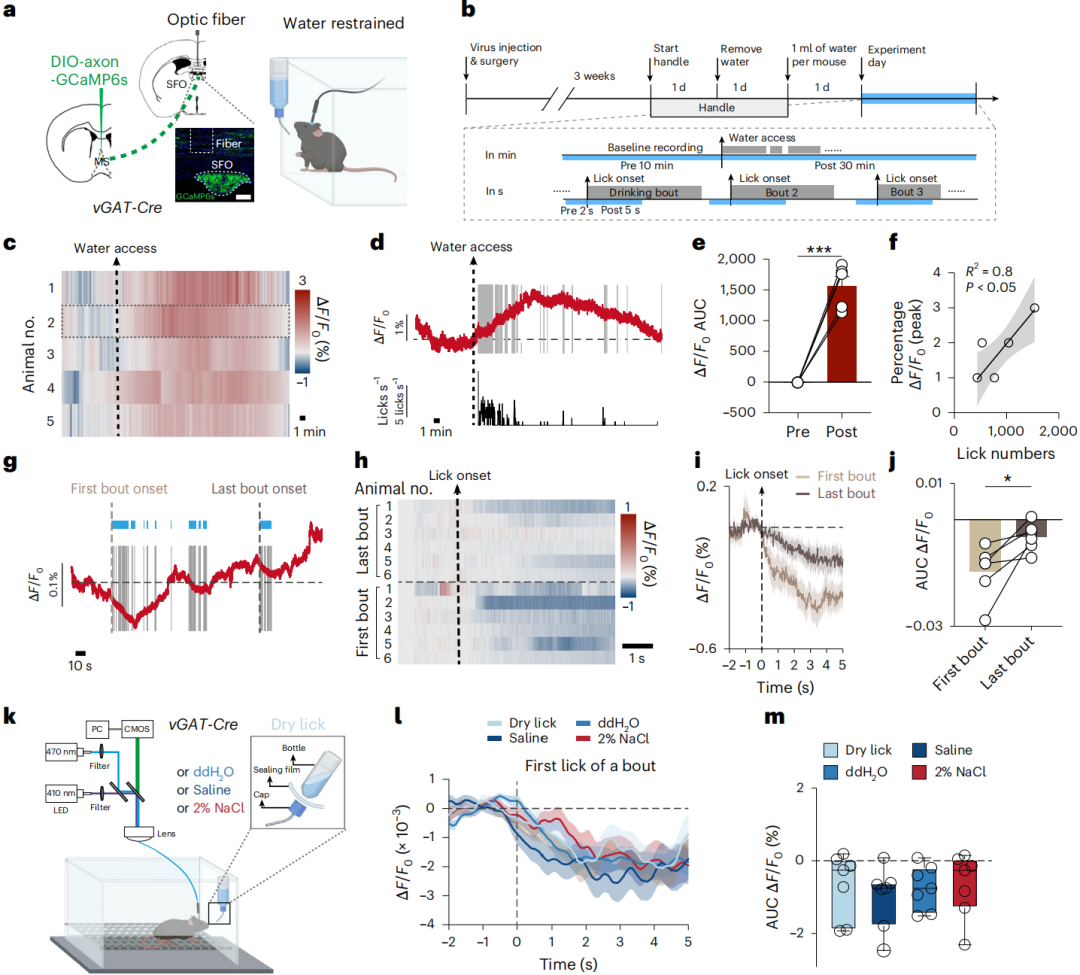
图2 MSvGAT-SFO电路整合了口咽和稳态信号的层次
基于MSᵛᴳᴬᵀ-SFO通路活性与饮水行为的时间关联,采用光遗传学选择性操控该通路,探究其因果调控作用。在禁水小鼠中刺激该通路(模拟饮水时的渐进激活模式,图3a),可使主动饮水小鼠几乎瞬时停止饮水,不影响运动能力且有轻微抗焦虑效应(图3b-d、g),且效应具有饮水特异性——不抑制禁食小鼠对蔗糖的摄入(图3c、e)。为了明确向SFO投射的MSᵛᴳᴬᵀ神经元如何缓解禁水小鼠的渴觉,开展了实时位置偏好(RTPP)实验。渴觉本身是一种固有的厌恶状态,通过“驱力降低”机制驱动饮水,脱水小鼠在“光刺激区域(激活MSᵛᴳᴬᵀ神经元)”的停留时间显著长于无刺激区域,且主动进入光刺激区域的次数更多。当小鼠喝饱水后,重复相同实验,发现:小鼠在“光刺激区域”和“无刺激区域”的停留时间基本持平,进入两侧区域的次数也无显著差异(图3f)。综上,脱水状态下,投射至SFO的MSᵛᴳᴬᵀ神经元传递正效价信号,水饱状态下该信号消失。
进一步以“OFF–ON–OFF”光周期抑制SFO内MSᵛᴳᴬᵀ轴突活性(图3h),30分钟实验显示:水饱小鼠在光开启阶段(通路被抑制)的舔舐次数显著多于光关闭阶段(图3i-k),且不影响蔗糖摄入、旷场实验中的焦虑水平与运动能力(图3j、l、n)。此外,光抑制MSᵛᴳᴬᵀ-SFO通路时,水饱小鼠接收负效价信号,禁水小鼠则无(图3m),表明通路通过“状态依赖的效价转换”介导饮水行为——活性增强产生愉悦感、缓解渴觉厌恶以终止饮水,活性降低则“鞭策”水饱小鼠饮水以缓解“假性渴觉”。这些数据共同证明,MS-SFO这一抑制性通路可调控饮水行为。
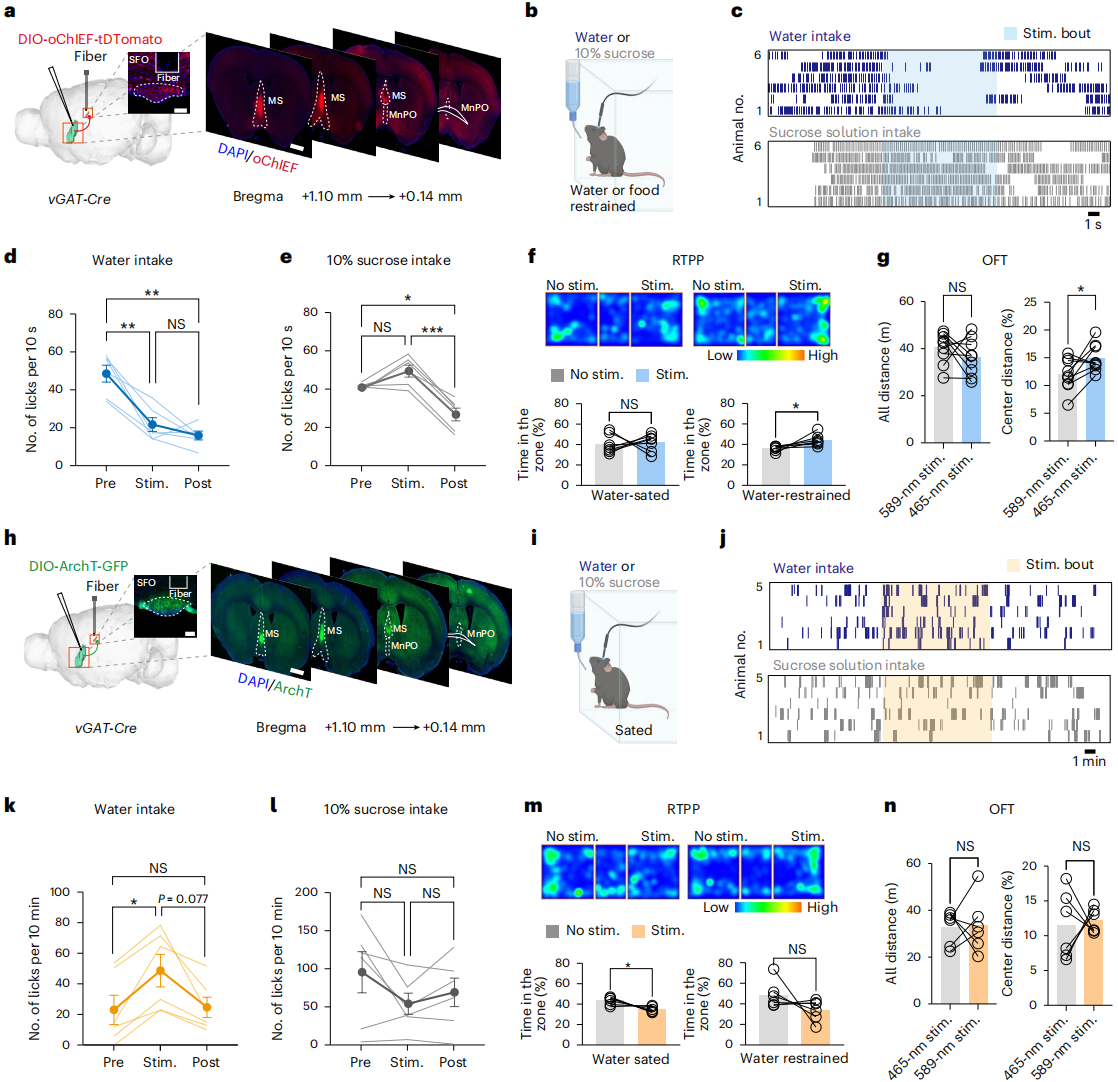
图3 MSᵛᴳᴬᵀ-SFO通路以状态依赖方式调控饮水行为
为了明确该饮水调控通路的下游细胞类型,首先采用RV跨单突触示踪(图4a):逆行标记显示,SFO中SFOCaMKII神经元主要接收MSᵛᴳᴬᵀ神经元投射(图4b-c),而SFO的GABA能神经元(SFOᵛᴳᴬᵀ神经元)主要受MS谷氨酸能神经元支配。结合ChR2光遗传与电生理记录,验证了MSᵛᴳᴬᵀ与SFOCaMKII神经元的单突触连接(图4d)。向MSᵛᴳᴬᵀ神经元注射Cre依赖的mWGA-mCherry顺行示踪,发现SFO内mCherry标记的突触后神经元基本共表达CaMKII,且多数为胆囊收缩素(CCK)阳性亚群——该亚群已知可通过舔舐快速激活防过量饮水。光纤记录也显示,舔舐时受MSᵛᴳᴬᵀ支配的SFOCaMKII神经元整体荧光升高。
为了证实功能连接,在vGAT-Cre小鼠中,将ChrimsonR-mCherry转导至MSᵛᴳᴬᵀ神经元,并在SFO表达CaMKII-GCaMP6s(图4e)。在体光刺激MSᵛᴳᴬᵀ神经元后,SFOCaMKII神经元活性显著降低,SFOᵛᴳᴬᵀ神经元无变化(图4f-g),支持“MS向SFOCaMKII神经元传递GABA能抑制性输入”。为了验证激活SFOCaMKII神经元是否能逆转MSᵛᴳᴬᵀ-SFO通路激活所诱导的饮水抑制效应,在脱水状态下化学遗传学激活SFOCaMKII神经元,同时光遗传激活MSᵛᴳᴬᵀ-SFO通路(图4h)。结果显示,SFOCaMKII激活完全消除了该GABA能通路光刺激引发的饮水抑制效应(图4i-j),有力证明SFOCaMKII神经元是MS区GABA能通路调控饮水行为的下游核心组件。
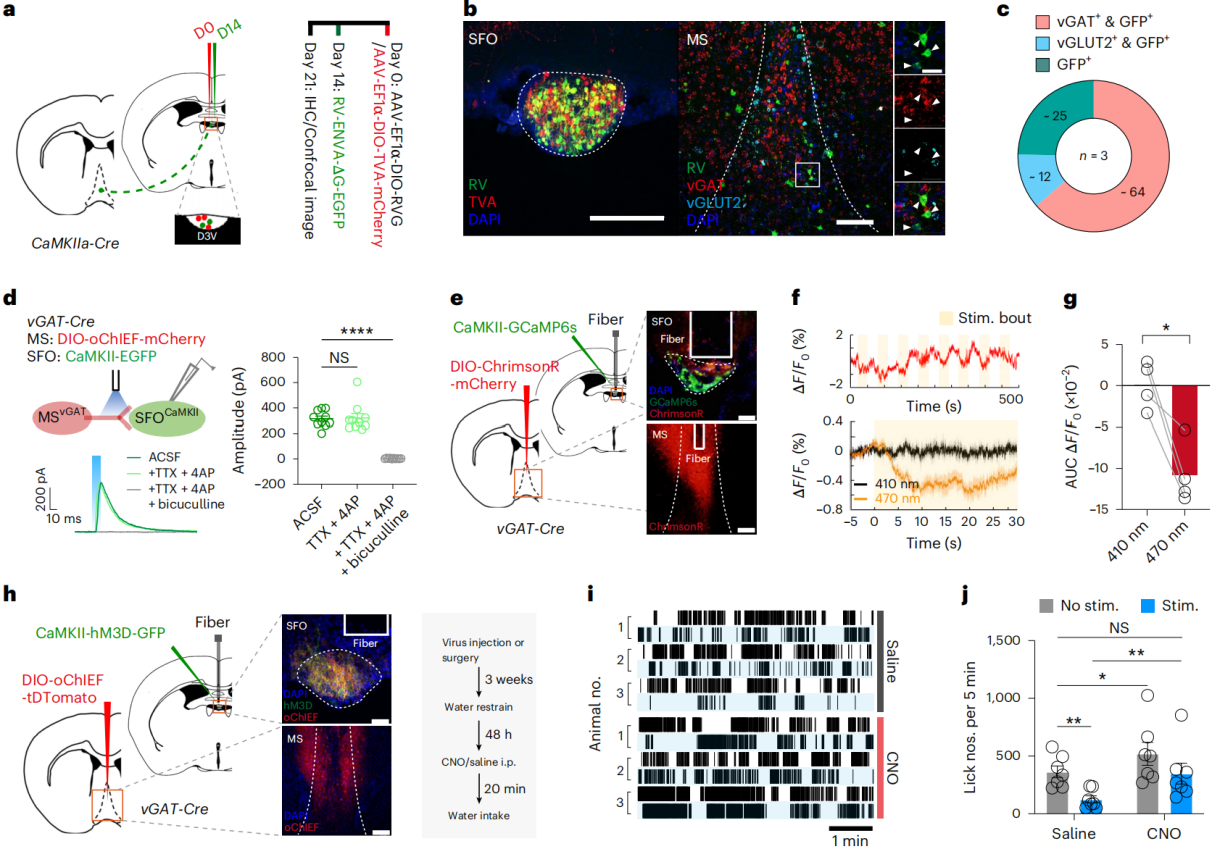
图4 MSᵛᴳᴬᵀ-SFO通路的细胞和生理基础
若MSᵛᴳᴬᵀ神经元对水饱足前置信号传递至关重要,阻断其功能应干扰水饱足感知。为此,通过靶向表达破伤风毒素轻链(TetTox),构建MSᵛᴳᴬᵀ神经元突触传递基因沉默小鼠模型:向MS注射Cre依赖型TetTox腺相关病毒,向SFO注射CaMKII-GCaMP6s(图5a)。检测基础生理功能发现,与mCherry对照组相比,TetTox小鼠的每日食物/饮水摄入、运动能力均无异常(图5g-h);但小鼠饮水时SFOCaMKII神经元活性动态显著减弱(图5b)。值得注意的是,TetTox小鼠饮水回合次数与对照组相当(图5f),但总舔舐次数显著增加(图5c-d);具体表现为通过延迟饮水过程终止(而非改变启动)导致舔舐次数增多(图5e-f)。结果证实:MSᵛᴳᴬᵀ神经元可传递抑制饮水的信号,沉默该神经元会削弱小鼠对水饱足的感知。
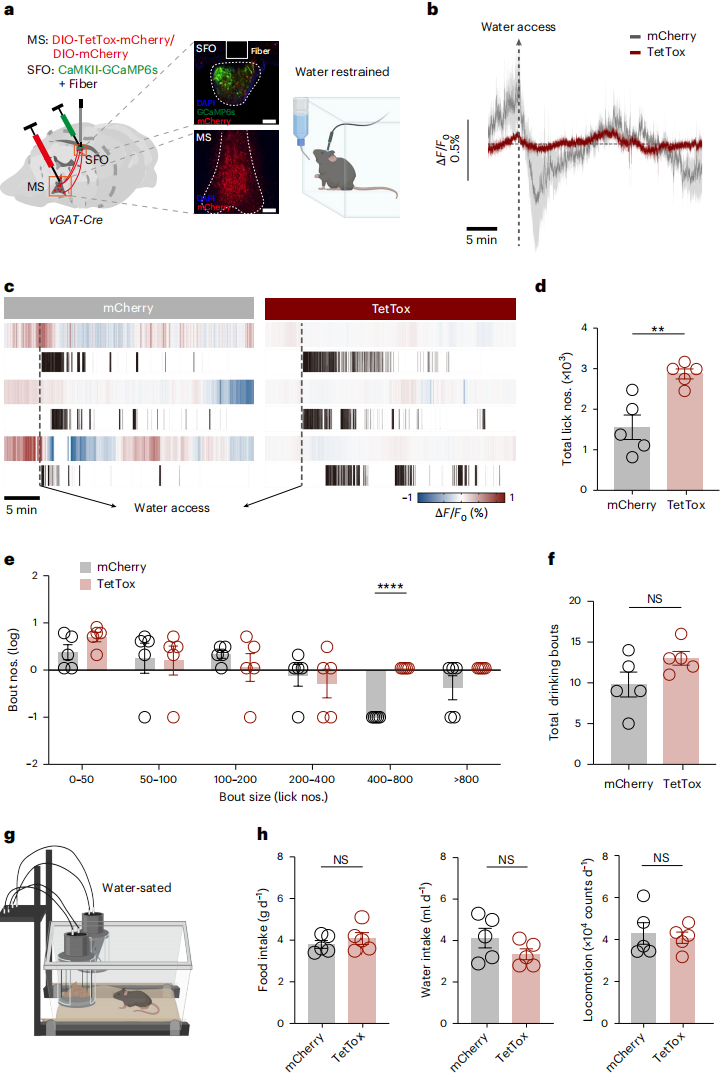
图5 抑制MSvGAT神经元会削弱SFOCaMKII神经元对水的饱腹感反应
为了探究MSᵛᴳᴬᵀ神经元接收预系统信号的机制,首先RV逆向跨单系统绘制其单突触输入图谱,结果显示MSᵛᴳᴬᵀ神经元接收海马体、下丘脑室旁核、中脑导水管周围灰质及后脑臂旁核(PBN)等多脑区输入,与既往研究一致。进一步对向SFO投射的MSᵛᴳᴬᵀ神经元进行跨突触示踪,发现输入神经元仅存在于PBN(以PBNᵛᴳᴸᵁᵀ²神经元为主)(图6a-b);结合ChR2通路作图与电生理记录,证实二者存在单突触连接(图6c)。已知外侧PBN是端脑上行信号关键节点,且参与饮水调控。为了验证PBN是否通过向MSᵛᴳᴬᵀ神经元传递预系统信号调控饮水,结合含hSyn-mWGA-Cre的顺行病毒与光遗传学,操控PBN-MS-SFO通路(图6d),结果发现光刺激激活SFO内受PBN支配的MS神经元投射时,可抑制渴觉小鼠大量饮水(图6e-f)。
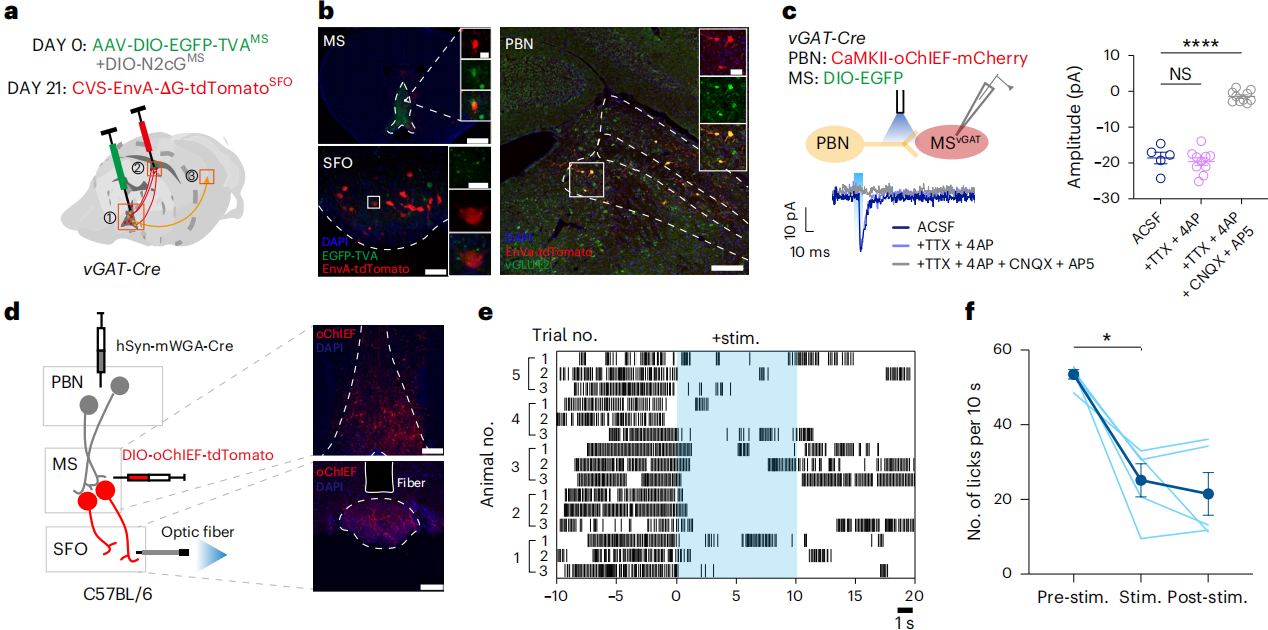
图6 激活PBN-MS-SFO可抑制渴觉小鼠大量饮水
为了明确通路是否传递预系统信号,化学遗传学沉默PBN(图7g-h),经 CNO抑制PBN神经元后,无论长期或短时饮水,SFO内MS神经元轴突均无响应(图 7i-l)。结合此前实验(图5)“沉默 MSᵛᴳᴬᵀ神经元致小鼠饮水增加、渴觉饱足受损”,提出假设:接收PBN投射的MSᵛᴳᴬᵀ神经元功能异常或致低钠血症。选择性消融该类神经元(图7m),检测渴觉小鼠饮水后0-90分钟血浆指标:Casp3处理组30分钟后血浆渗透压与Na⁺显著下降,且30-90分钟内Na⁺始终低于生理范围,呈严重低钠血症(图7n-o)。此外,沉默MnPO区GLP1r神经元虽也致小鼠多饮,但仅表现为过量摄入生理盐水,与MS区GABA能神经元调控差异显著,表明二者在渴觉饱足调控中作用不同。综上,PBN可将口腔咽腔与胃肠道信号传递至向SFO投射的MSᵛᴳᴬᵀ神经元,为饮水行为预期性调控提供支持。

图7 PBN将口咽和胃肠道信号传递给投射到SFO的MSvGAT神经元
文章研究发现PBN→MSᵛᴳᴬᵀ→SFOCaMKII通路是整合外周预系统信号、实现预期饮水调控的关键通路,其功能异常会破坏体液平衡。首次揭示“自下而上”的隔核抑制通路在预期饮水调控中的作用,阐明口腔-胃肠道信号整合的神经机制,补充了SFO调控饮水行为的网络(此前已知MnPOᴳᴸᴾ¹ʳ、局部SFOᵛᴳᴬᵀ通路)。该通路为糖尿病相关多饮症、精神分裂症相关多饮症等“异常饮水疾病”提供潜在治疗靶点。
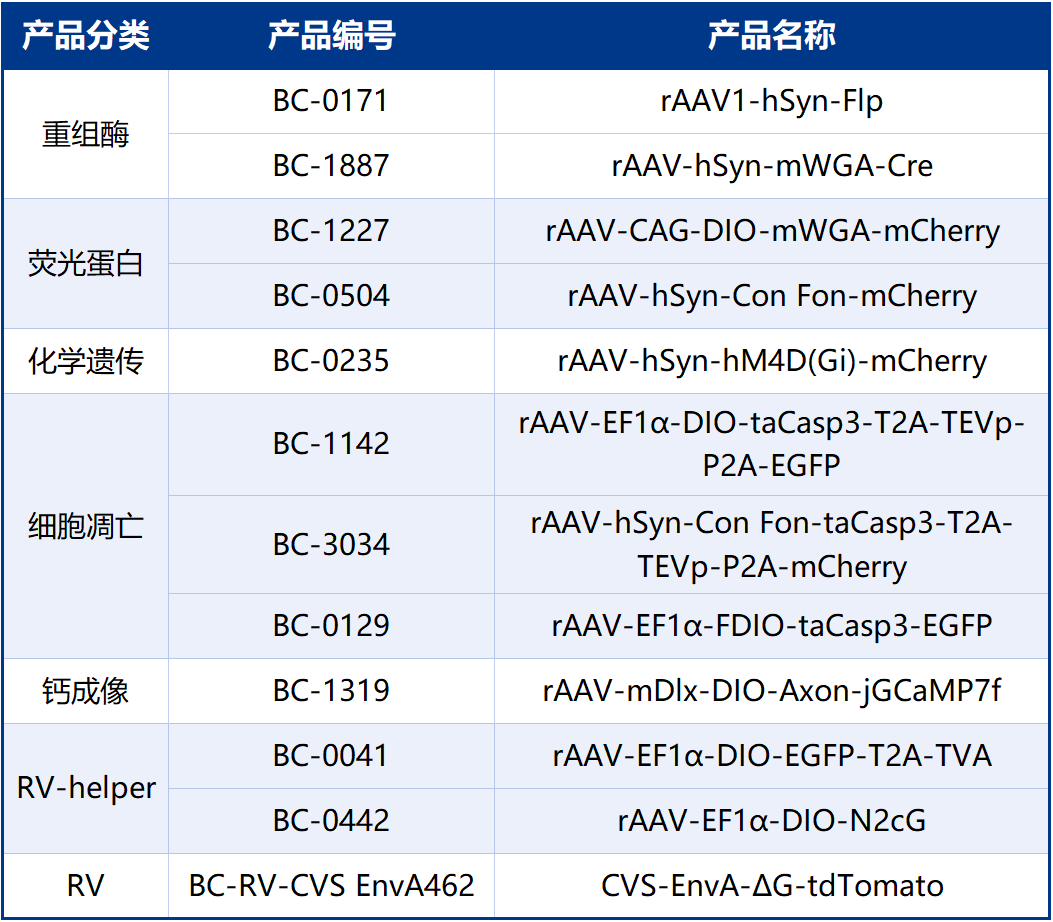
本文使用的工具病毒均由布林凯斯提供如下:
同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。