急性肺损伤(ALI)及进展的急性呼吸窘迫综合征(ARDS)是高发病率、高死亡率且缺乏有效治疗手段的严重肺部炎症性疾病,肺部炎症反应机制复杂,神经免疫相互作用对维持肺部稳态关键但特定脑区调控肺部炎症的机制不明。

2025年10月6日,中南大学湘雅二医院戴茹萍/李卉研究团队在Nature communications杂志发表了题为“Paraventricular nucleus CRH neurons regulate acute lung injury via sympathetic nerve–neutrophil axis”的研究论文。该研究以雄性小鼠为模型,经解剖追踪、化学遗传学调控及药物干预,发现ALI期间一条下丘脑室旁核CRHᴾⱽᴺ神经元-肺神经回路,激活该神经元可保护小鼠ALI、提升存活率并减少肺部中性粒细胞浸润,抑制则加重ALI。该保护作用由交感神经活性增强实现,局部释放去甲肾上腺素经β2-肾上腺素受体-β-arrestin2信号调控中性粒细胞功能,抑制NF-κB通路。这一发现为解析中枢神经系统主动调控ALI的机制提供了关键理论支撑,也为ALI及ARDS治疗靶点开发提供新思路。

CRHᴾⱽᴺ神经元激活缓解ALI机制示意图
中南大学湘雅二医院为论文第一作者单位,戴茹萍教授、李卉副主任医师为共同通讯作者,李卉副主任医师及刘涛博士为共同第一作者。本课题得到了国家自然科学基金(U24A20684,82371292,82271430)、湖南省自然科学基金以及中南大学研究生创新项目的资助。
本研究通过鼻内滴注脂多糖(LPS)构建小鼠急性肺损伤(ALI)和急性呼吸窘迫综合征(ARDS)模型,探究大脑对肺损伤的调控作用(图1a)。LPS暴露3小时后,c-Fos检测发现包括下丘脑室旁核(PVN)在内的6个脑区神经元激活,且近80%的PVN内CRH⁺神经元与c-Fos⁺共定位(图1b-e)。进一步向CRH-IRES-Cre小鼠PVN注射AAV-EF1α-DIO-GCaMP6m并通过光纤监测,证实LPS可增强CRHᴾⱽᴺ神经元钙信号(图1f-j)。进一步探究PVN中的CRHᴾⱽᴺ神经元是否向肺部投射传出信号,向CRH-IRES-Cre小鼠PVN注射AAV2/9-Ef1α-DIO-mCherry实现CRHᴾⱽᴺ神经元的可视化,3周后向肺部注射表达绿色荧光蛋白的伪狂犬病病毒(PRV)逆行追踪,6天后在PVN的大量CRH神经元中观察到GFP信号,这证明CRHᴾⱽᴺ神经元与肺部存在神经解剖学连接(图1k-m)。

图1 ALI激活CRHᴾⱽᴺ神经元
为探究CRHᴾⱽᴺ神经元对小鼠ALI的调控作用,研究采用化学遗传学方法,向CRH-IRES-Cre小鼠PVN注射兴奋性AAV病毒(hM3Dq)或对照病毒(Ctrl)(图2a),持续激活该神经元5天可显著提高小鼠生存率(图2b),激活2天能减轻肺损伤(图2c-d)、降低肺W/D比值与支气管肺泡灌洗液(BALF)蛋白质浓度以抑制肺通透性增加和肺水肿(图2e-f),并减少肺组织中IL-1β、IL-6、TNF等促炎细胞因子(图2g);而向小鼠PVN注射抑制性AAV病毒(hM4Di)(图2h),在采用10mg/kg LPS构建ALI模型(避免高剂量LPS致死掩盖效应)并腹腔注射CNO抑制该神经元后,小鼠死亡率显著升高(图2i),肺部炎症与肺损伤评分加重,肺通透性增加、肺水肿加剧(图2j-m),且肺组织中IL-6、IL-1β、TNF表达增强(图2n)。这表明CRHᴾⱽᴺ神经元激活可改善ALI并提高生存率,抑制则会加重ALI并升高死亡率。
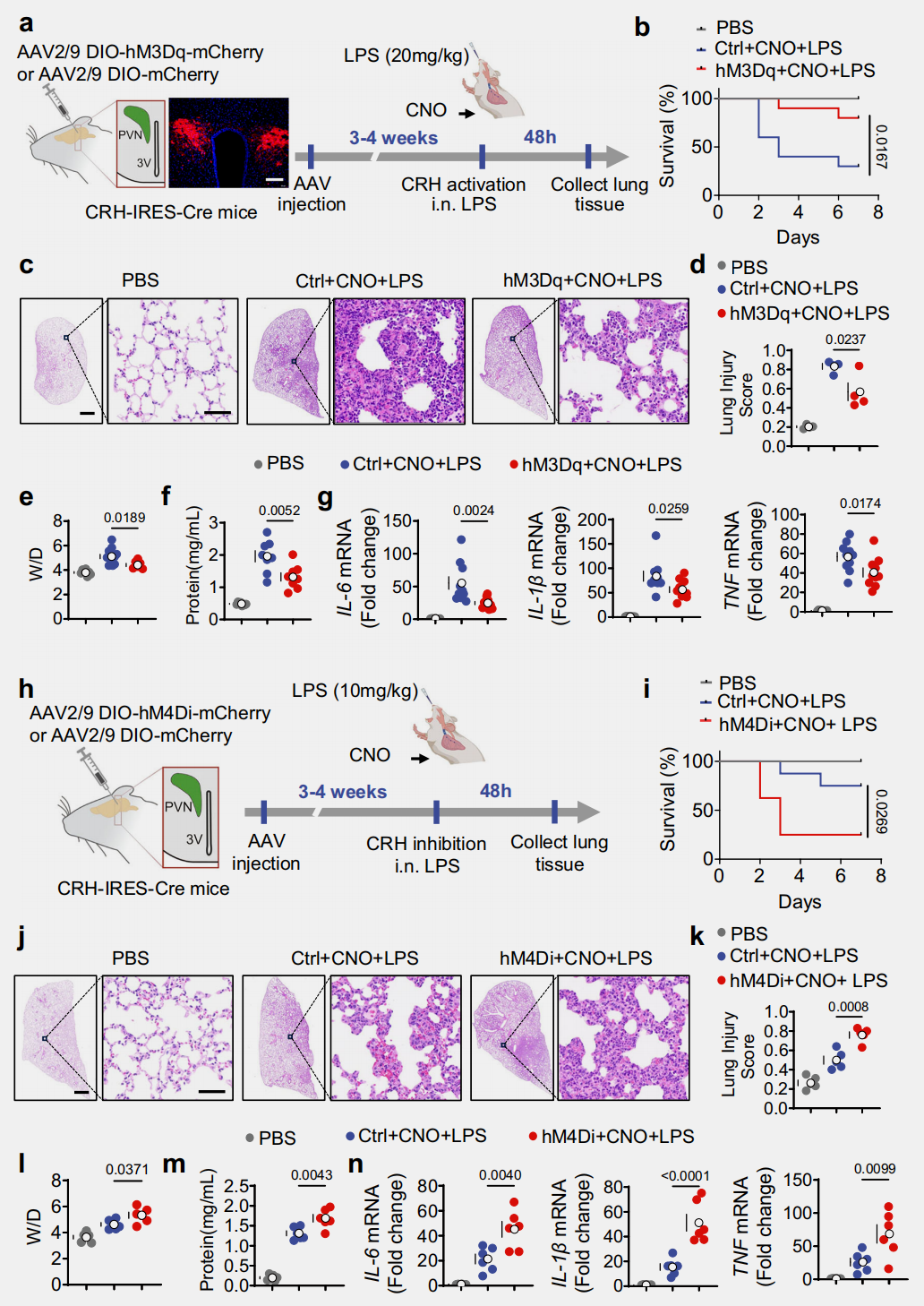
图2 CRHᴾⱽᴺ神经元调节ALI和存活率
鉴于中性粒细胞在炎症相关ALI中的关键作用,研究分析了CRHᴾⱽᴺ神经元激活或抑制后,LPS处理小鼠BALF及肺组织中白细胞(含中性粒细胞)的变化。激活该神经元时,流式细胞术显示LPS暴露8小时和48小时后,BALF与肺部的CD45⁺白细胞、Ly6G⁺中性粒细胞浸润显著减少(图3a-c),免疫组化显示肺内Ly6G⁺中性粒细胞及髓过氧化物酶(MPO,可致氧化性组织损伤)阳性细胞增多现象被抑制(图3d-e),肺组织RNA测序显示中性粒细胞相关基因及细胞因子通路表达降低(图3f-g)。抑制该神经元则会增加上述细胞数量(图3h-l)。综上表明CRHᴾⱽᴺ神经元在ALI期间可调控中性粒细胞向肺部的募集。
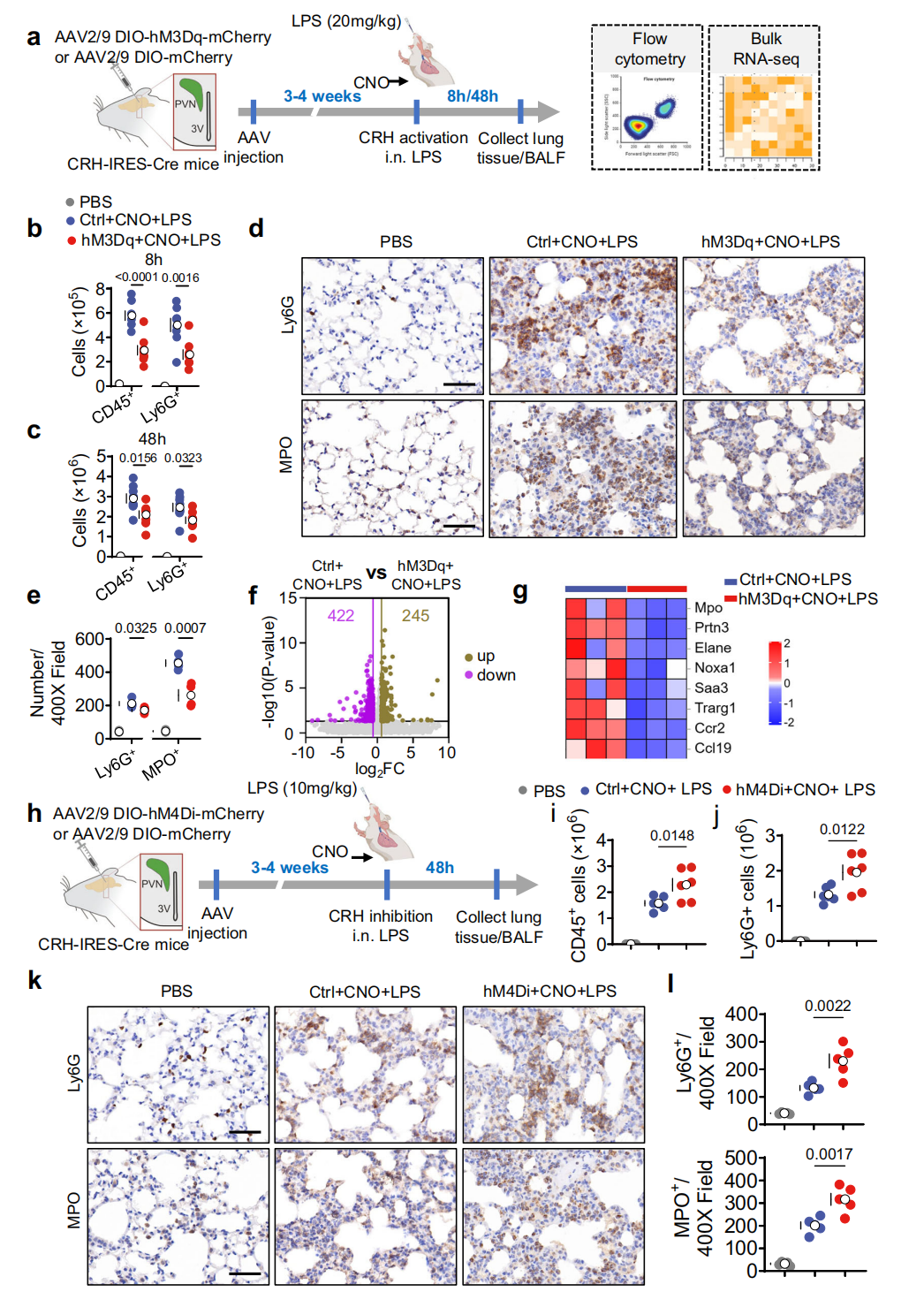
图3 CRHᴾⱽᴺ神经元影响中性粒细胞浸润和反应
进一步对CRHᴾⱽᴺ神经元化学遗传学激活后、LPS处理小鼠肺中分离的中性粒细胞进行RNA测序(图4a),结果显示其与对照小鼠相比,有1109个基因下调、1028个基因上调(图4b)。KEGG分析提示受调控通路包括趋化因子信号通路、NF-κB信号通路等(图4c)。激活CRHᴾⱽᴺ神经元可通过流式细胞术检测到显著抑制LPS处理小鼠BALF中性粒细胞的吞噬能力(FITC标记乳胶珠摄取减少,图4d)和活性氧(ROS)生成(DCFH-DA荧光强度降低,图4e),还能显著抑制ALI时LPS诱导的小鼠肺部中性粒细胞胞外陷阱(NETs,通过CitH3与MPO共染色证实,图4f-g)形成。综上表明CRHᴾⱽᴺ神经元激活可抑制ALI期间中性粒细胞的致病性功能。
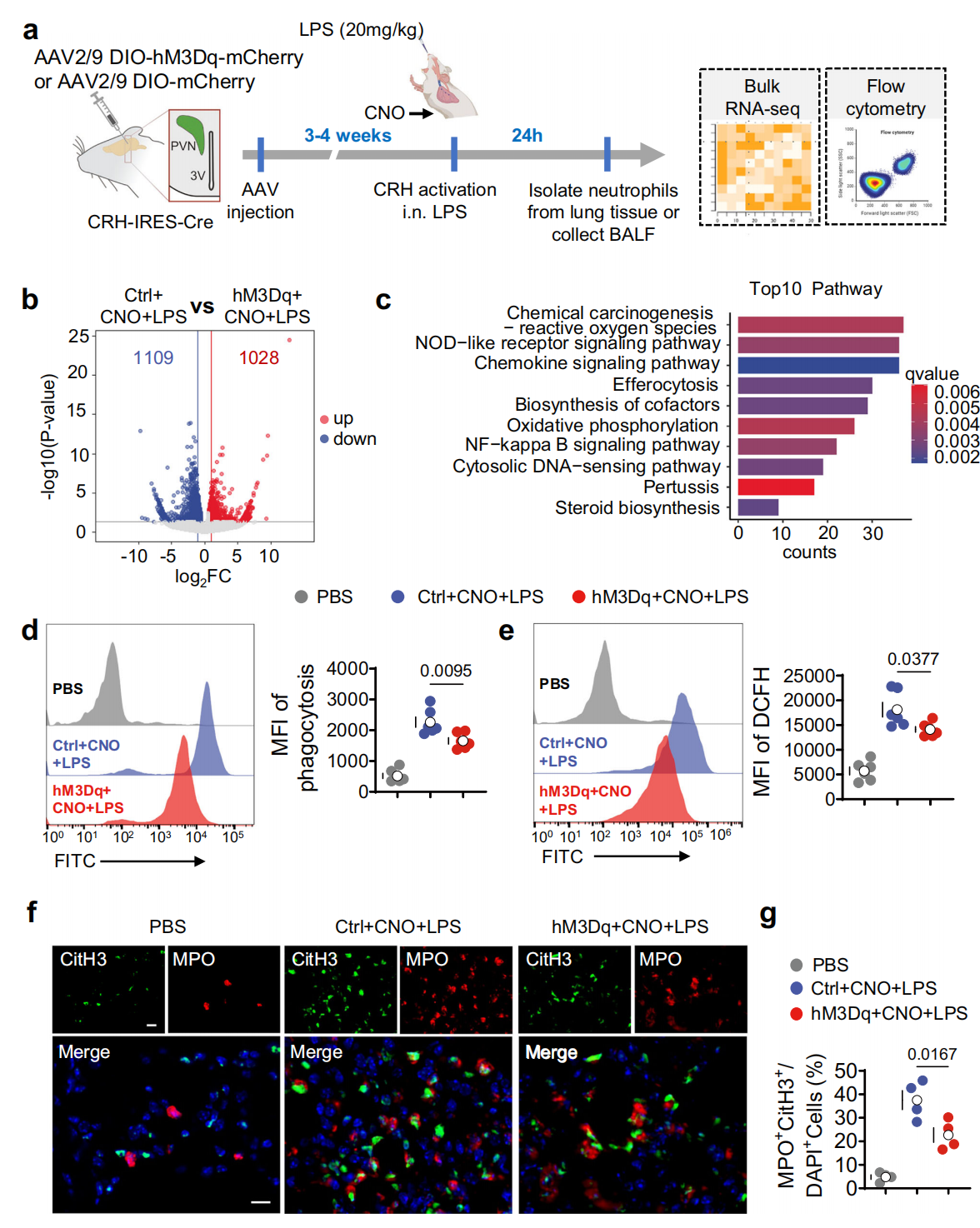
图4 CRHᴾⱽᴺ激活限制了ALI中性粒细胞效应功能
交感神经系统(SNS)和下丘脑-垂体-肾上腺(HPA)轴是CRHᴾⱽᴺ神经元介导神经免疫对话的核心系统。激活CRHᴾⱽᴺ神经元虽对血浆皮质酮(HPA轴相关)的影响因状态而异(基础状态下升高、LPS处理下降低),但均能增加肺组织去甲肾上腺素(NE)(图5a-b),另外CRHᴾⱽᴺ神经元激活可上调儿茶酚胺合成的限速酶酪氨酸羟化酶TH的表达(图5c),这表明肺SNS活性增强。后续实验显示,鼻内滴注6-羟基多巴胺(6-OHDA)消融肺交感神经(图5d)或给予β₂-肾上腺素能受体(β₂-AR)拮抗剂ICI118551阻断肺β₂-AR后(图5m),CRHᴾⱽᴺ神经元激活对ALI的保护效应(改善生存率、减少白细胞浸润等)均消失(图5g-j),小鼠肺损伤加重(图5k、l、n-r)。综上表明肺SNS和β₂-AR均参与该神经元介导的ALI保护作用。
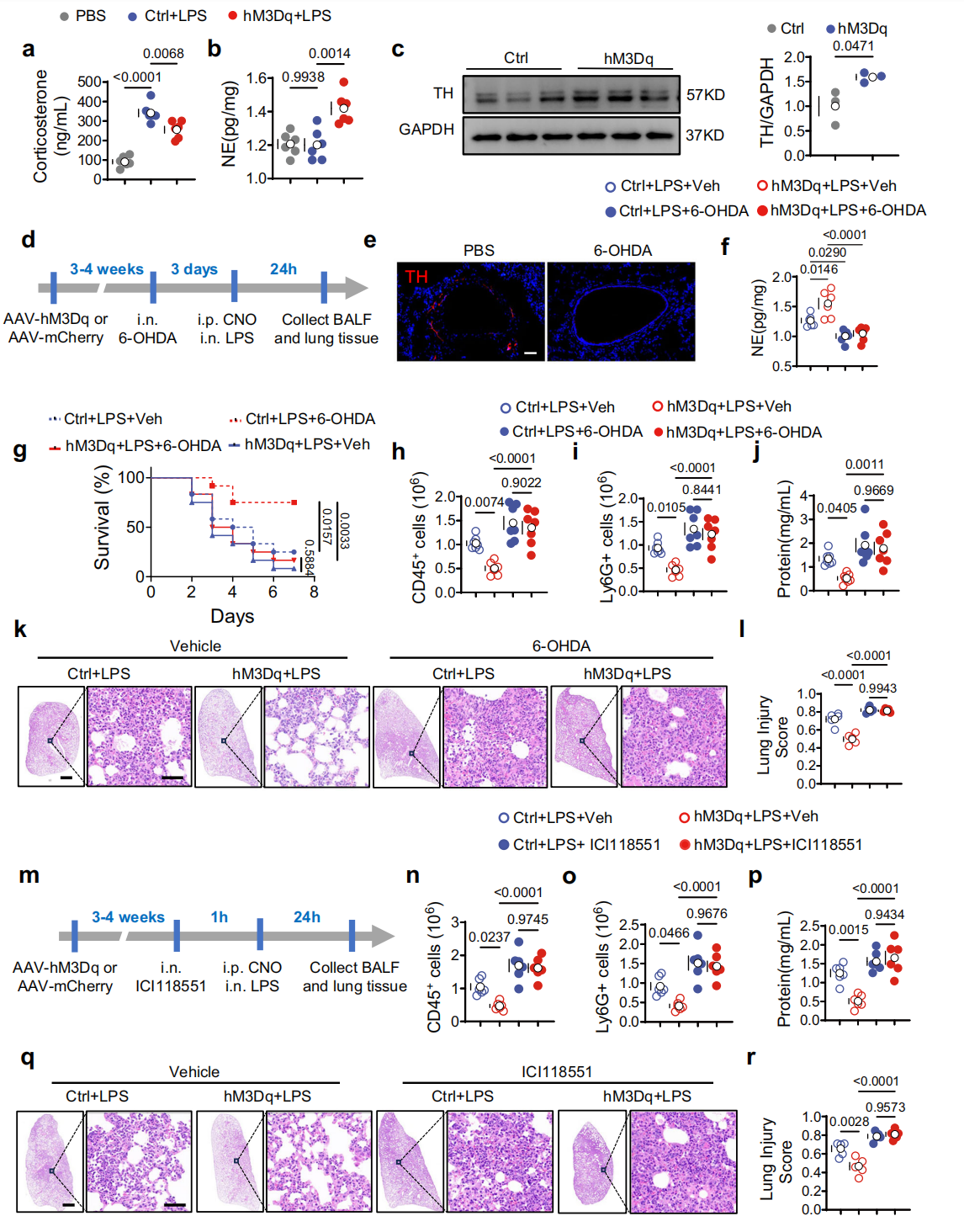
图5 CRHᴾⱽᴺ神经元通过局部交感神经激活调节ALI
为明确肺SNS对中性粒细胞功能的影响,体外检测了NE对骨髓分离中性粒细胞的作用。结果显示NE可降低LPS诱导的骨髓中性粒细胞吞噬作用(图6b)、活性氧(ROS)生成(图6c)及TNF表达(图6f),β₂-AR激动剂沙丁胺醇也有类似抑制效果(图6d-e),表明NE通过β₂-AR信号抑制中性粒细胞对LPS的反应。对LPS处理的对照组和hM3Dq表达小鼠肺中性粒细胞的RNA测序发现,NF-κB信号通路是CRHᴾⱽᴺ神经元激活调控的核心通路(图6g)。NE可抑制LPS处理中性粒细胞中p65、IκBα的磷酸化(图6h)及p-p65核转运(图6i),并上调β₂-AR相关的NF-κB负调控因子β-arrestin2(图6j),已知β-arrestin2是β₂-AR激活的NF-κB信号通路负调控因子。综上表明NE主要通过β₂-AR/β-arrestin2依赖的NF-κB信号抑制作用调控中性粒细胞功能,这也是 CRHᴾⱽᴺ神经元激活发挥ALI保护作用的潜在机制。
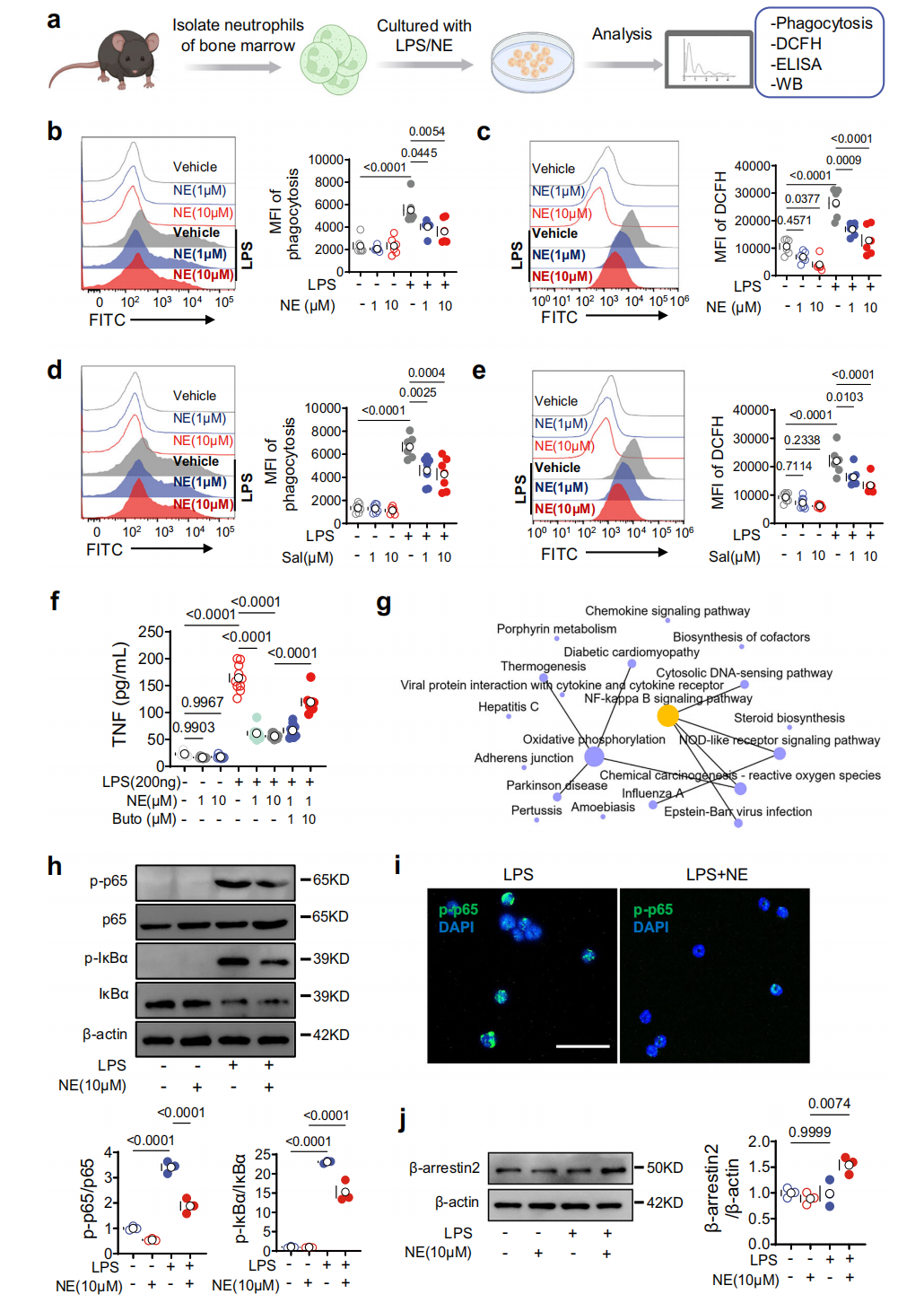
图6 NE通过β2-AR-β-arrestin2信号通路调控中性粒细胞,抑制NF-κB通路
本文首次揭示“CRHᴾⱽᴺ神经元-肺交感神经-中性粒细胞”轴。CRHᴾⱽᴺ神经元激活后通过增强肺交感神经活性释放NE,NE结合中性粒细胞β₂-AR并激活β-arrestin2,进而抑制NF-κB通路,最终减少中性粒细胞浸润与致病功能,减轻ALI损伤。未来其他脑区及PVN内其他神经元群体在肺部炎症调控中的作用需进一步研究以完善脑-肺调控网络,并动态监测CRHᴾⱽᴺ神经元在ALI不同阶段的活性变化,结合非侵入性神经调控技术等开展长期研究,验证基于CRH神经元的干预策略安全性与最佳疗效。
本文使用的工具病毒布林凯斯均可提供:
同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。