神经性疼痛(NP)由躯体感觉神经系统损伤或疾病引起,以异常疼痛感知和负面情绪为特征,严重影响生活质量,常导致焦虑、抑郁等,目前药物治疗缓解不足且长期使用有不良反应,非药物干预效果因个体差异而异,开发靶向、缓解疾病的镇痛药是未满足的医疗需求。间充质基质细胞(MSC)具有多向分化潜能、免疫调节特性和旁分泌功能,可从多种组织分离,在缓解多种疼痛方面有疗效,但其治疗结果受多种因素影响,镇痛机制尚未完全明确。
2025年8月28日,中山大学中山医学院项鹏和张小然团队及中山大学附属第一医院冯霞团队合作在Advanced Science 在线发表题为“Mesenchymal Stromal Cells Play an Analgesic Role Through a Npy2r Sensory Neuron-Mediated Lung-to-Brain Axis”的研究论文,揭示了间充质基质细胞(MSC)通过Npy2r感觉神经元介导的肺-脑轴发挥镇痛作用。MSC经外周递送后,激活肺部表达Npy2r的迷走感觉神经元,这些神经元投射至孤束核和腹外侧导水管周围灰质区,通过迷走神经肺-脑通路产生镇痛效果。

采用坐骨神经损伤(SNI)小鼠模型,于SNI两周后静脉注射1×10⁶个骨髓来源的MSC。冯・弗雷试验(VFT)显示,与假手术组相比,SNI雄性小鼠双侧爪机械痛阈值降低,而MSC给药1小时后双侧改善异常性疼痛,4小时达峰值;且MSC对雄性小鼠机械异常性疼痛的改善优于雌性,热板试验(HPT)显示其对雌雄小鼠热痛影响相似(图1C、D)。对比镇痛药疗效,人真皮成纤维细胞(HDF)对镇痛无显著影响,而MSC在给药4小时后对SNI雄性小鼠的镇痛效果显著,与右美托咪定(DEX)相当,优于阿司匹林(图1E、F)。MSC输注还改善了SNI小鼠在高架十字迷宫(EPM)和悬尾试验(TST)中表现出的焦虑样和抑郁样行为(图1G-I)。
利用基因小鼠(Fos CreERT2;Loxp-tdTomato)和全脑清除技术,发现MSC注射后即刻早期基因Fos在腹外侧导水管周围灰质区(vlPAG)、海马体等区域显著激活(图1J、K),其中vlPAG与大脑疼痛控制系统相关。通过注射AAV-hSyn-taCasp3消融vlPAG神经元(图1M),经TUNEL测定确认其凋亡(图1N、O)后,MSC的镇痛作用消失(图1P、Q)。重组伪狂犬病病毒(PRV-EGFP)神经示踪证实vlPAG与外周爪存在神经连接。综上,MSC通过vlPAG神经元在SNI小鼠中发挥镇痛作用。
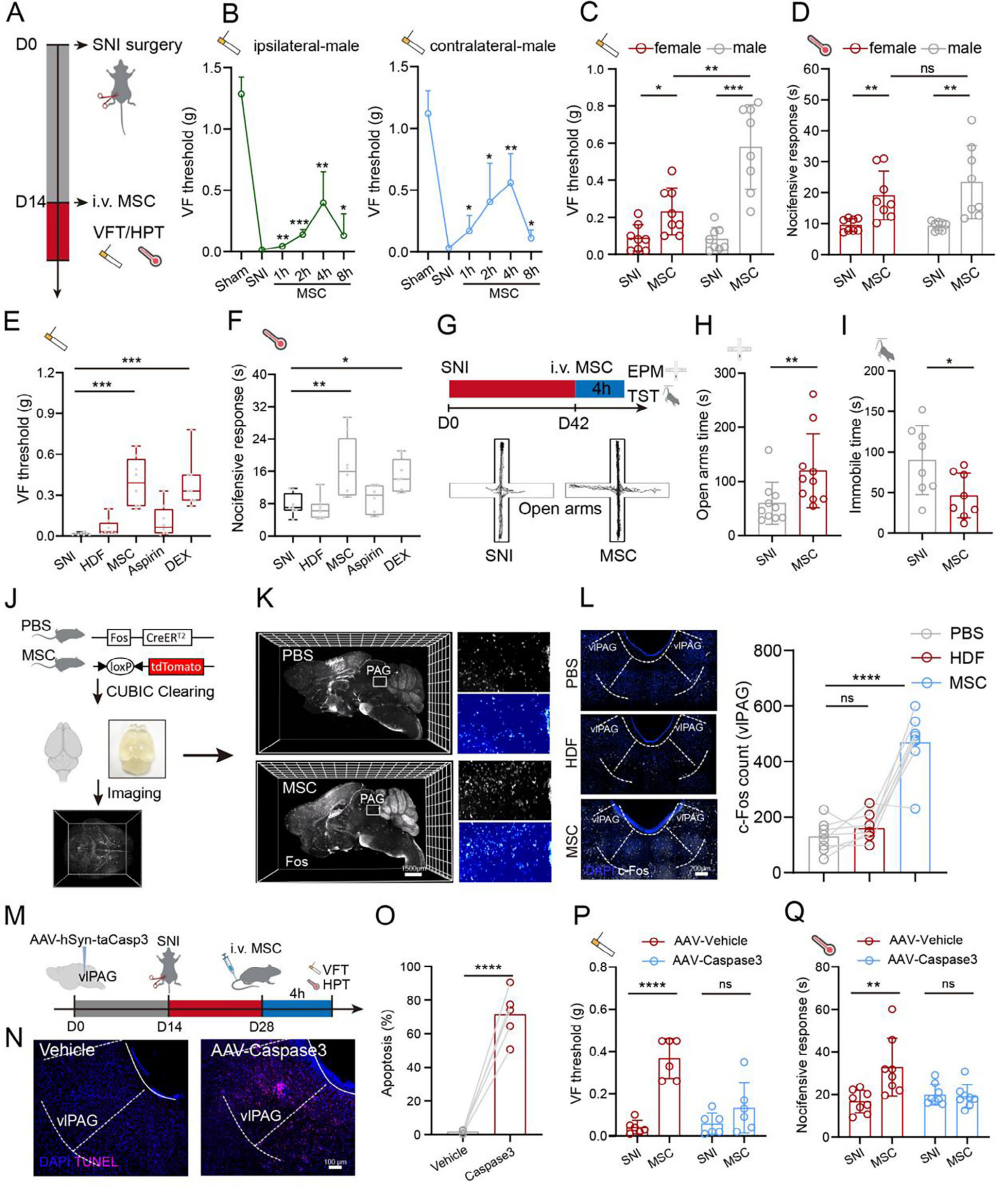
图1 MSC通过vlPAG神经元缓解神经损伤引起的疼痛
静脉输注的MSC主要分布于肺,而肺主要受迷走感觉纤维分支支配。将GFP标记的MSC静脉注射到VGLUT2-Cre;Loxp-tdTomato基因小鼠体内,经组织透明化和成像技术观察发现,多数VGLUT2纤维沿主要气道分布于平滑肌层下方并与之平行,且GFP-MSC与肺内迷走感觉神经紧密相邻(图2A、B)。同时,肺中GFP⁺细胞表达MSC特异性标志物CD105和CD90,表明在3天治疗窗口期内,输注细胞仍保留MSC特性,证实其在此期间具有活力和功能活性。
推测静脉注射的MSC通过肺迷走神经传入纤维调节vlPAG。为了绘制该回路将AAV-retro-DIO-EGFP注射到VGLUT2-Cre小鼠肺中以标记支配肺的迷走神经(图2C),在结状神经节和孤束核(NTS)中观察到明显信号(图2D、E)。将顺行示踪病毒HSV-EGFP注射到NTS(图2F),发现感染延伸至vlPAG靶区(图2G)。MSC注射后,双侧结状神经节c-Fos信号呈时间依赖性增加,且左侧响应更早(图2H、I)。在VGLUT-Cre;Loxp-GCaMP6小鼠中记录到,HDF注射仅使少数迷走感觉神经元钙信号增加,而MSC注射几乎引发所有记录的迷走感觉神经元钙瞬变。钙成像后收集结状神经节,发现MSC注射组VGLUT2-GCaMP6阳性感觉神经元c-Fos表达高于HDF组。此外,MSC注射诱导NTS神经元激活,且c-Fos与VGLUT2共定位增加,表明其激活了NTS中谷氨酸能神经元(图2J、K)。在MSC注射前进行迷走神经切断术(图2L),部分抑制了MSC诱导的NTS神经元和vlPAG神经元(图2M、N)激活。综上,MSC可能通过肺迷走神经-脑轴将信号传递至vlPAG。
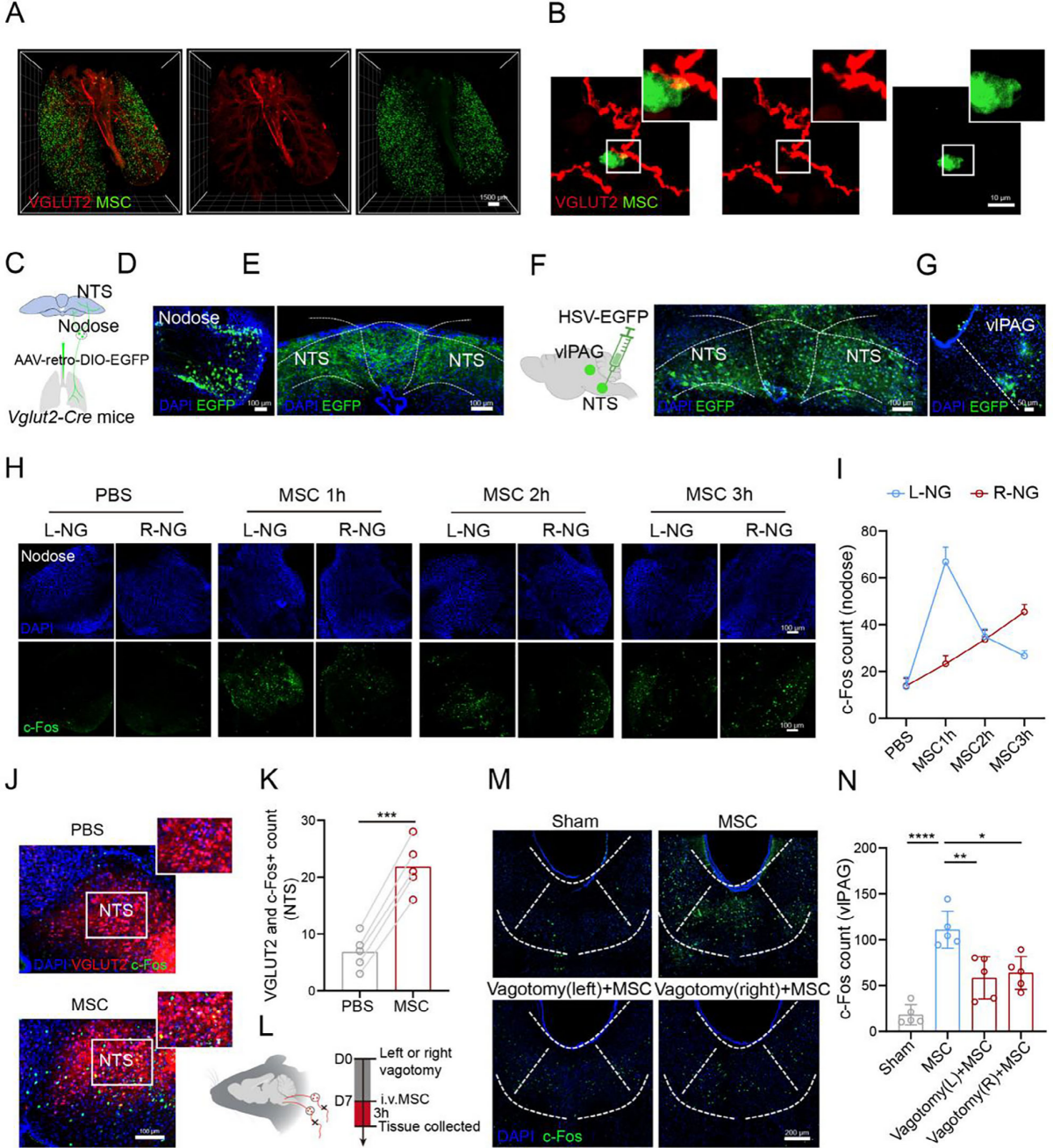
图2 MSC通过肺迷走→NTS→vlPAG通路调控vlPAG神经元
已知传入感觉神经节含多种分子不同的神经元,迷走神经感觉神经元是支配肺和气道的主要神经纤维来源。研究发现P2ry1和Npy2r迷走感觉神经元与不同肺-脑连接相关,P2ry1神经元为快速传导A纤维,投射至外侧孤束核(NTS);Npy2r神经元靶向接收肺C纤维输入的NTS内侧后部区域。为定位连接肺的Npy2r和P2ry1感觉神经元,向Npy2r-Cre小鼠肺注射AAV-retro-DIO-mCherry(图3A、B),结果仅结状神经节及NTS出现感染信号(图3C、D)。为了明确其在镇痛中的作用,采用化学遗传学激活:向Npy2r-Cre小鼠肺注射AAV-retro-DIO-hM3Dq-mCherry(图3E),CNO注射后结状神经节mCherry⁺神经元c-Fos表达增加(图3F);向野生型小鼠肺注射两种AAV混合物(AAV-retro-DIO-hM3Dq-mCherry和AAV-retro-P2ry1-Cre)激活P2ry1感觉神经元,CNO注射后也见结状神经节mCherry⁺神经元c-Fos增加(图3G)。仅激活Npy2r感觉神经元可改善SNI诱导的机械异常性疼痛和热痛觉过敏(图3H、I),且呈CNO剂量依赖性,还可诱导vlPAG的c-Fos表达增加(图3J)。
向Npy2r-Cre小鼠肺注射AAV-retro-DIO-ChRmine-EYFP(图3K),591nm LED光照射胸部1分钟后,SNI小鼠热痛觉过敏改善(图3L)。光纤记录显示,刺激支配肺的Npy2r迷走感觉神经元后,vlPAG神经元钙信号增加(图3M、N),放电率升高,表明选择性激活该神经元可产生镇痛,建立潜在肺-脑疼痛调节回路。为了验证支配肺的Npy2r迷走感觉神经元是否投射至vlPAG,采用双病毒注射:第0天向Npy2r-Cre小鼠肺注射AAV-retro-DIO-mCherry,第21天向vlPAG注射PRV-EGFP(图3P)。感染96小时后,结状神经节和NTS中红绿荧光重合,提示其可能投射至vlPAG(图3Q、R)。野生型小鼠注射固蓝和PRV-EGFP也获相似结果。综上,Npy2r感觉神经元通过肺-脑通路驱动镇痛。
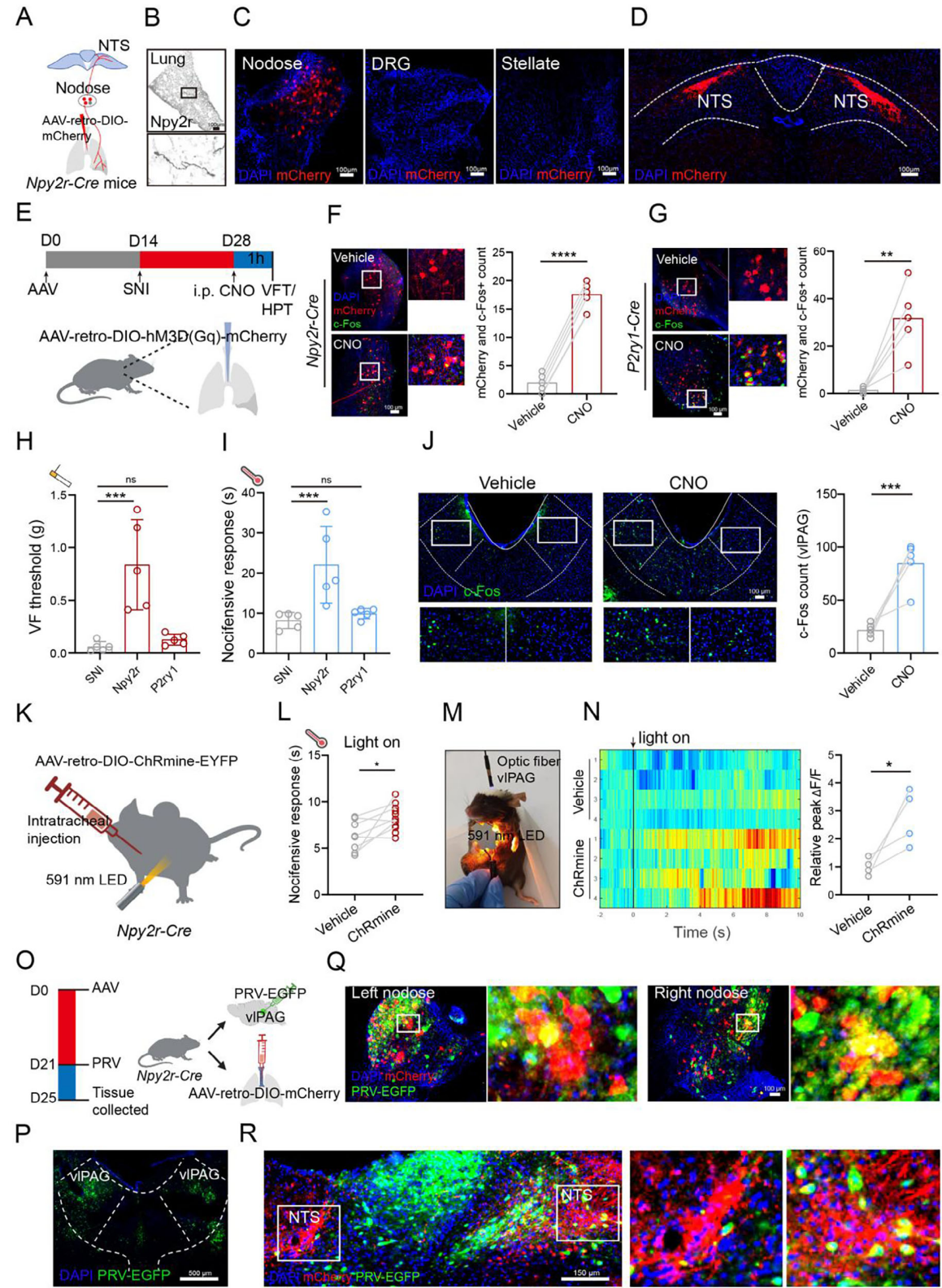
图3 肺部Npy2r感觉神经元发挥镇痛作用
因为肺Npy2r迷走感觉神经元可投射至vlPAG,推测MSC是否通过肺Npy2r感觉神经元镇痛。观察输注GFP-MSC与Npy2r感觉神经在肺、心、肝、脾、肠等器官的分布,仅肺中二者共定位,提示可能存在相互作用(图4A)。且在Npy2r-Cre;Loxp-tdTomato小鼠肺中,经神经元标志物(TUBB3)共染色,发现Npy2r在肺神经中表达。MSC可诱导结状神经节中Npy2r感觉神经元的c-Fos表达增加(图4B-D),提示其可能激活该部位Npy2r迷走感觉神经元。向Npy2r-Cre小鼠肺中注射AAV-retro-DIO-hM4D(Gi)-EGFP以沉默支配肺的Npy2r感觉神经元(图4E)后,VFT试验显示,对照组MSC可提高SNI小鼠机械痛阈值,而hM4Di介导的Npy2r感觉神经元沉默抑制了MSC的镇痛效果(图4F);热板试验(HPT)显示,抑制Npy2r感觉神经元后,MSC对SNI小鼠热痛觉过敏的改善作用消失(图4G)。综上,支配肺的表达Npy2r的感觉神经元的激活有助于MSC发挥镇痛作用。
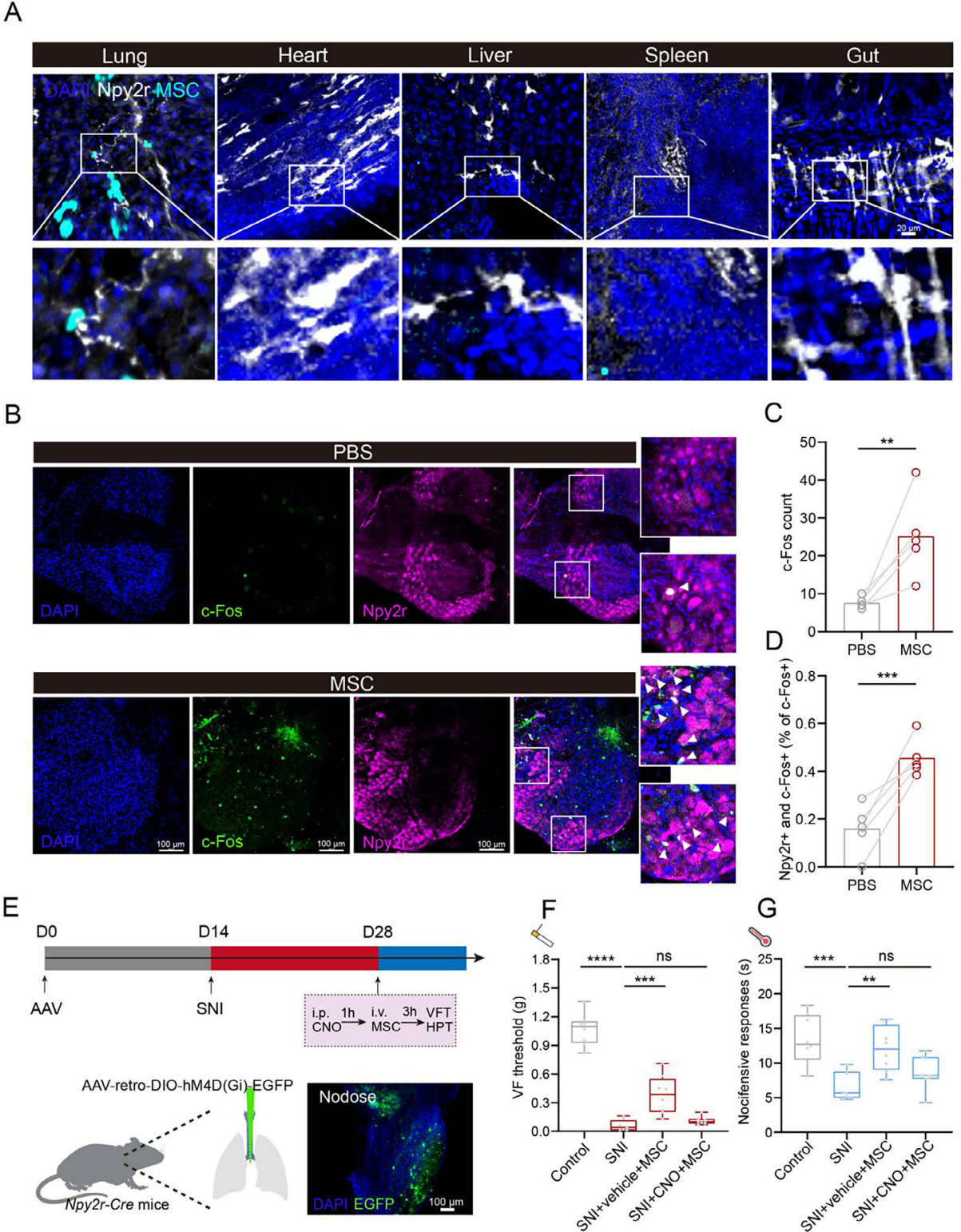
图4 MSC激活Npy2r感觉神经元以镇痛
为研究MSC输注对肺Npy2r感觉纤维的影响,给Npy2r-Cre;Loxp-GCaMP6基因小鼠静脉注射MSC,记录新鲜离体肺中Npy2r感觉纤维活动(图5A)。GCaMP6荧光强度显示,与PBS组相比,肺Npy2r感觉纤维受到MSC的刺激(图5B、C)。利用迷走神经节在体钙成像,研究Npy2r迷走感觉神经元对MSC注射的反应(图5D),在保持与肺连接的情况下成像。结果显示,MSC在多数Npy2r迷走感觉神经元中引发钙瞬变(图5E、F)。向Npy2r-Cre小鼠肺注射AAV-retro-DIO-GCaMP6,记录MSC注射后结状神经节钙信号,证实多数支配肺的神经元对MSC输注有反应。从Npy2r-Cre;Loxp-GCaMP6小鼠收集结状神经节,与RFP标记的MSC共培养数小时(图5G)。体外实验中,MSC温和且持续增加神经元钙反应至少5小时(图5H、I)。免疫荧光分析共培养的结状神经节,发现MSC位于其附近(图5J)。综上,静脉注射的MSC增强了Npy2r迷走感觉神经元的钙信号。
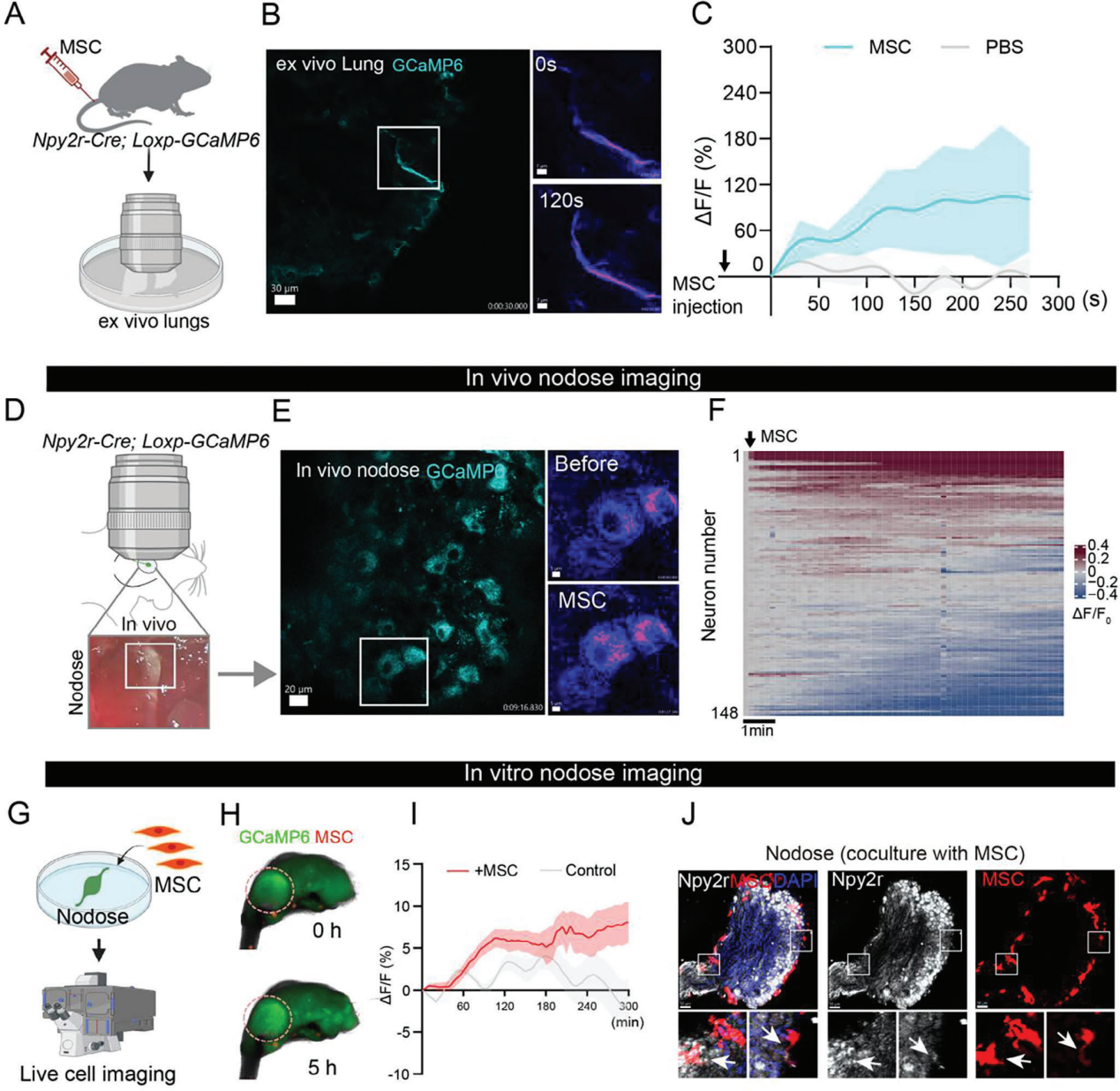
图5 外周MSC对肺神经支配的Npy2r感觉神经元钙信号的增强
先前研究表明,细胞外ATP可通过迷走感觉神经末梢的P2rx2/3受体刺激肺内迷走C纤维。检测发现,MSC注射组肺组织匀浆的ATP水平高于人真皮成纤维细胞(HDF)注射组(图6A),故推测MSC可能通过ATP信号激活肺内Npy2r感觉神经元。重新分析结状神经节单细胞RNA测序数据显示,Npy2r感觉神经元中P2rx2和P2rx3的表达量高于其他配体门控离子通道嘌呤能受体(图6B)。且在Npy2r-Cre;Loxp-GCaMP6基因小鼠中,加入ATP后,肺内Npy2r感觉神经的荧光强度更高(图6C)。使用嘌呤能P2rx2/3受体拮抗剂米诺膦酸(YM-529)证实,MSC输注前雾化吸入YM-529,可阻断MSC介导的结状神经节中Npy2r神经元的激活(图6E),还降低了MSC诱导的NTS(图6F)和vlPAG(图6G)中的c-Fos信号。表明MSC通过ATP信号部分激活Npy2r迷走感觉神经元,正向调节中枢神经系统。
已知ATP可通过囊泡或泛连接蛋白1(PANX1)等通道蛋白释放。喹吖因染色(染色体显带技术)结合流式细胞术检测显示,MSC和HDF上清液中ATP囊泡数量无明显差异,但MSC上清液的ATP水平更高(图6H)。测序分析表明MSC中PANX1的表达高于HDF(图6I)。敲低MSC中PANX1的表达(MSC PANX1si1和MSC PANX1si2)后(图6J),与MSC NC组相比,MSC PANX1si1和MSC PANX1si2输注几乎不会引起Npy2r-Cre;Loxp-GCaMP6小鼠新鲜离体肺中Npy2r感觉纤维的反应(图6L)。在Npy2r-cre;Loxp-GCaMP6小鼠的肺中,TUBB3共染色证实Npy2r-GCaMP6在肺神经中表达(图6M)。免疫荧光分析显示,敲低PANX1的MSC几乎不能激活结状神经节中的Npy2r迷走感觉神经元(图6N),vlPAG中c-Fos的表达也呈类似趋势(图6O)。综上,MSC通过ATP信号激活Npy2r感觉神经元并发挥镇痛作用。
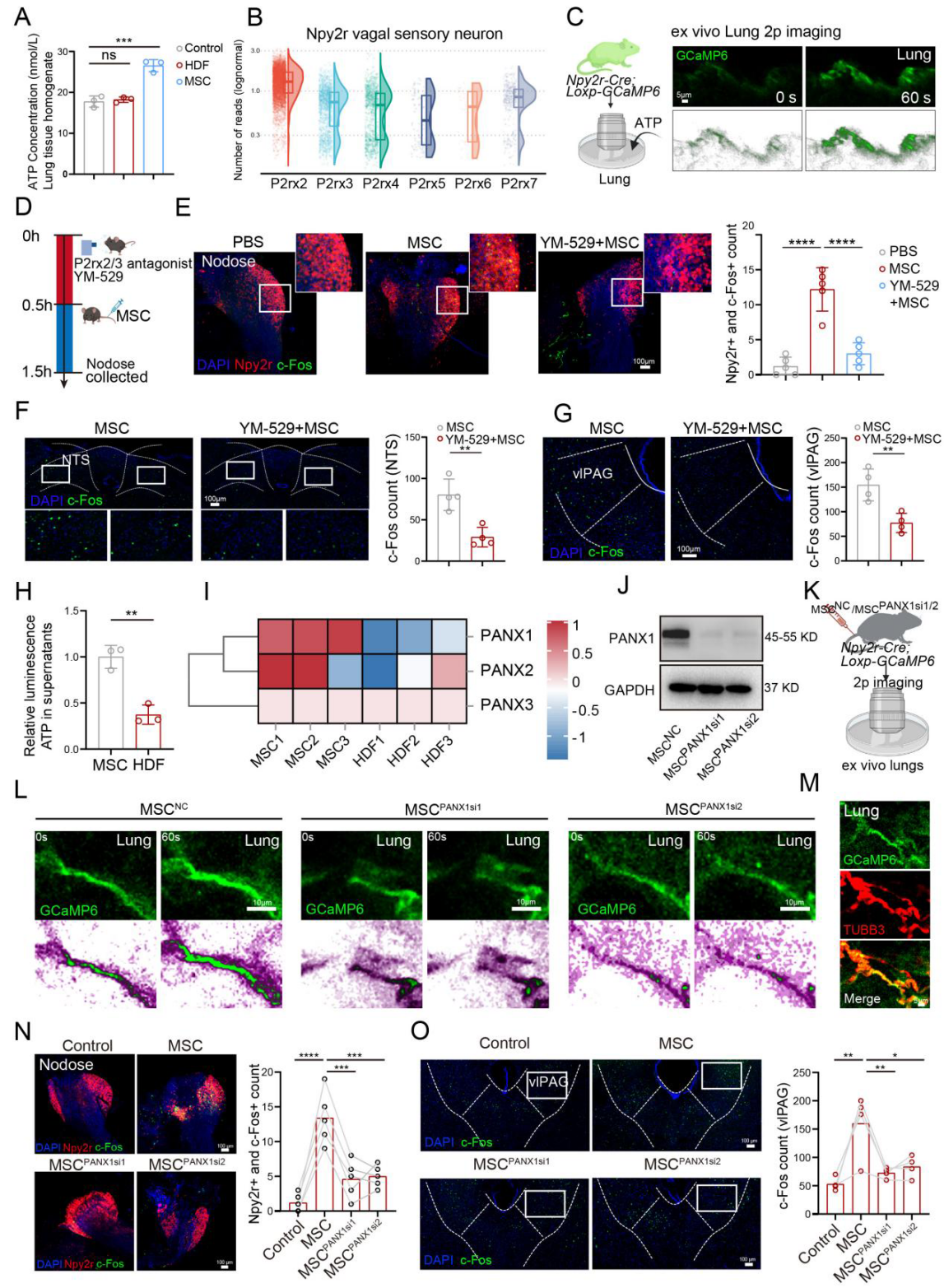
图6 MSC通过ATP信号激活Npy2r感觉神经元
为探索更便捷的通路激活方式,研究直接吸入5'-腺苷三磷酸三锂盐(ATPγS,一种P2rx2激动剂)是否激活与Npy2r感觉神经元相关的肺-脑轴,在SNI小鼠中产生类似抗伤害性感受。如图7A,将SNI小鼠置于密闭空间,分别雾化吸入PBS或ATPγS。结果显示,吸入ATPγS后结状神经节中Npy2r迷走感觉神经元被激活(图7B),且诱导NTS(图7C)和vlPAG(图7D)中神经元激活。更重要的是,吸入ATPγS显著改善SNI诱导的机械异常性疼痛和热痛觉过敏(图7E、F)。进一步评估疗效和安全性,研究不同剂量吸入ATPγS的镇痛效果,发现10mg/kg能显著提高机械痛和热痛阈值,15mg/kg无额外益处。检测血清IL-6水平,吸入10mg/kgATPγS后无显著升高。在未处理小鼠中吸入ATPγS,热板试验显示其热痛阈值显著提高,且vlPAG中c-Fos表达升高。这些表明,多种情况下直接吸入P2rx2激动剂有显著止痛作用。
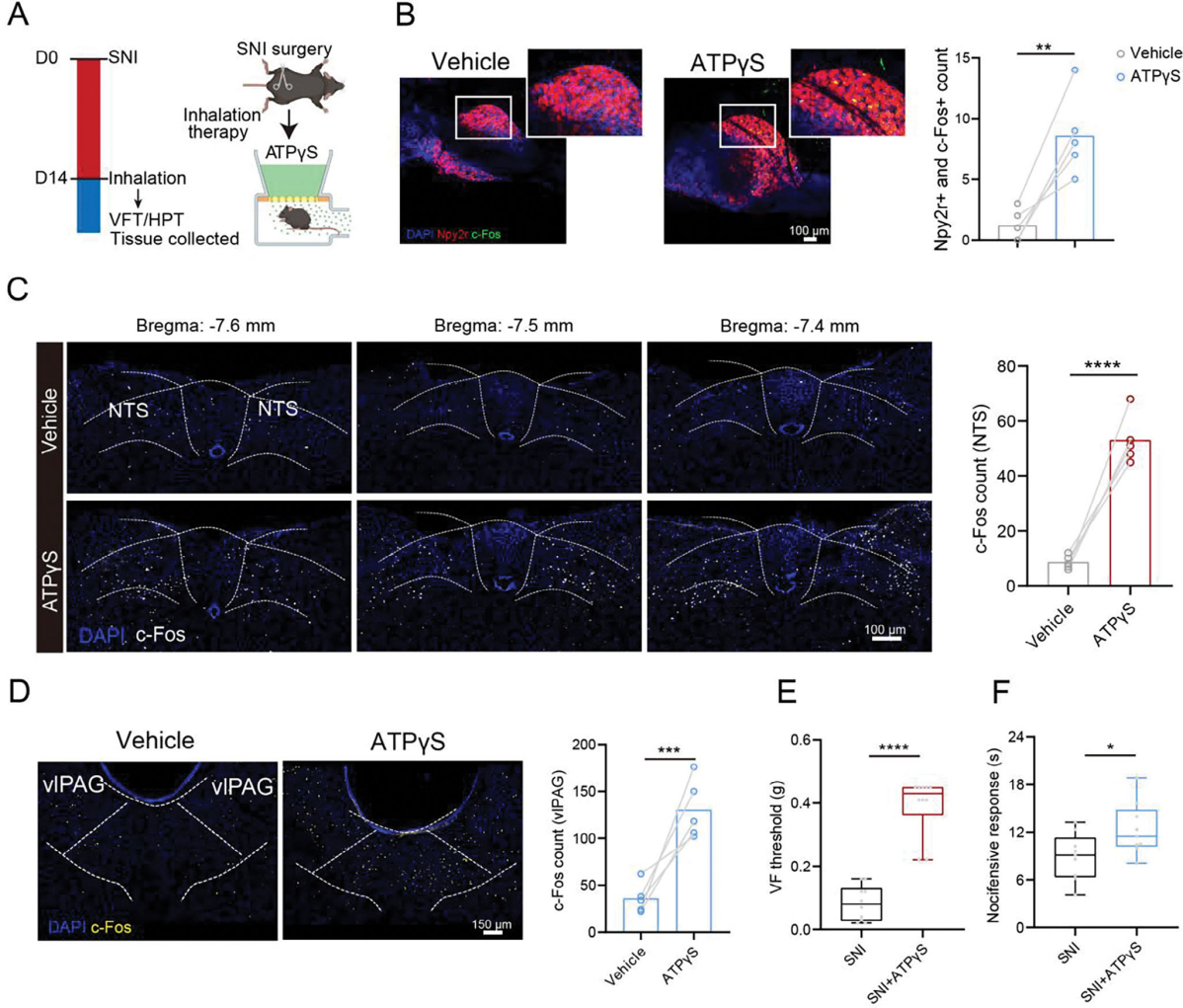
图7 ATPγS激活Npy2r感觉神经元减少疼痛反应
本研究揭示了间充质基质细胞(MSC)通过肺迷走神经→孤束核→腹外侧导水管周围灰质(vlPAG)通路,激活支配肺的Npy2r感觉神经元,且这一过程依赖ATP信号,同时发现直接吸入P2rx2激动剂可有效止痛,为慢性疼痛的治疗提供了新的靶点和便捷的潜在干预方式,具有重要的临床转化价值。
本文使用的工具病毒布林凯斯均可提供:
同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。