组胺能神经元系统在睡眠-觉醒调节、能量和内分泌稳态、认知记忆、运动功能等多种生理功能中起关键作用。该系统的失调或损伤与失眠、发作性睡病、阿尔茨海默病、帕金森病等多种神经系统疾病的发病有关。上游输入回路如何调节组胺能系统是一个具有重要生理意义的关键研究问题,此前研究存在非特异性标记、数据不全面等局限。
2025年8月29日,浙江中医药大学陈忠教授/海南大学骆清铭院士研究团队合作在Nature Communications发表了题为“A whole-brain male mouse atlas of long-range inputs to histaminergic neurons ”的研究论文,通过将狂犬病病毒逆行追踪系统与荧光显微光学切片断层扫描(fMOST) 相结合,构建了雄性小鼠组胺能神经元的3D单突触长程输入图谱。同时,明确了上游皮质神经元在单细胞分辨率下的特定层分布模式和共投射结构,并揭示了外侧隔核(LS) 和丘脑室旁核(PVT)在快速眼动睡眠中不同的功能动态和调节作用,为组胺能神经回路的系统研究奠定基础。

为了标记投射到组胺能神经元的单突触长程输入神经元,将rAAV-EF1α-DIO-mCherry-F2A-TVA与rAAV-EF1α-DIO-oRVG(TVA:RVG=1:2)混合后,注射到HDC-CreERT2小鼠的结节乳头核(TMN,组胺能神经元仅位于结节乳头核,几乎向所有主要脑区投射轴突纤维)(图1a)。病毒注射1天后,连续5天腹腔注射他莫昔芬(100mg/kg)诱导Cre重组酶活性。三周后,同区域注射RV-ENVA-ΔG-EGFP(图1a)。TVA-mCherry和RV-EGFP共标记细胞为起始细胞(图1b、d),RV标记的上游神经元在全脑多脑区呈不同分布模式(图1c)。经系列对照实验,证实HDC-CreERT2小鼠中,单突触逆行RV追踪方法具有特异性和可靠性。
为了建立精确全面的组胺能神经元单突触长程输入全脑图谱,通过fMOST系统进行高分辨率全脑切片、成像和重建(图1e)。其标准化全脑3D重建经冠状、矢状、水平和全视图投影可视化(图1f),代表性冠状切片展示于多个头尾水平。靶向组胺能神经元的上游细胞有三个关键分布模式:(1)偏好内侧区域;(2)偏好腹侧区域;(3)集中在距bregma 0mm~-2.5mm的前后轴部分。区域层面,排除注射部位后,下丘脑核上游细胞最多,小脑密度最低(图1g)。定量分析显示,下丘脑前核(AHN)是主要上游输入来源,比例显著高于其他脑区(图1g)。纹状体、苍白球等也有大量输入,关键核团包括纹状体中的杏仁核内侧核(MEA)、外侧隔核嘴侧部(LSr)等,终纹床核分布模式值得进一步分析(图1g)。基于组胺能神经元投射异质性发现,研究投射到不同下游区域的亚群输入模式差异。结果发现投射到MS和SC的组胺能神经元亚群均从mPFC、LS等接收密集输入,但在mPFC、LS等上游区域,其与一般TMN组胺能神经元的输入密度存在显著差异。综上所述具有不同传出投射的组胺能神经元会差异性整合上游脑区传入输入。
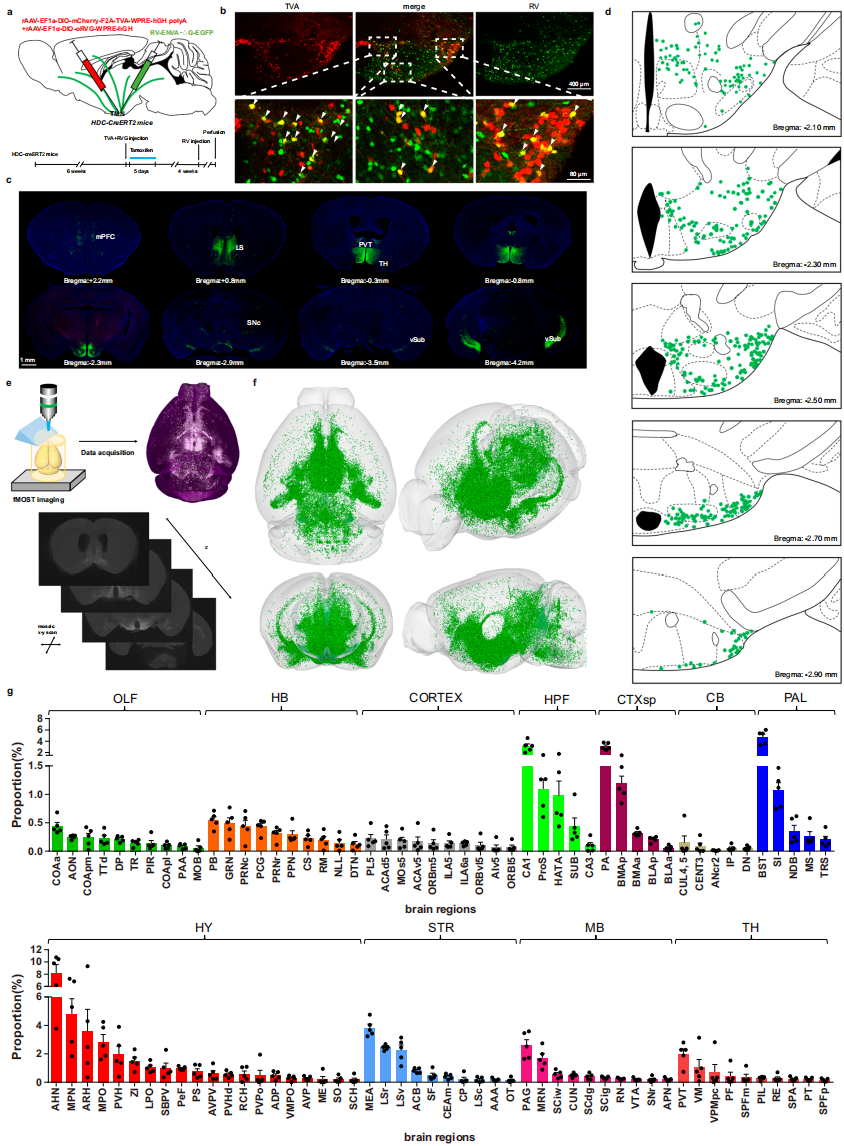
图1 组胺能神经元长程单突触输入的全脑三维重建与可视化
皮质在情感和感觉过程中作用关键。分析fMOST原始数据(图2c)和全脑输入图谱(图1g)发现,投射到组胺能神经元的皮质输入主要分布于第V层,提示功能特异性。对皮质输入神经元3D可视化(图2a)显示,其广泛分布于多数皮质区域,密度存在差异(图2b)。定量分析表明,多数皮质输入来自第V层,其次是第VIa层,其他层输入稀疏(图2d)。区域层面,多数皮质区域遵循第V层偏好,仅mPFC的边缘下区(ILA)例外,其第VIa层输入密度更高(图2e)。
为阐明皮质输入神经元的共投射模式及全脑回路调控机制,利用fMOST数据进行单细胞形态重建,经处理获得150个重建良好的神经元并进行分析(图2f-h)。全皮质水平分析显示,除下丘脑和皮质外,多数输入神经元共投射到多个皮质下区域,主要为纹状体、中脑、苍白球和丘脑(图2h),且所有重建神经元仅支配同侧半球(图2f)。部分皮质区域存在区域特异性投射模式,如内嗅区是唯一对海马结构(HPF)有共投射的皮质区域;mPFC、眶区(ORB)和无颗粒岛叶区(AI)与嗅球(OLF)选择性连接。比较mPFC的ILA和边缘前区(PL)的共投射模式发现,ILA神经元倾向共投射到前部区域(如OLF、STR),PL神经元倾向共投射到后部区域(如PAL、TH、MB),提示这些亚区功能回路不同。
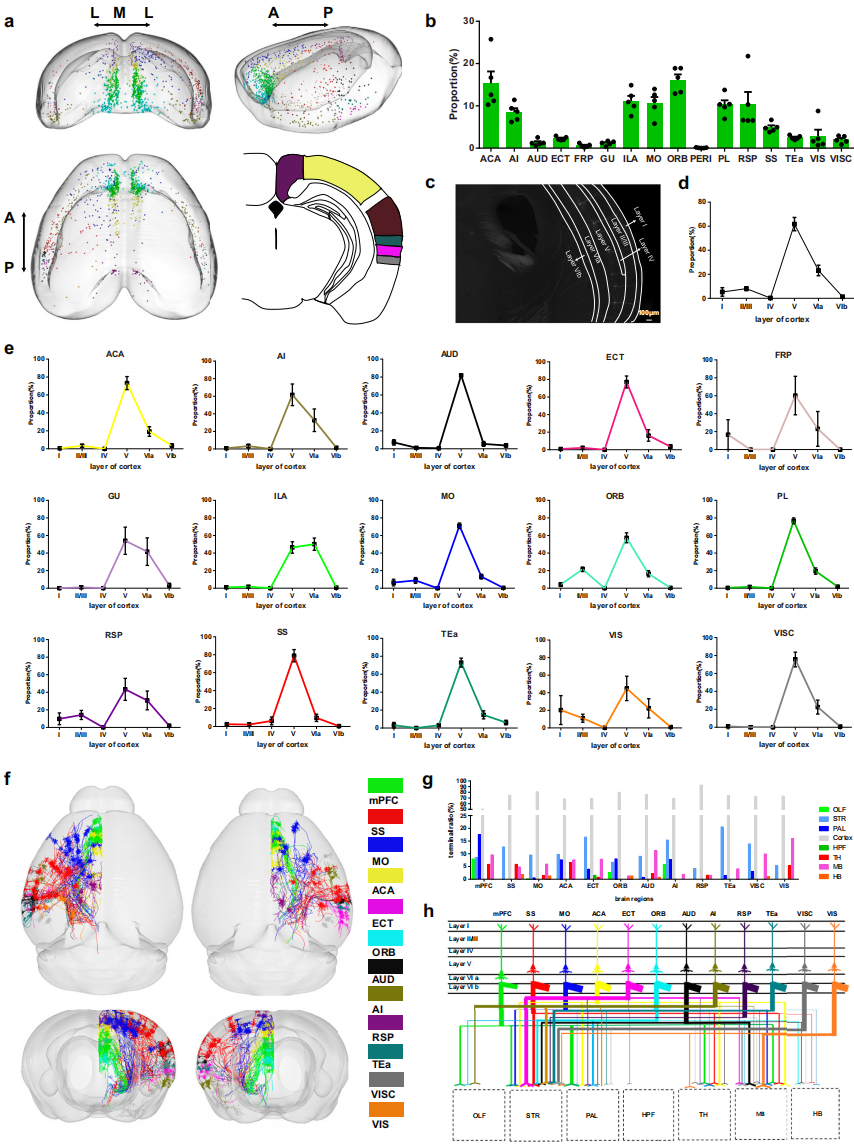
图2 靶向组胺能神经元的上游皮质神经元的层分布和共投影特征
组胺能神经元广泛表达GABAA及NMDA/AMPA受体,介导抑制性和兴奋性输入以调节组胺能信号传导,但多数上游脑区中GABA能和谷氨酸能神经元的精确分布不明,阻碍了相关功能研究。通过对含RV标记小鼠大脑主要上游脑区的冠状切片进行RNAscope原位杂交(图3a),选用GAD1作为GABA能神经元标记,vglut2/CaMKIIα作为谷氨酸能神经元标记(因vglut2多见于皮质下,CaMKIIα适用于皮质和海马)。定量分析显示,LS和MEA的RV-EGFP标记神经元主要为GAD1阳性,vglut2/CaMKIIα信号极少,为抑制性输入(图3b、i、j);终纹床核(BST)多数RV-EGFP标记神经元与GAD1共标记,仅少数与vglut2共标记(图3f、j)。相反,丘脑室旁核(PVT)、CA1区和PA/BMAp主要为vglut2/CaMKIIα阳性输入,GAD1共表达可忽略,为兴奋性输入(图3d、g、h、j)。中脑导水管周围灰质(PAG)和下丘脑前区(AHY)为混合输入,既有大量GAD1阳性群体,也有vglut2/CaMKIIα阳性群体(图3c、e、j)。空间分析显示,AHY中GABA能输入神经元广泛分布,谷氨酸能的集中在第三脑室附近;PAG中GABA能输入神经元偏好腹侧和外侧区域,谷氨酸能的分布均匀。
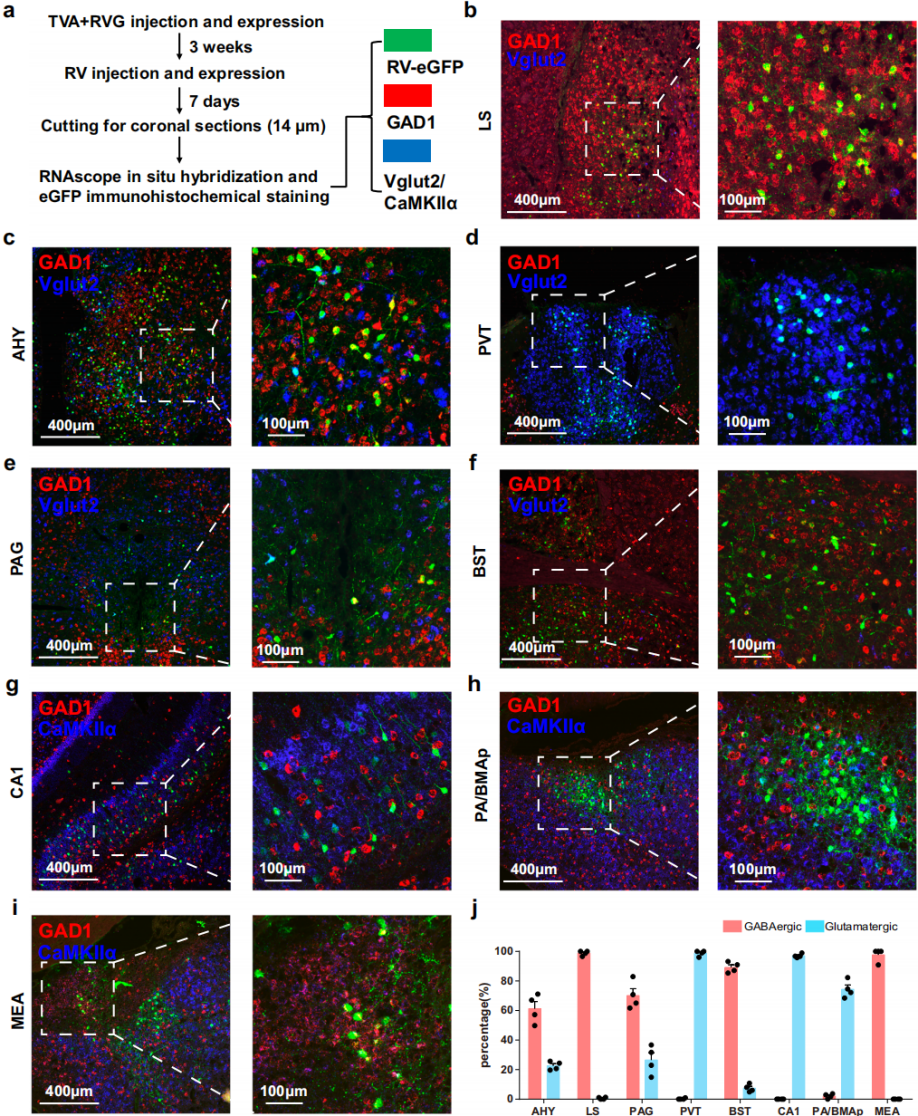
图3 组胺能神经元上游脑区兴奋性和抑制性输入
相较于组胺能输出回路研究,其输入回路功能表征有限。鉴于该系统在睡眠-觉醒调节中的作用,选取外侧隔核(LS,主抑制性)和丘脑室旁核(PVT,主兴奋性)研究,因二者向组胺能神经元提供大量输入且有密集组胺能纤维支配,可能在组胺能传入和传出回路中意义重大。采用Cre依赖的mWGA单突触顺行追踪系统验证连接:将相关病毒混合物注射到HDC;Ai47小鼠(TMN组胺能神经元表达GFP)双侧LS(图4a),三周后TMN中mWGA-mCherry/GFP共标记神经元证实LS→组胺能神经元单突触连接(图4b);类似操作于PVT(图4c),TMN中也发现共标记神经元(图4d)。通过全细胞膜片钳记录表征功能连接:向HDC;Ai47小鼠双侧LS注射ChrimsonR病毒混合物(图4e),5毫秒红光刺激下,GFP标记的组胺能神经元出现强烈抑制性突触后电流(IPSCs),其在TTX和4-AP中存在,被GABAA受体拮抗剂消除,证实LS到组胺能神经元的直接单突触GABA能传递(图4f,g);向PVT注射相同病毒(图4h),5毫秒红光刺激下,记录到强烈兴奋性突触后电流(EPSCs),其在TTX和4-AP中存在,被NMDA/AMPA受体拮抗剂消除,验证PVT到组胺能神经元的直接单突触谷氨酸能输入(图4i,j)。上述结果为LS/PVT→组胺能神经元的直接连接提供结构和功能证据。
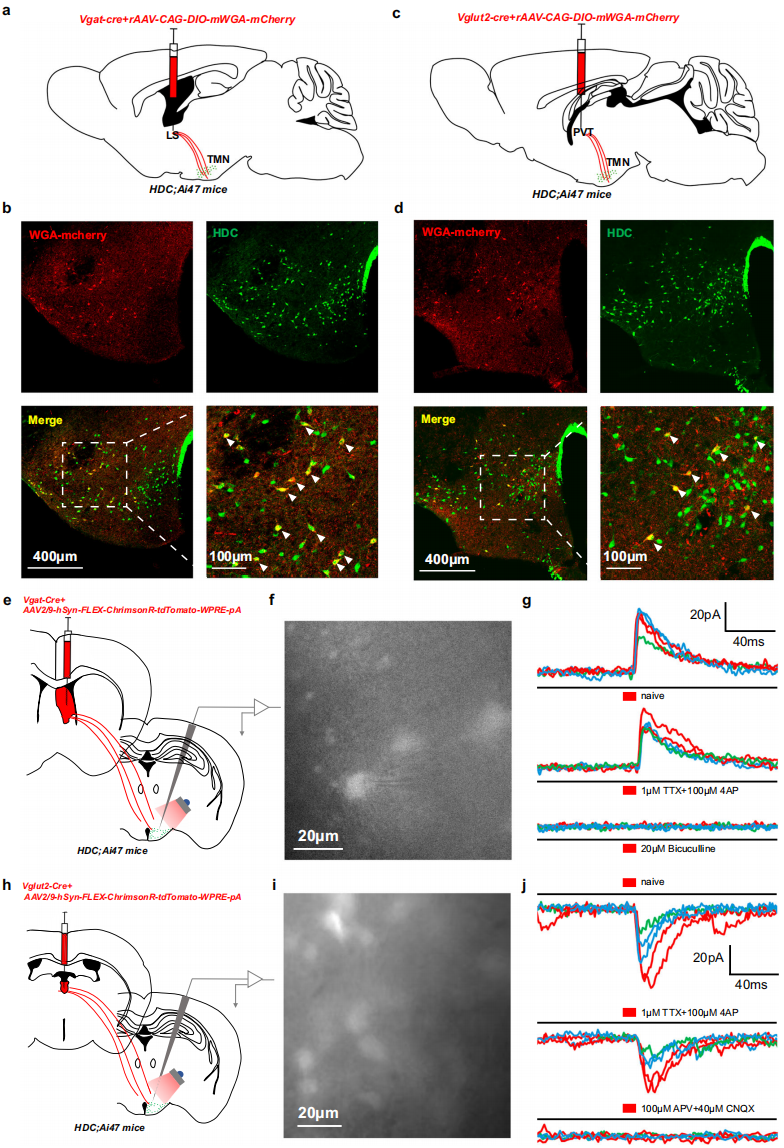
图4 LS和PVT神经元与TMN组胺能神经元之间的单突触结构和功能连接
已知LS和PVT含高密度组胺能神经纤维及大量投射至组胺能神经元的输入神经元,在调节组胺能系统核心功能中起重要作用。鉴于组胺能系统在睡眠-觉醒调节中的明确作用,及PVT谷氨酸能神经元和LS GABA能神经元参与该过程的报道,研究旨在解释一个明显的悖论:这些功能上对立的核团似乎对睡眠-觉醒转换具有相似的影响。为研究LS和PVT中投射至组胺能神经元的细胞,采用Cre依赖的单突触逆行GCaMP系统:将rAAV-EF1α-DIO-mCherry-F2A-TVA与rAAV-EF1α-DIO-N2cG按1:2混合,注射到HDC-CreERT2小鼠双侧TMN,三周后注射CVS-EnvA-ΔG-GCaMP6s,同时在LS或PVT植入光纤(图5a、e)。在TMN及上游脑区发现GCaMP6s标记神经元(图5b、c、f、g)。
同步脑电图(EEG)/肌电图(EMG)和光纤光度记录显示:觉醒向非快速眼动(NREM)睡眠转换时,LS和PVT的输入神经元钙信号均降低(图5d、h、i、m);睡眠(NREM或快速眼动(REM))向觉醒转换时,输入神经元钙信号增强(图5d、h、j、l、n、p)。值得注意的是,NREM向REM睡眠转换时,PVT神经元活动降低,LS神经元无此变化(图5d、h、k、o)。结果表明,LS和PVT中投射至组胺能神经元的细胞协同调节睡眠-觉醒转换,且在NREM向REM睡眠转换中存在未被描述的状态特异性差异。
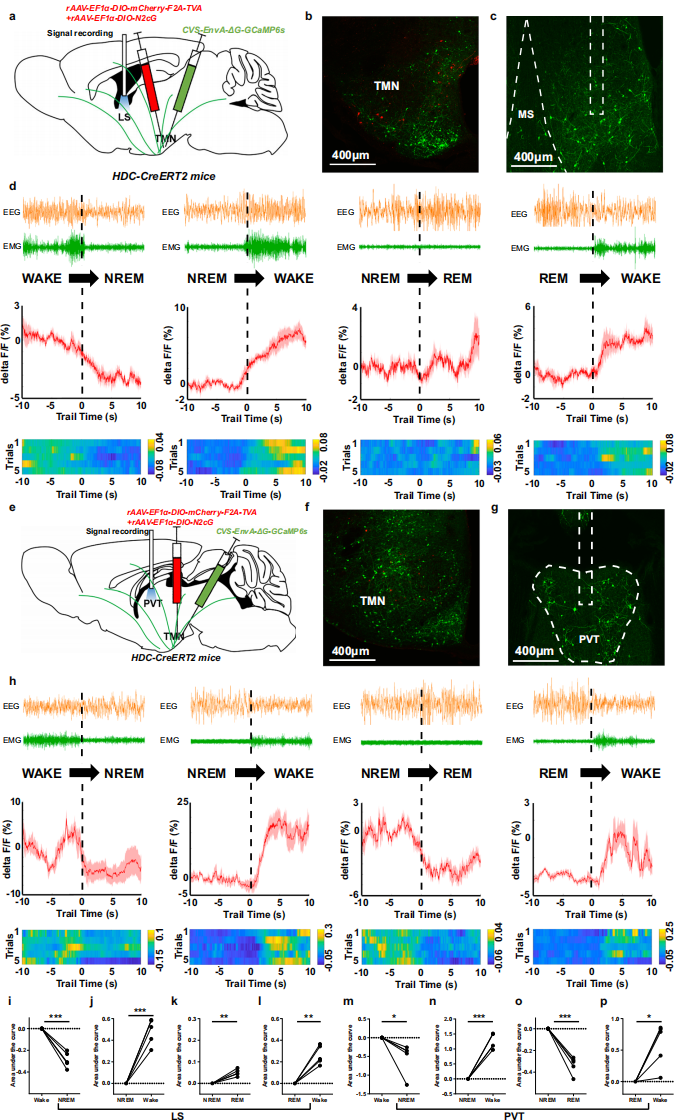
图5 在睡眠-觉醒周期中靶向组胺能神经元的LS和PVT神经元的Ca2+动力学差异
非快速眼动睡眠向快速眼动睡眠转换期间的功能动态差异,提示这些输入回路具有不同的调控作用。研究采用化学遗传学激活法,将rAAV-VGAT1-CRE-EGFP与rAAV-DIO-hM3D(Gq)-EGFP混合物注入野生型小鼠双侧LS,或将rAAV-VGLUT2-CRE与rAAV-DIO-hM3D(Gq)-EGFP混合物注入PVT(图6a-d)。表达三周后,在TMN植入套管递送CNO及电极记录EEG/EMG。7天后记录显示,LS-hM3Dq组和PVT-hM3Dq组觉醒时间均显著高于对照组(图6e-i)。REM睡眠参数差异显著:激活LS-TMN回路增加REM睡眠持续时间,激活PVT-TMN回路则抑制(图6i,j);NREM向REM转换频率也差异明显(图6k)。昼夜节律分析显示:(1)三组小鼠夜间觉醒时间均多于白天(图6l,p);(2)LS-hM3Dq组REM睡眠较对照组增加,PVT-hM3Dq组则减少(图6l-s)。这些发现揭示了LS和PVT输入回路调节睡眠结构的根本差异,突显组胺能网络调控复杂性,为解析回路机制提供关键基础。
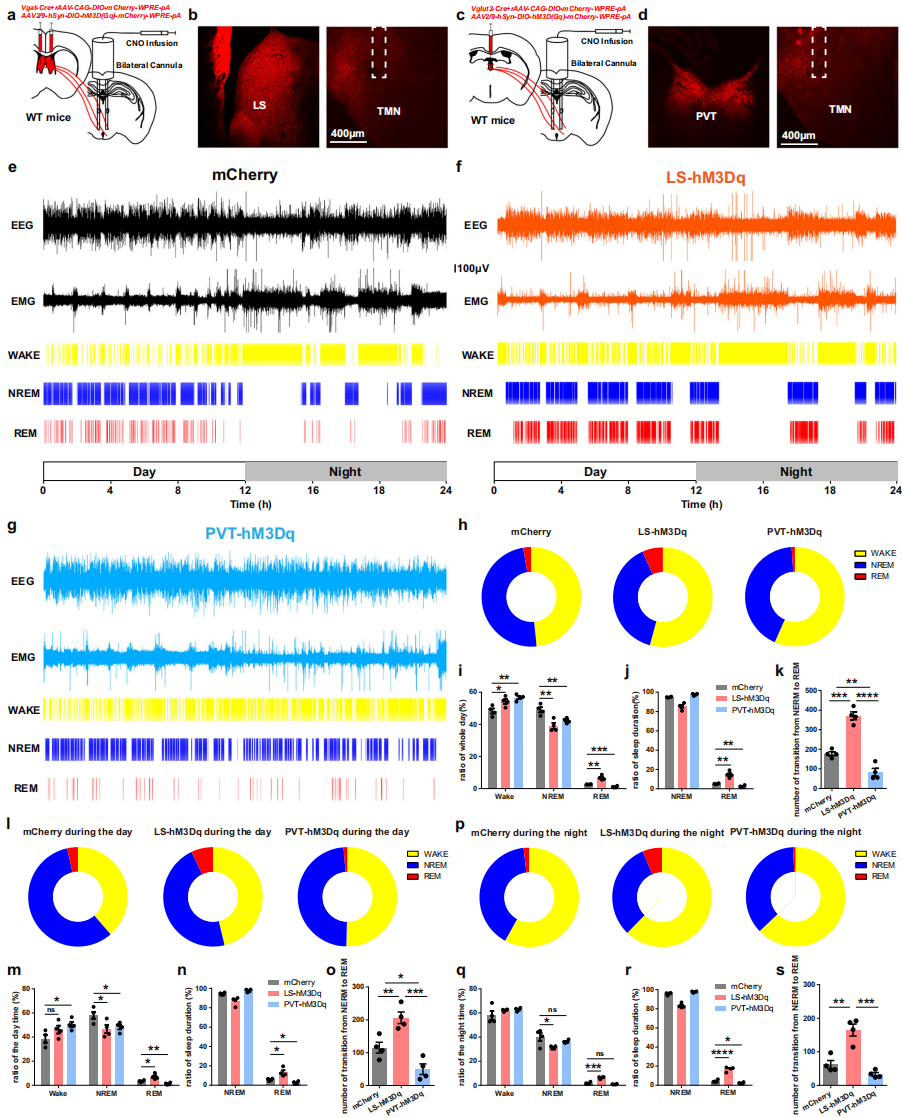
图6 LS和PVT-TMN回路在睡眠-觉醒调节中的平衡作用
本文构建了全面精确的小鼠组胺能神经元长程单突触输入全脑图谱,为未来组胺能神经回路的功能研究提供了坚实基础,揭示了不同上游输入回路在睡眠-觉醒调节中的作用,有助于深入理解组胺能系统的复杂功能。为相关神经系统疾病的发病机制研究和治疗方法开发提供了新的思路和参考。
本文使用的工具病毒布林凯斯均可提供:

同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。