泪液由泪腺等分泌,对眼表保湿和保护至关重要,其分泌不足会导致水液缺乏型干眼,全球成人患病率为5%-50%。传统认为副交感神经(PSNS)主导泪液分泌,而交感神经(SNS)的作用存在争议,其在干眼应激下的体内病理作用及下游通路尚不明确,限制了干眼治疗策略的发展。
2025年6月5日,山东第一医科大学附属眼科研究所谢立信院士、周庆军研究员团队在Nature Communications上发表题为“A gatekeeper sympathetic control of lacrimal tear secretion and dry eye onset through the NA-Adra1a-Ucp2 pathway”相关文章,研究发现交感神经系统(SNS)在泪腺中存在完整神经支配,在多种干眼应激下会被激活,通过去甲肾上腺素(NA)激活α1a肾上腺素能受体(Adra1a),调控线粒体解偶联蛋白2(Ucp2),从而减少泪液分泌并促使干眼发生。

山东第一医科大学附属眼科研究所谢立信院士和周庆军研究员为通讯作者,博士研究生曲明俐和副研究员王群为共同第一作者,该研究获得了山东第一医科大学(山东省医学科学院)临床-基础联合创新团队、山东省重点研发项目和泰山学者等项目资助。
为了可视化完整神经纤维,采用透明化方法将小鼠眶外泪腺进行荧光成像(图1a)。通过酪氨酸羟化酶(TH)的免疫标记来检测交感神经支配。经过组织透明化处理后,泪腺实现了光学透明(图1b)。结果显示,交感神经的完整网络和分支模式在单纤维分辨率下得以可视化(图1c)。随后,进行TH与血管内皮标记物CD31、腺泡细胞标记物Mist1、上皮标记物E-钙粘蛋白(ECAD)、肌上皮细胞标记物αSMA、导管细胞标记物Axna1以及副交感神经标记物胆碱乙酰转移酶(ChAT)的共免疫标记。解剖学角度来看,泪腺交感神经分为沿血管的大神经束及延伸至腺泡和间质的小纤维,多数纤维围绕腺泡和肌上皮细胞,部分靠近导管细胞(图1c-d)。定量分析表明,TH⁺交感神经的密度是 ChAT⁺副交感神经的一半(图1e),这与之前关于泪腺中副交感神经支配占主导地位的描述一致。此外,交感神经表达突触小泡和突触前末端的标记物突触素(SYP)(图1f)。最终,明确小鼠泪腺中交感与副交感神经的不同分布模式。
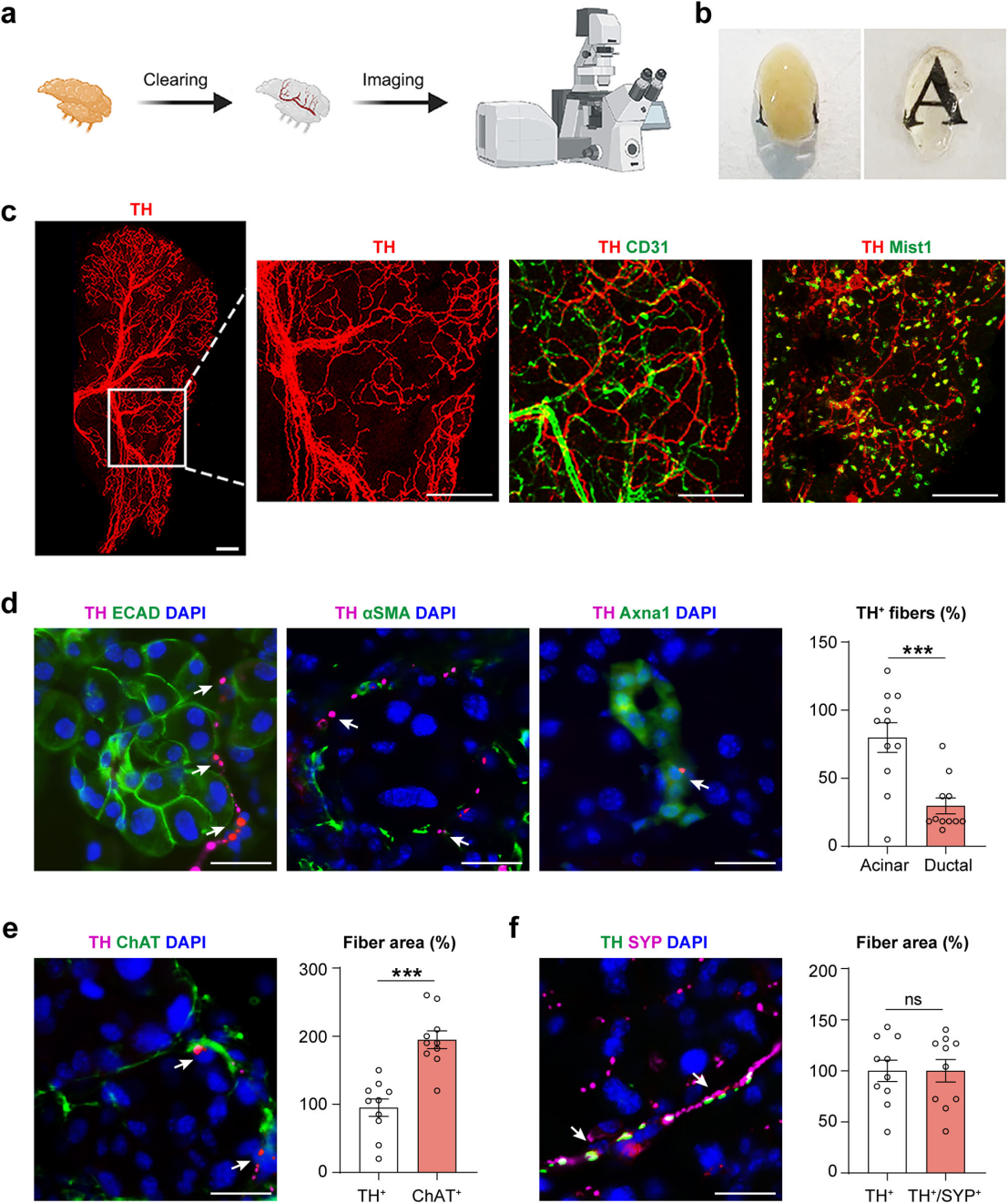
图1 小鼠泪腺交感神经的可视化
交感神经系统在 “战斗或逃跑” 反应中至关重要。为探究干眼应激下SNS 活动变化,采用东莨菪碱(SCOP)联合慢性干燥应激的干眼小鼠模型(图2a)。结果显示,SCOP处理3天后泪液减少(图2b),7天后角膜损伤(图2c)。同时,干眼小鼠交感神经颈上神经节(SCG,交感神经链中最大的神经节)中c-FOS⁺ TH⁺神经元数量较对照增加12倍(图2d),膜片钳记录显示SCG神经元动作电位频率升高(图2e)。此外,SCOP处理7天后,干眼小鼠泪腺中去甲肾上腺素(NA)浓度和交感神经密度升高(图2f-g),乙酰胆碱(ACh)浓度和ChAT表达降低(图2f),神经营养因子Ngf和Gdnf表达上调(图2h)。综上,SCOP和干燥应激可诱导泪腺交感神经激活,提示其参与调控泪液减少和干眼发生。
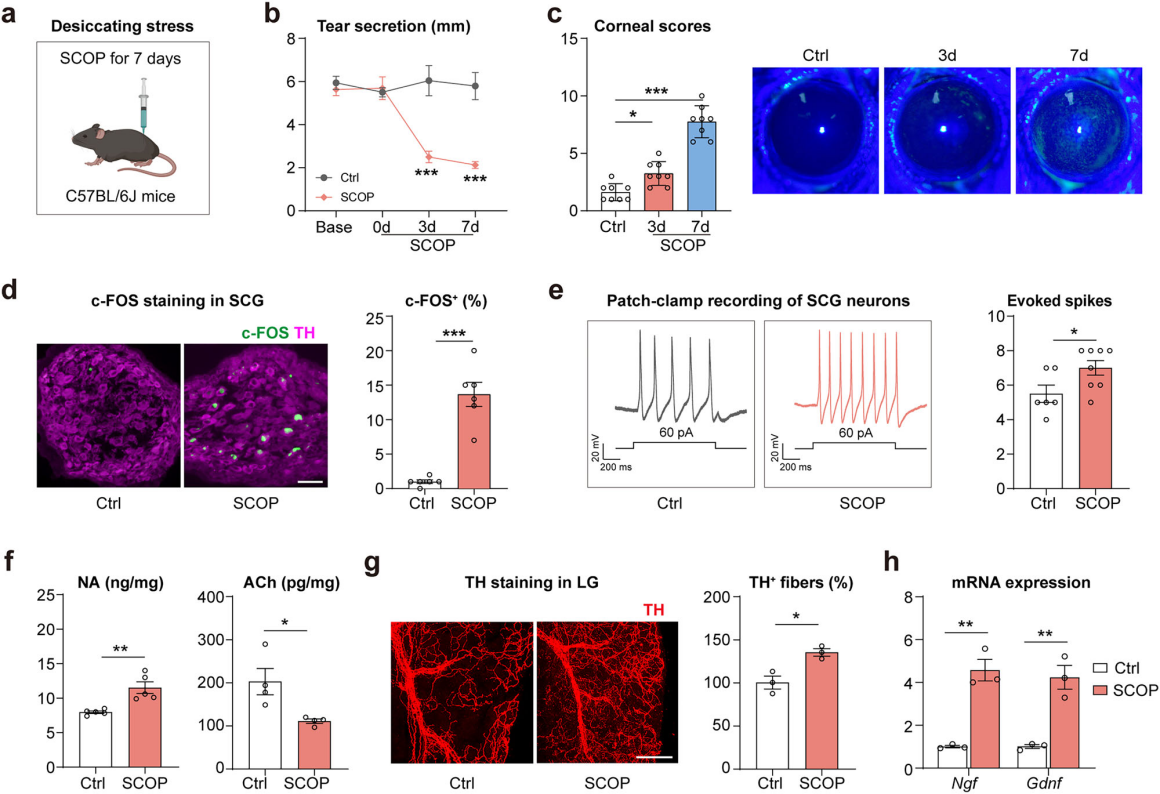
图2 干眼刺激引起交感神经激活
为阐明SNS激活在调控泪腺泪液分泌中的作用,在SCOP诱导的干眼小鼠中采用化学(6-OHDA)、颈上神经节切除术(SCGx)及基因(Th-DTR小鼠)去神经法(图3a),处理后泪腺SNS密度和NA浓度降低,6-OHDA和SCGx处理使泪液分泌分别增加,角膜损伤改善(图3b-c)。为特异性清除交感神经,将Th-cre小鼠与ROSA26i-DTR小鼠杂交生成Th-DTR小鼠,给予白喉毒素(DT)后可消融TH⁺神经元和神经(图3d)。DT处理后泪腺SNS密度和NA浓度降低,在暴露于SCOP和慢性干燥应激后,其泪液分泌(图3e)和角膜损伤(图3f)显著改善。用胍乙啶(可阻断交感神经末梢释放NA)预处理的小鼠也获得类似结果(图3d-f)。总体而言,SNS去神经和阻断可增加干眼小鼠的泪液分泌。
为验证SNS分泌的NA在调控泪液分泌中的直接作用,在6-OHDA预处理的干眼小鼠中输注NA或注射Adra1a激动剂A61603(图3g)。与空载体处理的小鼠相比,NA输注或A61603注射的小鼠重现了泪液分泌减少(图3h)和角膜损伤加重(图3i)的干眼表型,与未处理的干眼小鼠相似。肾上腺切除实验排除肾上腺来源NA影响,证实SNS分泌的NA直接导致干眼小鼠泪液减少。
为将SNS去神经改善的泪液分泌与泪腺功能恢复直接关联,研究人员进一步对小鼠泪腺进行了转录组和组织学分析。结果显示6-OHDA处理使泪腺79个基因上调和131个基因下调(图3j),KEGG分析表明,上调基因富集于分泌信号通路,下调基因富集于炎症通路(图3k)。定量PCR证实,6-OHDA处理的泪腺中Prb1(编码碱性唾液脯氨酸丰富蛋白1)和Amy1(编码淀粉酶)转录本上调,TNF-α和 IL-1β转录本下调(图3l)。综上,SNS失活通过改善干眼小鼠的泪腺功能增加泪液分泌。
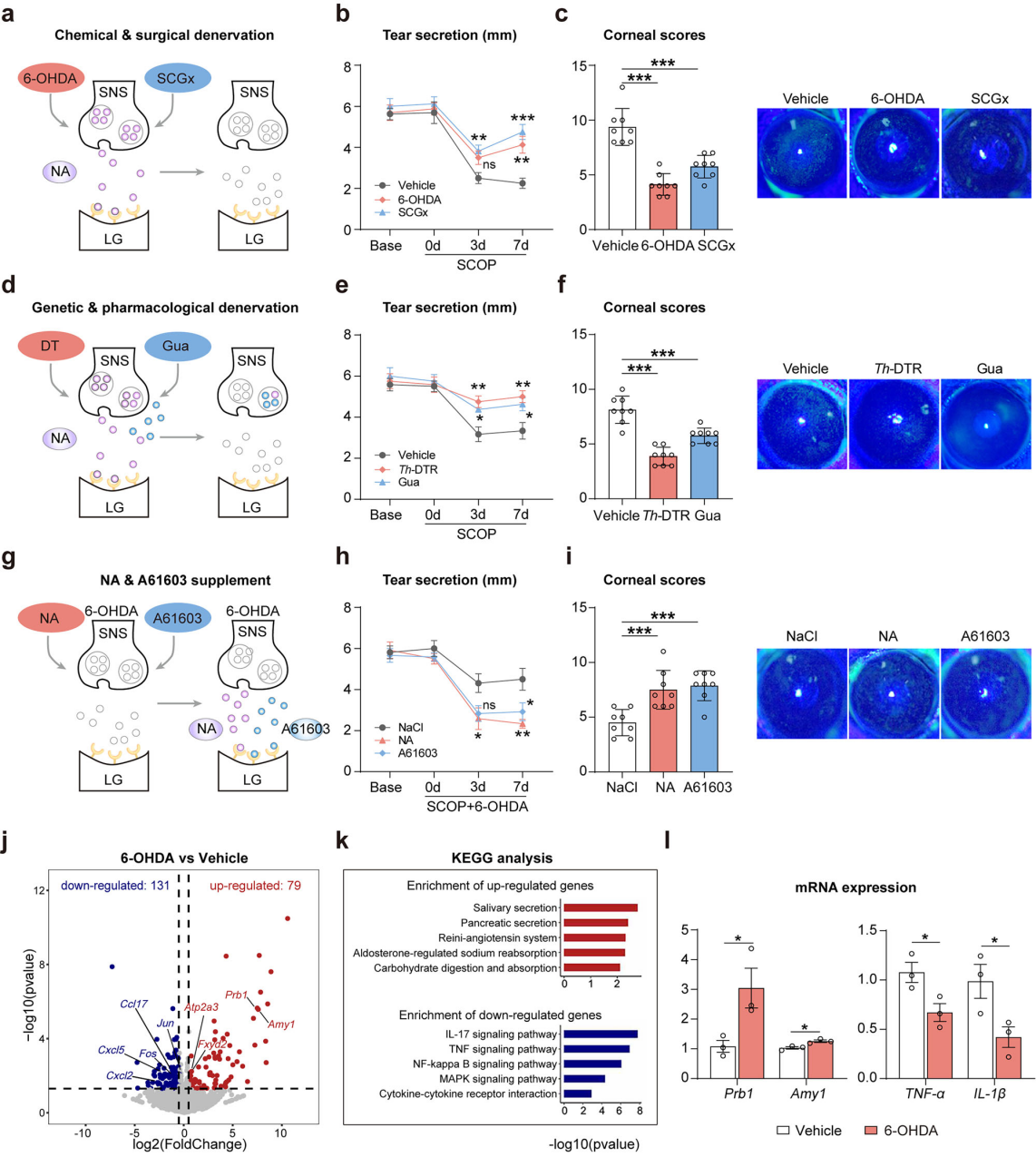
图3 SNS失活增加干眼小鼠泪液分泌
交感神经系统通过释放NA作用于肾上腺素能受体调控泪液分泌。研究检测小鼠泪腺mRNA,发现Adra1a表达最丰富(图4a)。通过给予不同拮抗剂:坦索罗辛(Adra1a拮抗剂)、BMY7378(Adra1d拮抗剂)、普萘洛尔(β1-AR和β2-AR拮抗剂)预处理干眼小鼠,仅坦索罗辛显著改善泪液分泌与角膜损伤(图4b-c)。通过杂合敲除小鼠实验(图4d)进一步明确Adra1a的主导作用:仅Adra1a⁺/⁻小鼠(而非Adra1d⁺/⁻或Adrb2⁺/⁻小鼠)的泪液分泌(图4e)和角膜损伤(图4f)得到改善。综上,药物干预和基因修饰小鼠实验均表明,Adra1a而非Adra1d或Adrb2在交感神经调控的泪液减少中起关键作用。
基于上述发现,研究解析交感神经调控机制。组织免疫标记显示,Adra1a与肌上皮和腺泡细胞共定位(图4g),通过Acta2-cre和Mist1-creERT2小鼠条件性敲低Adra1a(图4h),显著改善干眼症状(图4i-l)。纯化细胞的定量PCR表明,坦索罗辛可上调腺泡细胞泪液生成基因和肌上皮细胞泪液分泌基因表达。这些结果表明,交感神经通过调控泪腺腺泡细胞和肌上皮细胞,同时控制泪液生成与分泌。水凝胶局部递送Adra1a拮抗剂西洛多辛(图4m),显著改善干眼小鼠泪液分泌和角膜损伤(图4n-o)。综上,交感神经激活后分泌的NA通过结合腺泡和肌上皮细胞的Adra1a受体,减少干眼应激下的泪液生成与分泌。
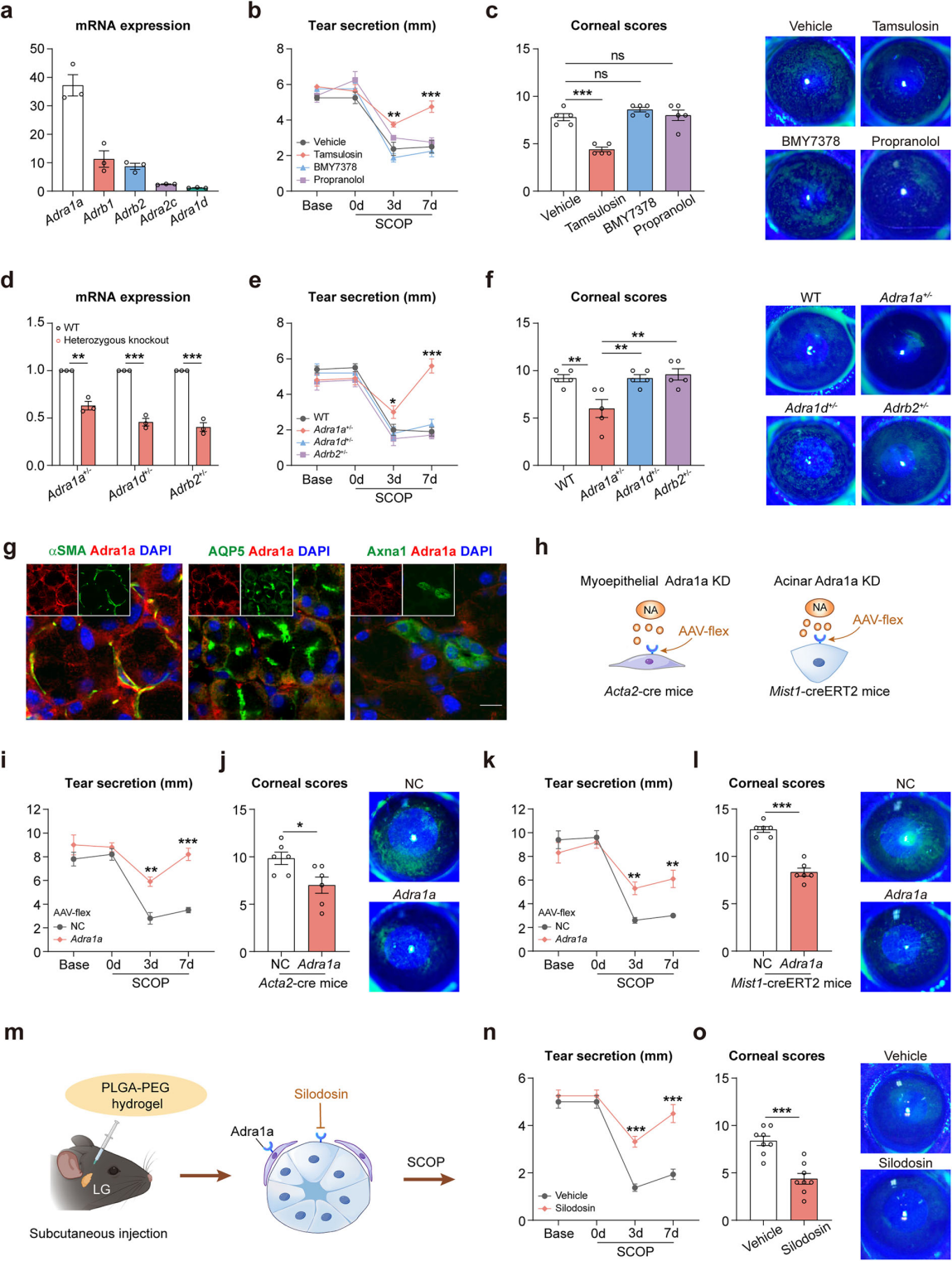
图4 Adra1a在SNS控制泪液分泌中的主导作用
干眼是一种多因素病因的疾病,其中泪腺功能障碍可导致水液缺乏型干眼疾病。为验证SNS激活在不同水液缺乏型干眼疾病中的作用,研究人员进一步研究了三种不同的干眼小鼠模型:干燥综合征(TSP-1⁻/⁻)、糖尿病和束缚应激模型,这些模型均表现出明显的泪液减少和角膜损伤(图5a-d)。与对照组和野生型小鼠相比,这三种干眼小鼠的泪腺中均出现相似的NA升高和ACh降低的变化(图5a-d)。腹腔注射Adra1a拮抗剂坦索罗辛(图5e, h, k),结果显示坦索罗辛治疗同样改善了这三种不同水液缺乏型干眼小鼠的泪液分泌(图5f, i, l)和角膜损伤(图5g, j, m)。相比之下,干燥综合征的TSP-1⁻/⁻小鼠的泪液分泌改善速度较糖尿病和束缚应激小鼠更慢。综上结果表明,泪腺的SNS激活可能是多种水液缺乏型干眼疾病的共同机制和治疗靶点。
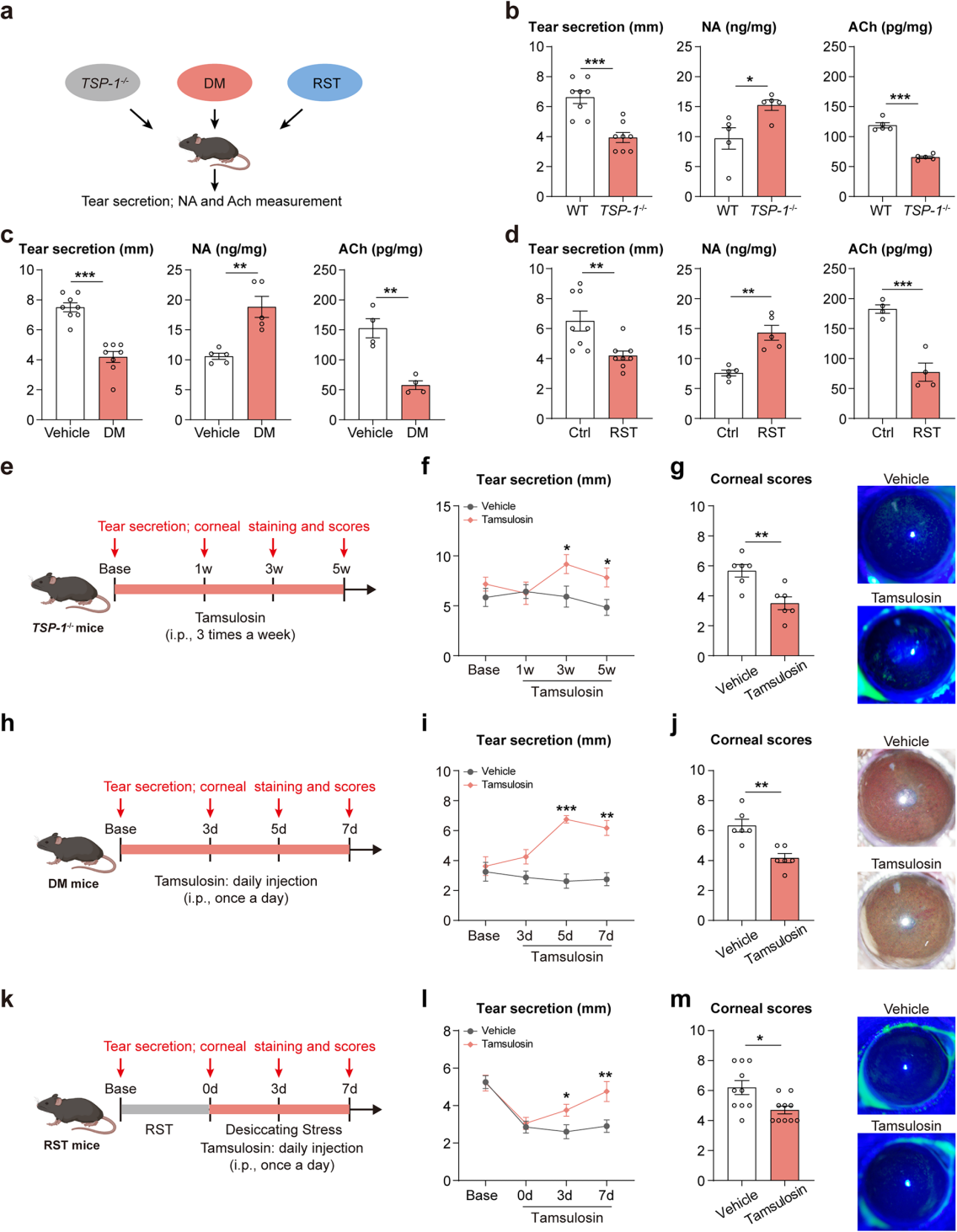
图5 Adra1a阻断在多种水液缺乏型干眼小鼠中有效
确定Adra1a主导作用后,探索SNS激活调控泪液分泌的下游通路。因解偶联蛋白 2(Ucp2)可被SNS激活并参与多种生理调控,检测发现Ucp2在小鼠泪腺中表达丰富(图6a-b),且东莨菪碱和慢性干燥应激显著上调Ucp2,免疫标记显示Ucp2与肌上皮和腺泡细胞共定位(图6c)。为明确Ucp2在SNS调控泪液分泌中的作用,在C57BL/6 J小鼠中进行干眼诱导实验,分别采用Ucp2抑制剂京尼平预处理或使用Ucp2⁻/⁻小鼠(图6d),结果显示京尼平预处理小鼠和 Ucp2⁻/⁻小鼠的泪液分泌(图6e-g)和角膜损伤(图6f-h)显著改善。向泪腺注射Ucp2干扰AAV(shUcp2)并诱导干眼,结果显示Ucp2敲低同样改善了泪液分泌和角膜损伤(图6i-j),并提升线粒体呼吸能力与DNA拷贝数(图6k-m)。综上,泪腺Ucp2主导慢性干眼应激下SNS调控的泪液分泌过程。
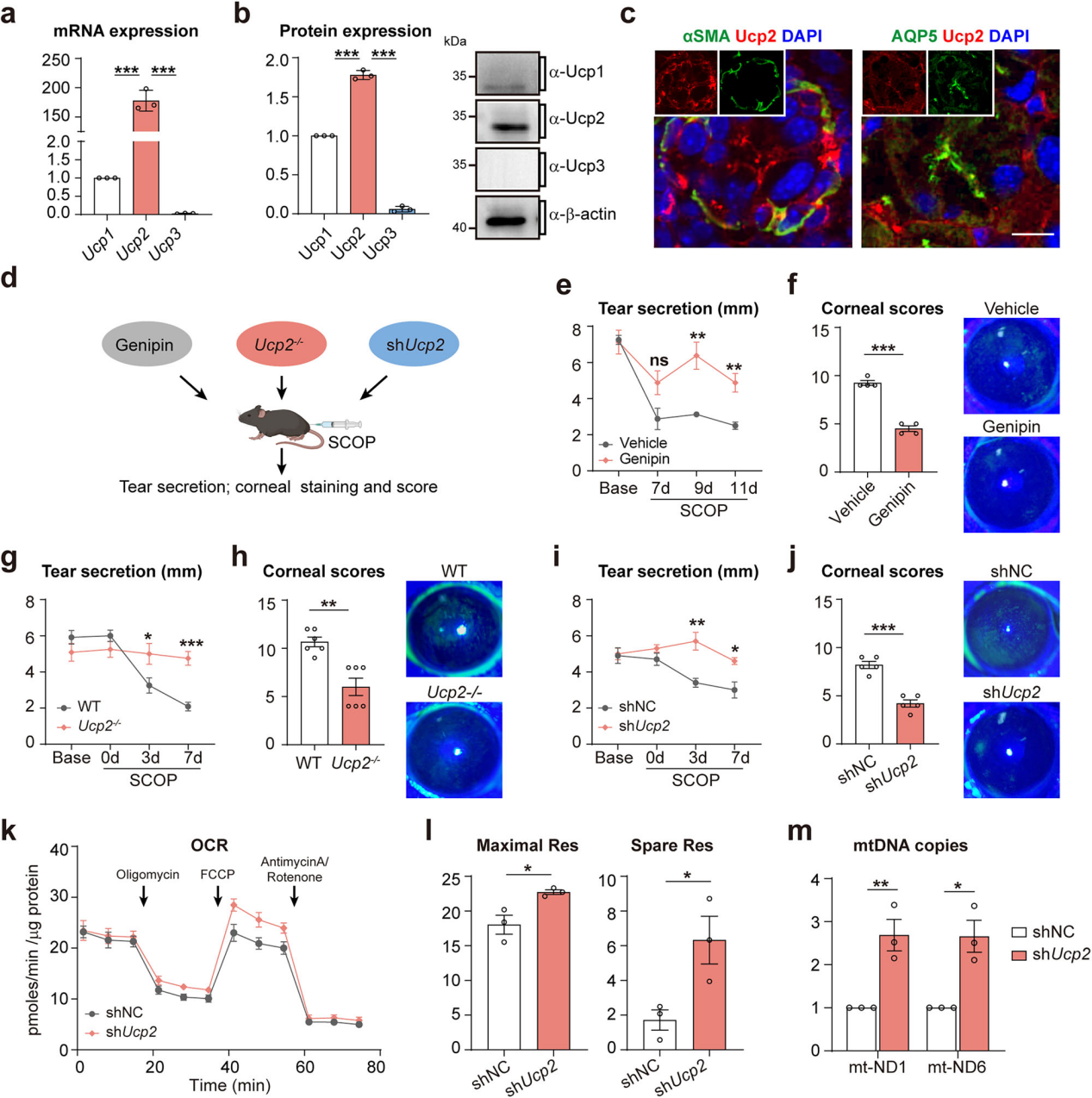
图6 Ucp2调控交感神经控制的泪液分泌
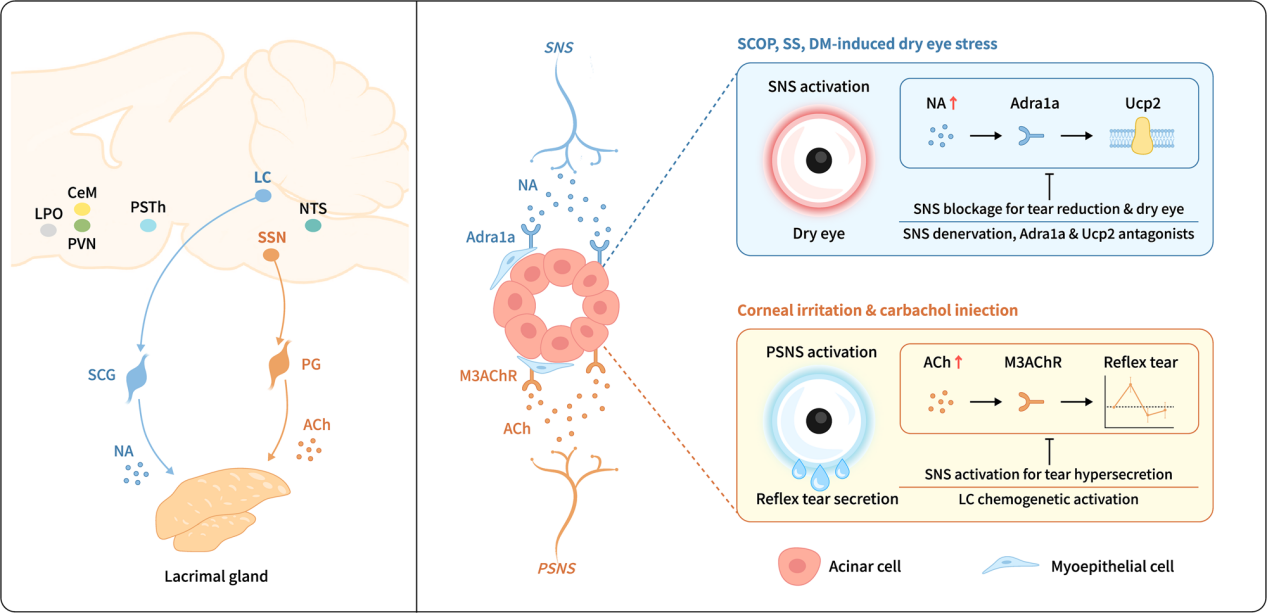
为了确定向泪腺投射去甲肾上腺素能输出的脑区,通过向泪腺和SCG分别注射表达EGFP和mRFP的PRV进行逆行跨突触追踪(图7a)。PRV注射后第2天,在已知向泪腺传递副交感神经信号的上泌涎核(SSN)中检测到GFP 信号。第3天,在蓝斑核(LC)、孤束核(NTS)和室旁核(PVN)中清晰观察到GFP和mRFP双标记信号;第4天信号增强并在更多脑区被检测到。多数双标记的LC神经元表达TH,而仅带有GFP信号的SSN神经元表达ChAT,表明SSN与LC、NTS、PVN分别是投射副交感和交感信号至泪腺的主要脑区。
蓝斑核已被报道可调节全身交感神经输出。为探讨LC在交感神经调控泪液分泌中的潜在作用,东莨菪碱处理小鼠后LC和SSN中c-FOS⁺细胞增加(图7b-c),且LC神经元动作电位爆发频率更高(图7d),提示交感神经LC和副交感神经 SSN神经元被激活。采用化学遗传学(向Th-cre小鼠LC注射编码hM4Di的AAV9)(图7e-g)和光遗传学(注射编码eNpHR3.0的AAV9)(图7i-j)抑制LC肾上腺素能神经元。结果显示,抑制LC后,Th-cre小鼠泪液分泌显著增加(图7h, k)。综上所述,LC是控制泪腺泪液分泌的关键交感神经脑核。

图7 蓝斑脑区参与SNS控制的泪液减少
接下来进一步探究蓝斑核-颈上神经节-泪腺轴(LC-SCG-LG axis)在调控反射性泪液分泌中的作用,采用角膜尼龙线刺激和腹腔注射卡巴胆碱的小鼠模型,二者均可诱发快速反射性泪液分泌。向Th-cre小鼠双LC侧注射AAV9-DIO-hM3Dq(图8a)。免疫荧光染色和电生理检测证实,给CNO后LC神经元被激活(图8b-c)。结果显示,角膜刺激诱导的反射性泪液分泌升高在该模型中被完全抑制(图8d),而卡巴胆碱注射诱导的分泌升高则部分降低(图8e)。此外,通过SCGx进行外周交感神经消融后(图8f),角膜刺激小鼠的反射性泪液分泌升高进一步增强(图8g),卡巴胆碱注射小鼠的分泌升高持续时间延长(图8h)。综上所述,LC-SCG-LG轴可以精确控制反射性泪液分泌量和持续时间,以防止泪液过度分泌。
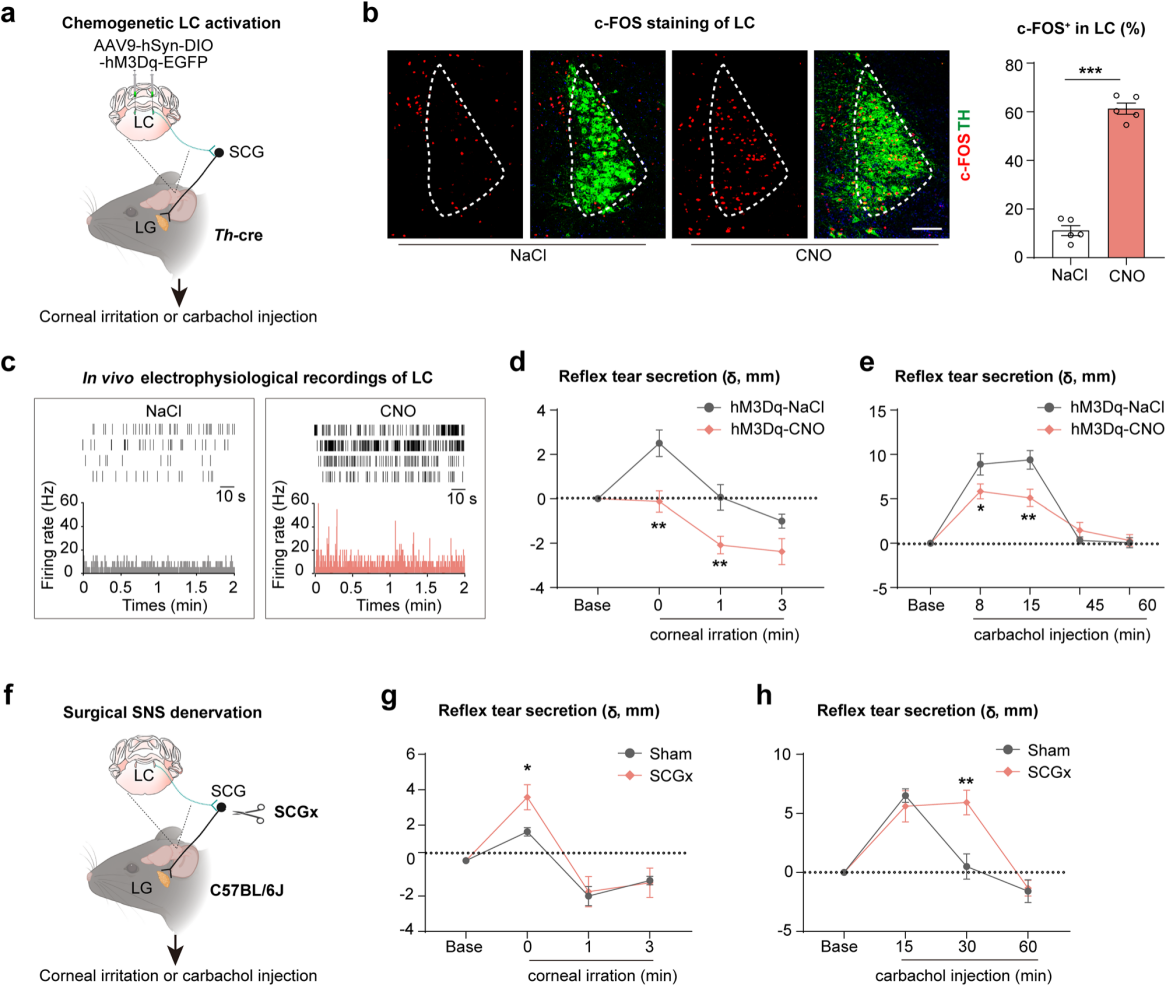
图8 SNS激活和抑制引起的反射性泪液分泌
本研究可视化了小鼠泪腺中交感与副交感神经的完整神经支配网络,首次揭示了交感神经系统(SNS)在体内作为 "守门人" 的调控作用,并鉴定出蓝斑-颈上神经节-泪腺轴(LC-SCG-LG axis)在干眼应激和反射性刺激下对泪液分泌的控制机制。这些发现不仅深化了对泪液分泌调控机制的理解,更为干眼疾病的预防和治疗提供了新的理论范式和潜在靶点。
本文使用的工具病毒布林凯斯均可提供:
同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。