肝损伤是各种肝脏疾病常见的病理生理基础,与炎症相关。神经系统通过释放神经递质、神经肽、趋化因子和其他调节分子来调节炎症反应,它感知微生物的入侵和损伤,并反射性地调节免疫反应。肝神经调节炎症,但触发炎症的具体信号及通过靶向神经治疗炎症的方法仍不明确。中医中“酸入肝”的原理表明酸刺激调节肝脏的生理和病理稳态,而脑-肝轴如何运作以及酸味神经是否会影响肝脏炎症尚不清楚。
2025年3月7日,华中科技大学同济医学院同济医院器官移植研究所兰培祥、陈知水及刘静团队在 Journal of Hepatology上在线发表题为“Sour neuronal signalling attenuates macrophage mediated liver injury”的文章,研究表明酸刺激可减轻人类和小鼠的肝缺血再灌注损伤(IRI),并明确了脑-肝轴在肝 IRI中的关键作用,通过神经元分泌的TAFA2(TAFA 趋化因子样家族成员2) 招募 CCR2(C-C趋化因子受体2受体)激活巨噬细胞来介导肝 IRI,这一发现为肝病治疗提供了新见解和潜在的治疗策略。
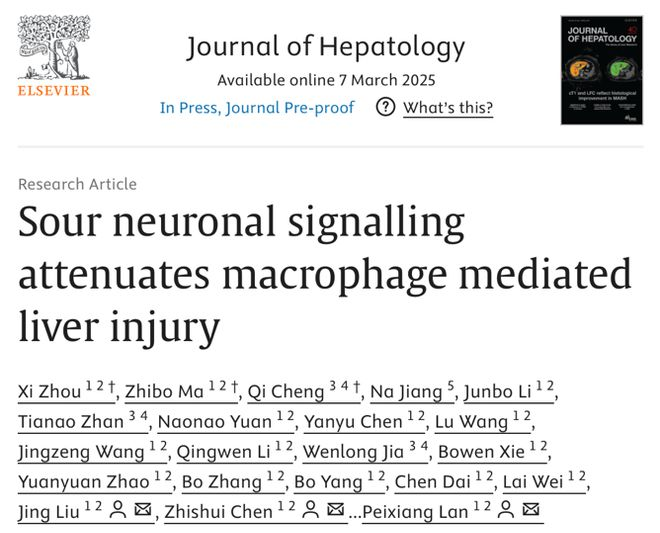
为探讨酸味对肝损伤的影响,研究构建肝缺血再灌注损伤(IRI)小鼠模型并进行酸刺激(柠檬酸),发现酸刺激可减少肝组织损伤以及血清标志物水平,而使用丁卡因阻断神经冲动局麻小鼠舌头或者灌胃柠檬酸时,酸刺激的保护作用被消除。NMDAR阻断剂立体定向注射到小鼠VPM脑区后,酸刺激后IRI肝的血清标志物水平和肝损伤程度无明显变化。这些结果表明神经系统在酸刺激减轻肝IRI过程中起重要作用。

图1 酸通过神经减轻小鼠肝脏缺血再灌注损伤
为绘制大脑和肝脏的联系,研究在小鼠VPM区注射单纯疱疹病毒 H129-hUbC- HBEGFP,发现脑、肝脏及腹腔神经节(CG)中均有荧光蛋白的表达。腹腔神经节切除后(CGX),酸刺激并没有降低IRI小鼠模型肝的组织损伤和血清标志物。这些结果进一步表明酸性刺激通过神经通路包括舌头、大脑和 CG介导肝脏保护效应,即脑-CG-肝轴。
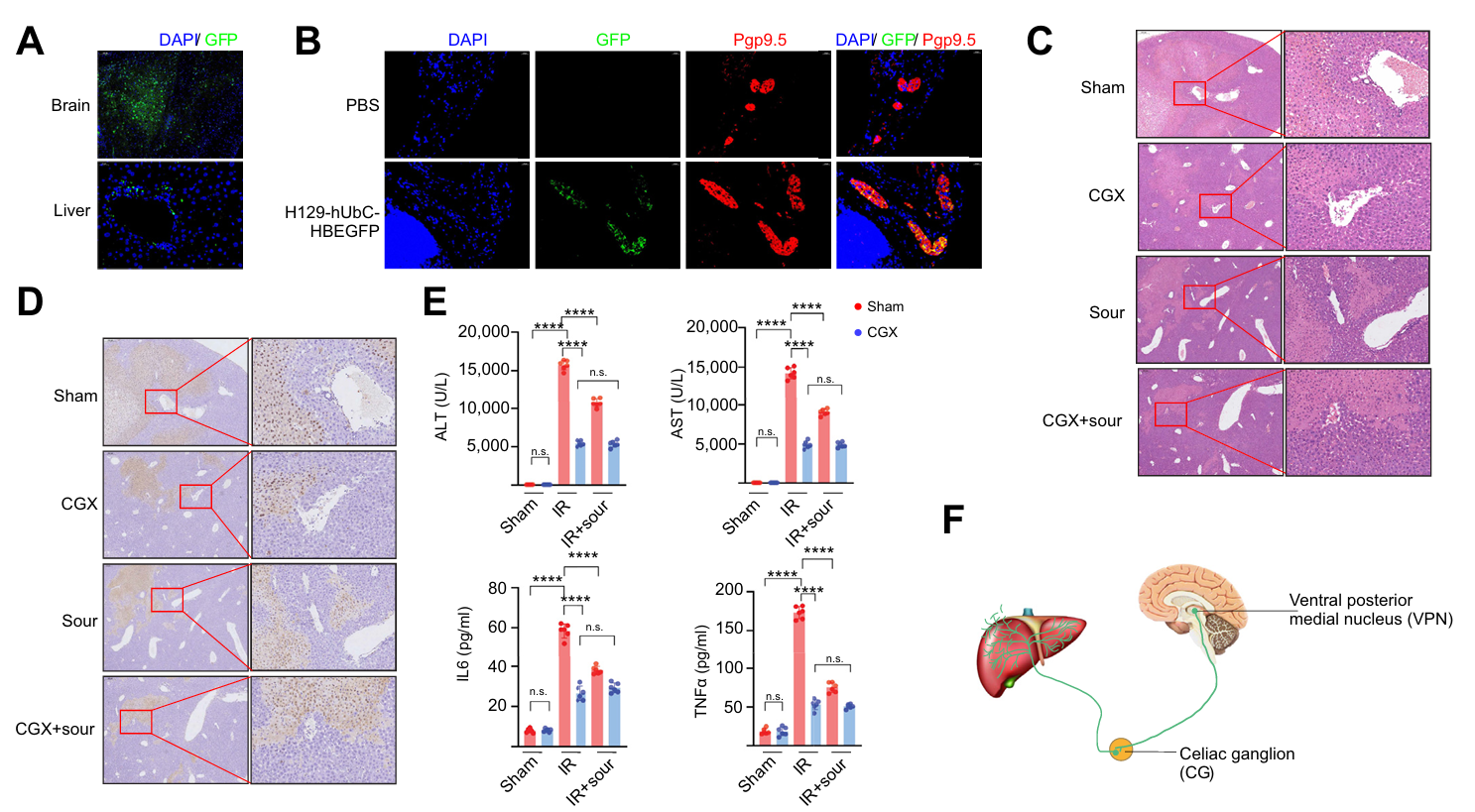
图2 大脑和肝脏中H129感染的神经元分布图
为探究酸味刺激肝和腹腔神经节(CG)的基因表达情况,研究对肝IRI、肝IRI + 酸味刺激及假手术的小鼠进行肝脏和CG单细胞核转录组测序,结果显示肝IRI 时,免疫细胞簇扩大,酸味刺激可减少该现象。TAFA2在神经元中特异性表达, IRI 时被诱导表达上调,酸味刺激后抑制其表达。海马神经元细胞系 HT22 中,钾离子可诱导TAFA2表达,而其他炎症因子不能;电压门控钾通道抑制剂可减少 TAFA2产生和肝损伤。这些结果表明酸刺激通过抑制肝内神经元中钾离子诱导的 TAFA2表达,实现神经系统减轻肝IRI。
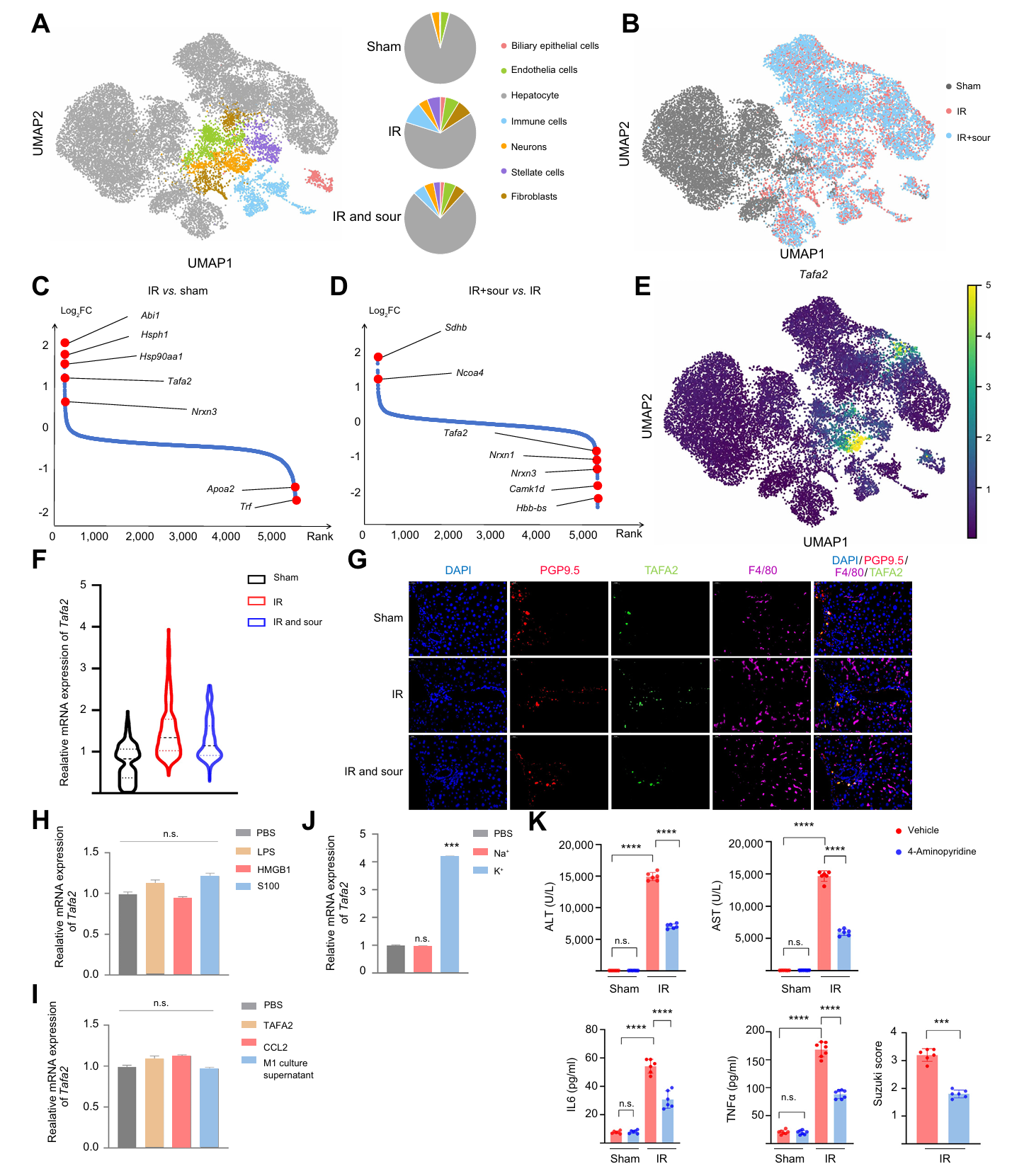
图3 酸性刺激可抑制肝IRI期间内皮细胞中TAFA2的表达
为探究神经元TAFA2在肝缺血再灌注损伤(IRI)中的作用,研究选用Tafa2敲除(KO)小鼠和AAV病毒(AAV-hSyn-EGFP-sh-Tafa2)实现的TAFA2敲低小鼠,发现TAFA2敲低或敲除可改善IRI引起的巨噬细胞浸润,肝组织损伤、细胞死亡及血清标志物升高。这进一步表明TAFA2在肝IRI中起关键促进作用,抑制其表达可减轻肝损伤。
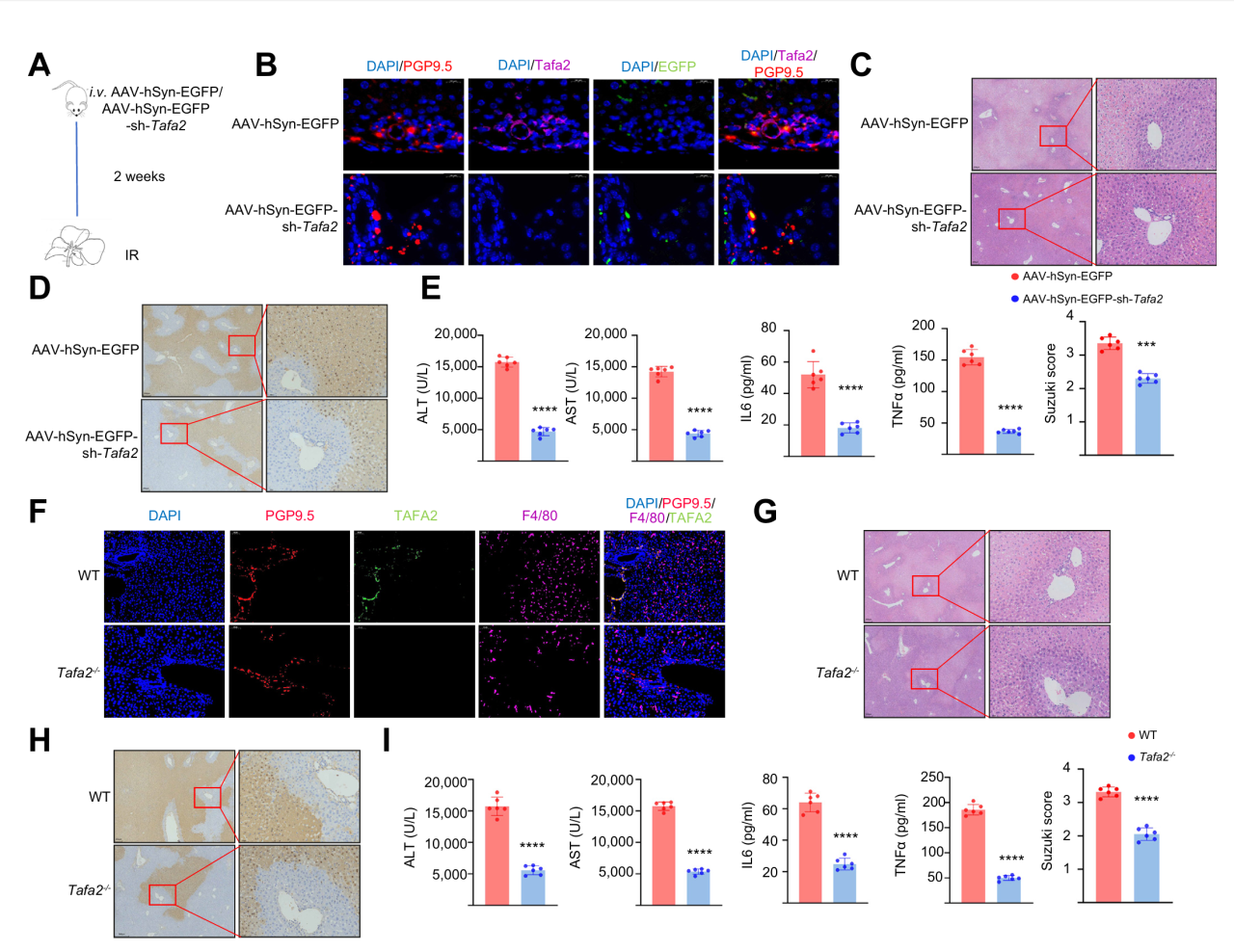
图4 Tafa2基因敲除或敲低均能减轻小鼠肝IRI
为阐明肝IRI中免疫细胞特征,研究通过单细胞测序发现肝IRI 时巨噬细胞簇比例增加且其炎症相关基因(如 Il1β、Il6、Tnf、S100)表达上调,而酸性刺激可减少这些基因表达。通过 FLAG 标记 TAFA2 结合实验及流式细胞术证实 TAFA2 特异性结合巨噬细胞,且 TAFA2 敲除或敲低会抑制 IRI 时巨噬细胞向肝脏浸润。体外实验也表明 TAFA2 可激活骨髓来源巨噬细胞并诱导炎症因子表达,证实巨噬细胞被 TAFA2 激活并介导肝脏IRI。
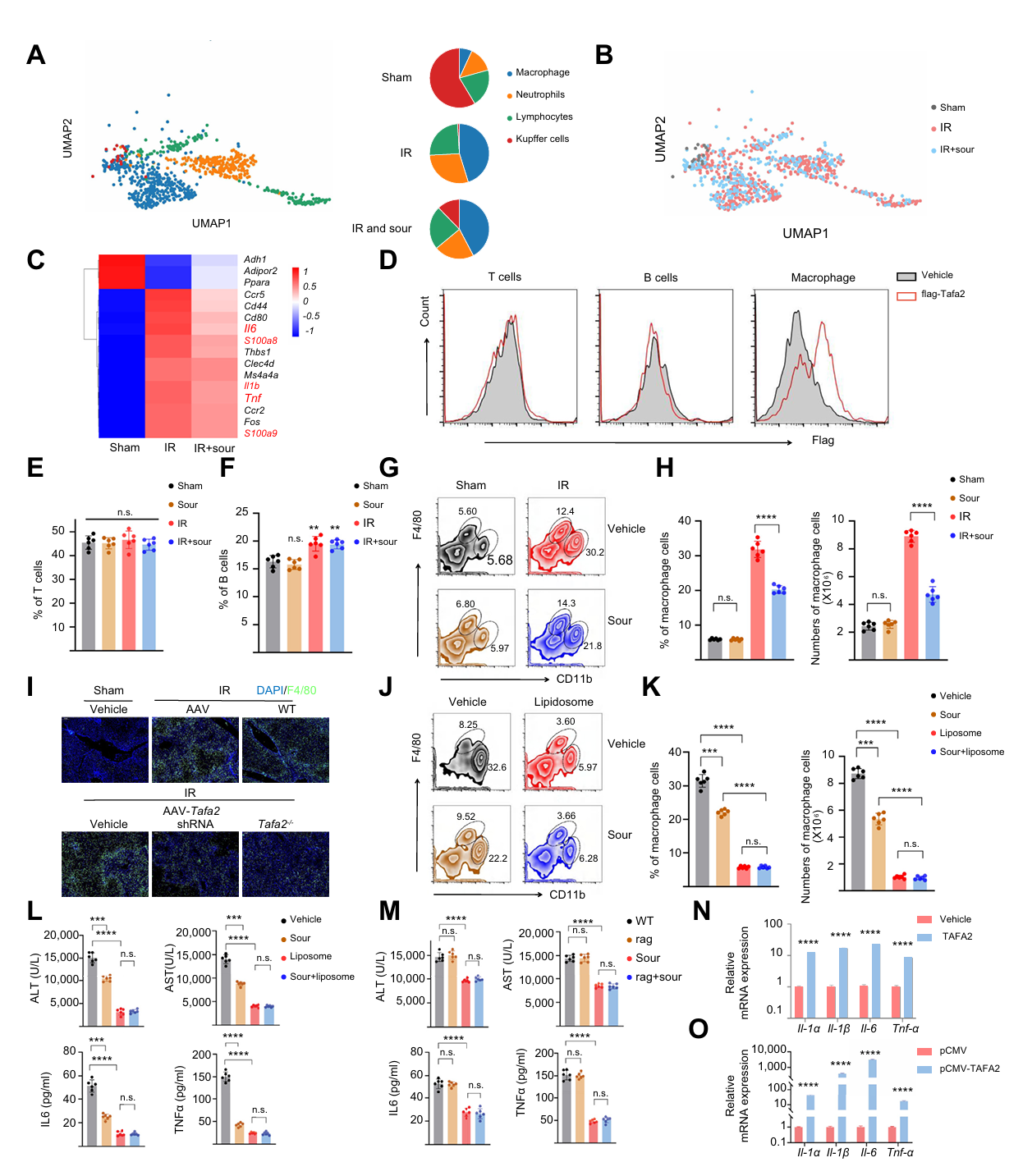
图5 TAFA2使得IRI中巨噬细胞的比例增加并促进炎症细胞因子的生成
为了探究TAFA2与巨噬细胞的相互作用机制及CCR2的功能,研究首先通过免疫沉淀、质谱分析、流式细胞术等实验证实 CCR2 是巨噬细胞TAFA2的特异性受体。RNA-seq分析确认TAFA2或CCL2刺激的骨髓来源巨噬细胞(BMDM)转录谱几乎一致,66个与粘附、代谢、Ras信号通路相关差异基因表达上调,195个代谢和核糖体通路相关基因表达下调,TAFA2诱导的 Il1α、Il1β、Il6、Tnfα 等炎症基因及干扰素刺激基因表达水平更高,促进巨噬细胞介导的炎症响应。进一步活体实验表明CCL2对巨噬细胞的作用依赖于CCR2,TAFA2主要通过CCR2促进巨噬细胞介导的炎症反应,同时巨噬细胞上可能存在其他TAFA2受体。
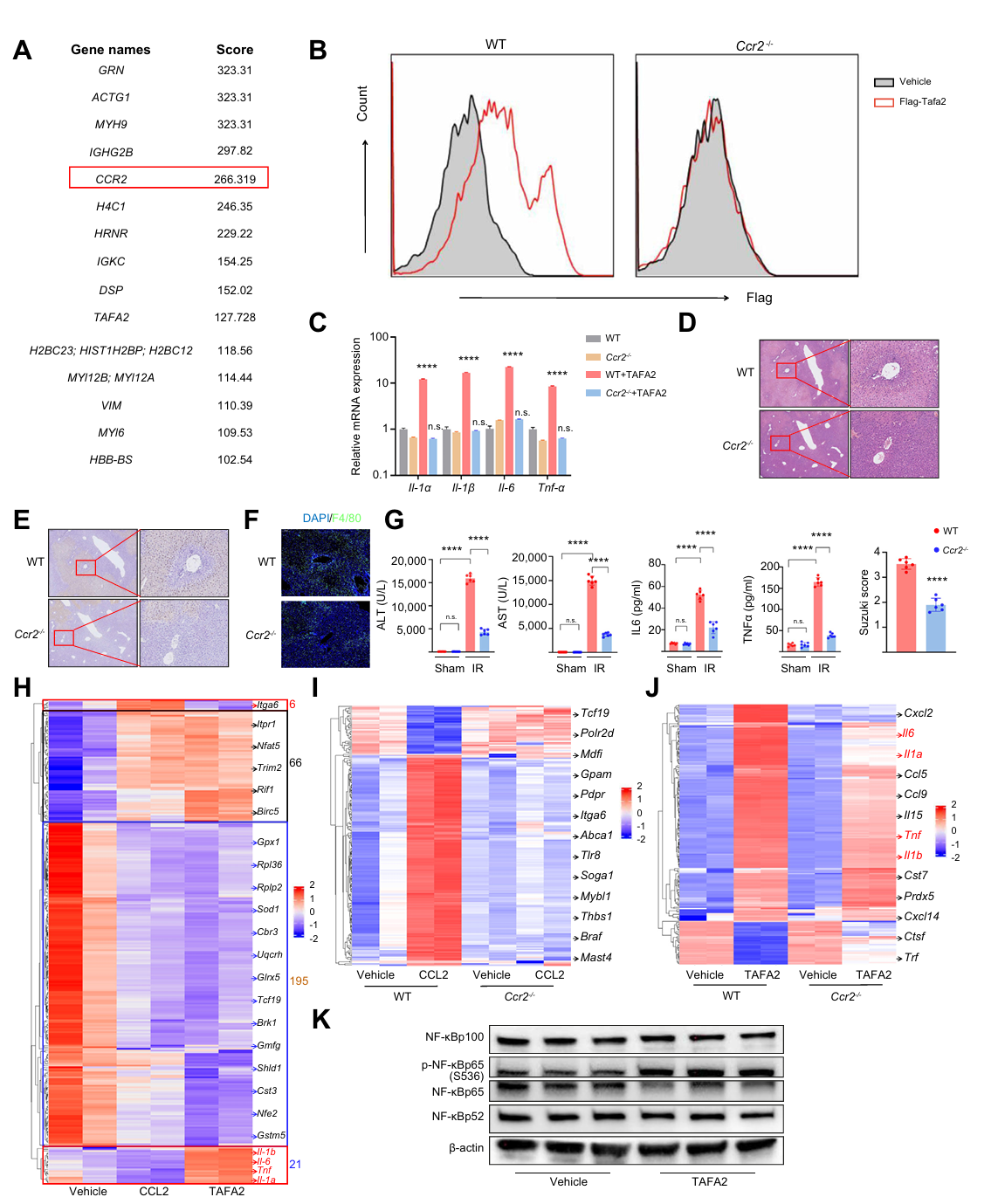
图6 TAFA2与巨噬细胞表面的CCR2受体相互作用
为验证酸刺激在人类肝脏IRI中的作用,研究在武汉开展开放随机空白对照临床试验,将66例肝切除术患者分为酸味组(25 mM柠檬酸术前24小时开始每8小时含漱5分钟)和对照组,其中6名因术中肝缺血超过30分钟而退出,4名因依从性差(即未按指示漱口)退出。结果显示人类试验中酸味组术后血清ALT、AST水平显著低于对照组,重度肝损伤(ALT>500 U/L)发生率为0%(对照组 40%),且小鼠模型中酸刺激同样减轻肝IRI,这些结果证实酸刺激可通过降低术后严重肝损伤风险,有效缓解人类和小鼠肝切除术中的肝IRI。
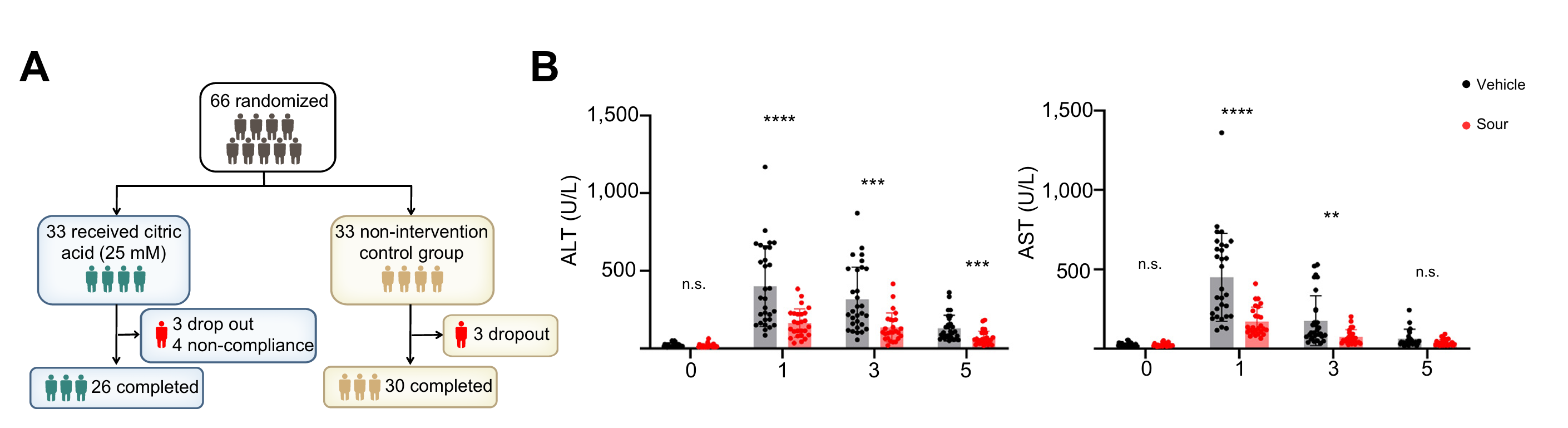
图7 在人肝脏切除术中,酸性刺激可减弱肝IRI
这项研究首次揭示了脑-肝轴在肝损伤中的调控作用,阐明了酸味刺激通过神经信号通路缓解肝损伤的机制。这一发现为临床肝切除术中减少肝脏缺血再灌注损伤提供了新的干预手段,具有重要的临床应用价值。
华中科技大学同济医学院附属同济医院器官移植研究所周曦博士、马智博博士和肝脏外科程琪副教授为论文的共同第一作者。华中科技大学同济医学院附属同济医院器官移植研究所兰培祥研究员、陈知水教授、刘静博士为论文的共同通讯作者。
本文使用的工具病毒布林凯斯均可提供:

同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。