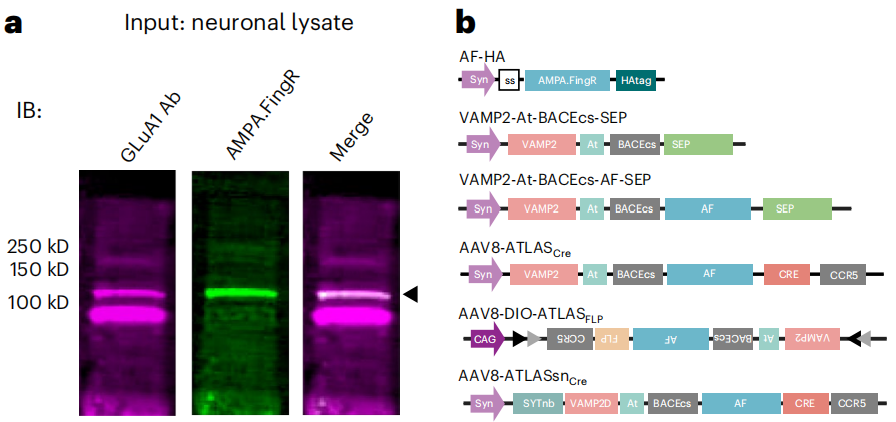
本文介绍了一种名为ATLAS(anterograde transsynaptic label based on antibody-like sensors)的顺向跨突触示踪技术,它基于合理设计的蛋白质,能从基因确定的神经元进行顺向跨突触标记。通过mRNA展示筛选出与GluA1受体结合的AMPA.FingR(AF),构建ATLAS蛋白并验证其能介导跨突触示踪。实验表明,ATLAS在体内外均能实现严格顺向、跨单突触、活动依赖的神经元示踪,且不阻断突触传递,还可用于标记多种神经环路,其组件可独立替换或修改,为神经环路研究提供了有力工具。

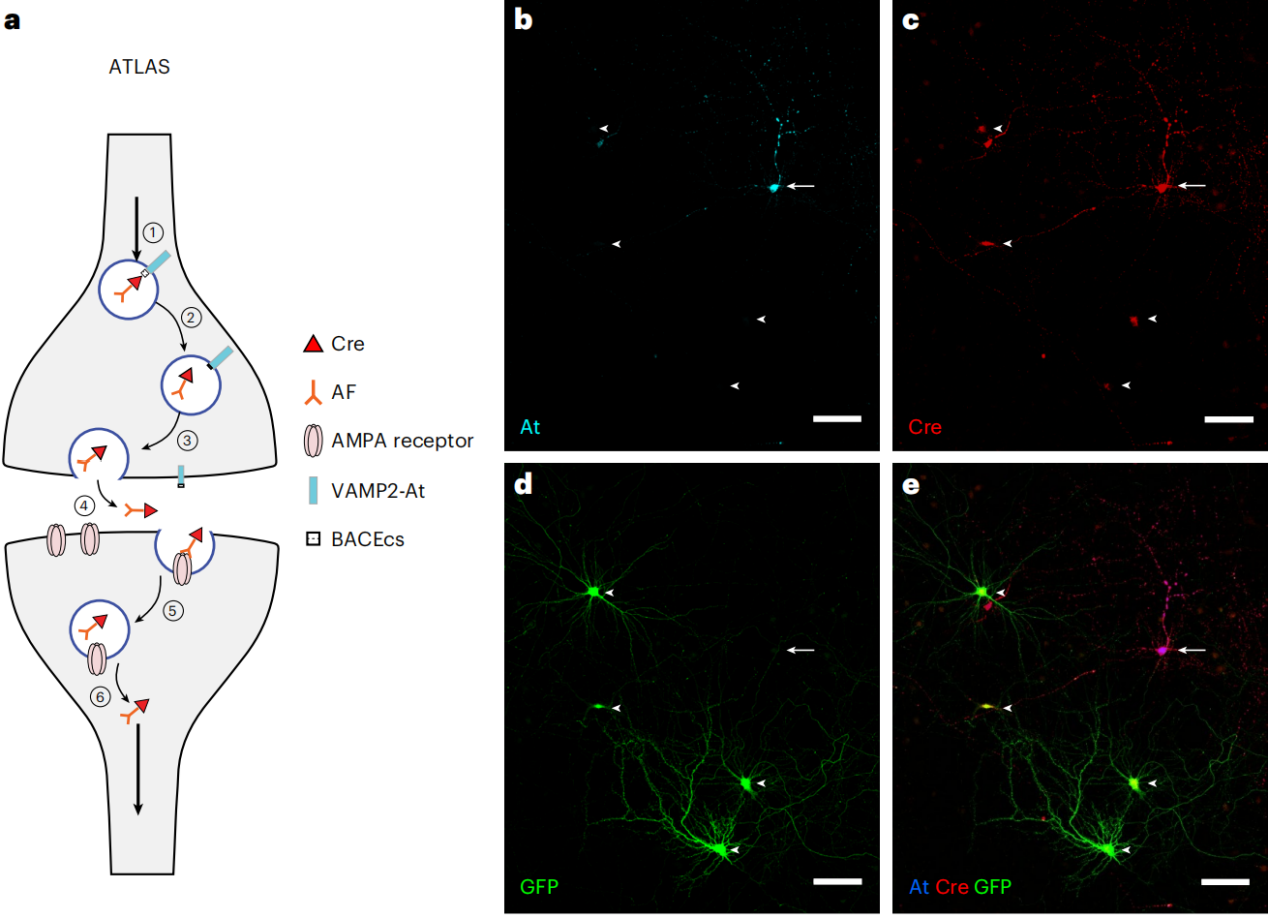
利用mRNA展示技术从文库中筛选出与GluA1受体结合的Fn9.3克隆,即AMPA.FingR(AF;FingR代表用mRNA展示技术生成的纤维连接蛋白胞内抗体)。AF能特异性结合GluA1受体,在神经元中部分定位于突触周围和内吞区域,且可通过内吞进入细胞。将AF与突触前蛋白VAMP2融合,插入突触前细胞内源性BACE1酶切位点和表位标签ALFA-tag(At),构建VAMP2-At-BACEcs-AF-Cre(ATLAS-Cre)。ATLAS-Cre表达后,AF-Cre可释放到突触间隙,结合到突触后膜的AMPA受体,再通过内吞进入细胞核,实现对突触后细胞提供遗传访问。
将ATLAS-Cre转染到感染AAV编码floxed-GFP报告基因(AAV8-DIO-GFP)的解离细胞培养物中,观察到一些表达GFP和Cre但未被起始细胞标记物At标记的细胞,这与Cre的跨神经元转运以及floxed等位基因的重组情况相符,意味着Cre已被转运至细胞核,这些结果证明ATLAS能介导跨突触示踪并提供遗传访问。
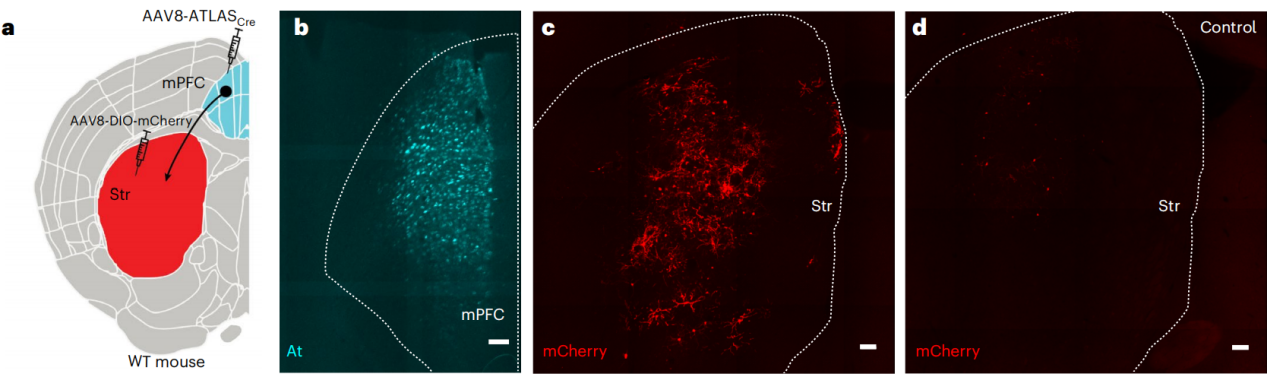
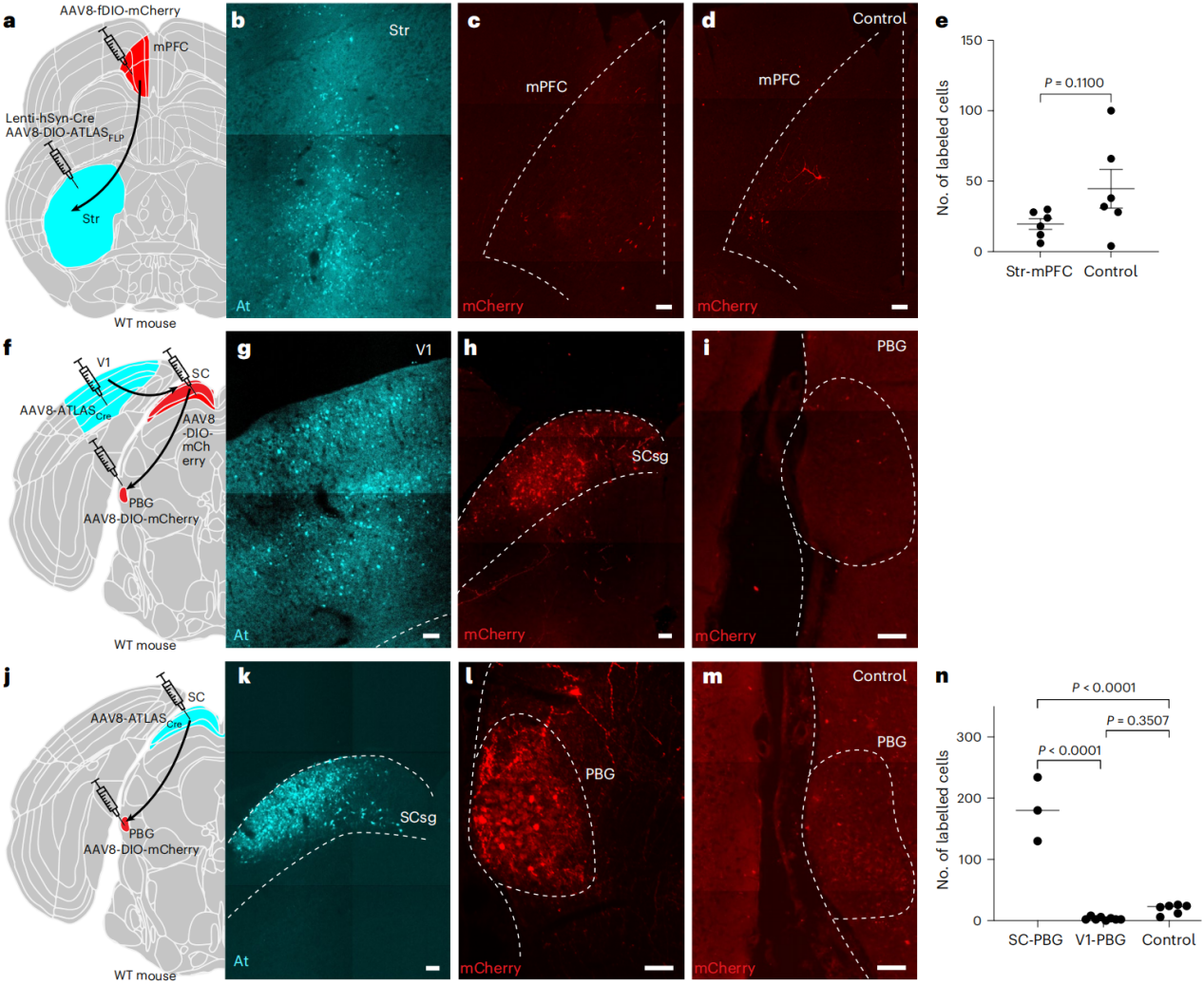
将AAV8-ATLAS-Cre注射到小鼠的内侧前额叶皮层(mPFC)中,将AAV8-DIO-mCherry注射到小鼠的纹状体(Str)中,以追踪从mPFC到Str的单向投射。1周后,在mPFC中发现At染色标记的阳性细胞,在Str中发现有大量mCherry阳性细胞,表明ATLAS能介导跨突触运输Cre,使细胞被mCherry标记。
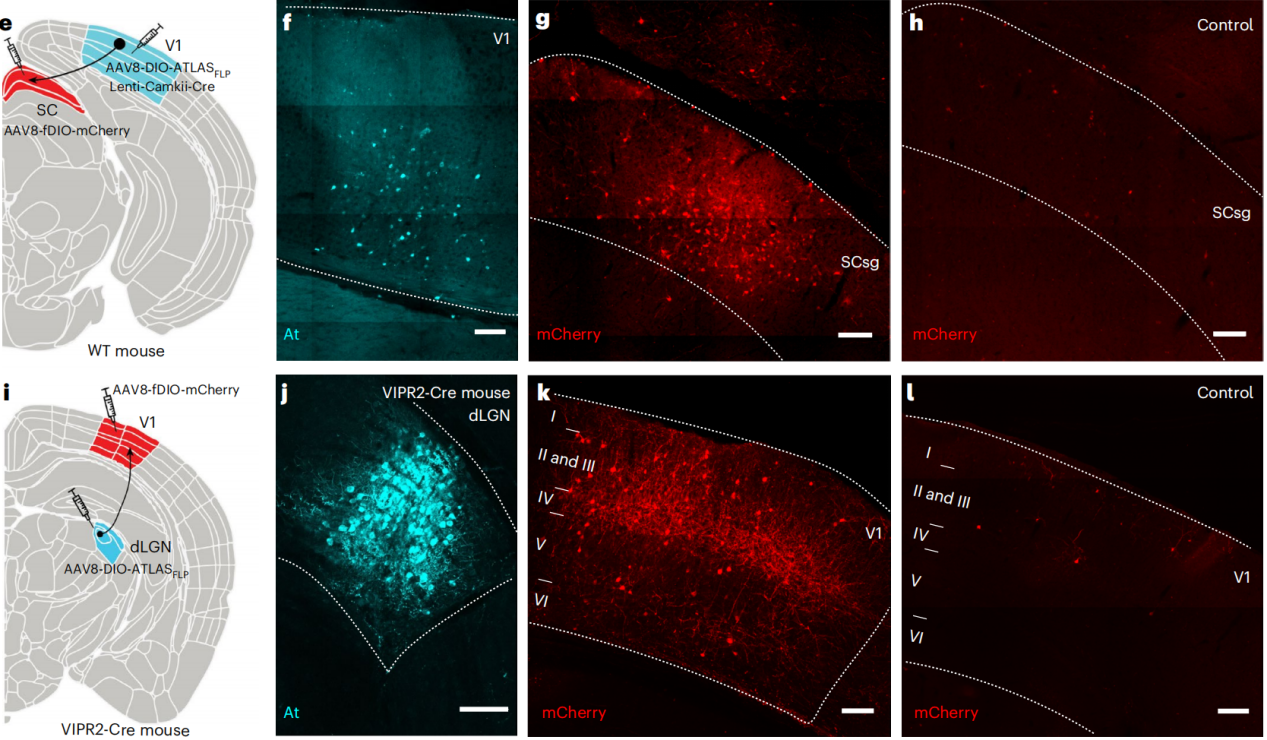
构建AAV8-DIO-ATLAS-FLP,将Lenti-CamkII-Cre慢病毒与AAV8-DIO-ATLAS-FLP共注射到野生型小鼠的初级视觉皮层(V1),并将AAV8-fDIO-mCherry注射到小鼠的上丘(SC)中,其中对照组只在SC注射病毒。结果显示,实验组V1区At染色阳性,SC区有大量mCherry阳性细胞,而对照组仅有少量弱阳性细胞。
将AAV8-DIO-ATLAS-FLP注射到VIPR2-Cre小鼠的背外侧膝状核(dLGN),AAV8-fDIO-mCherry注射到小鼠的V1中。结果显示,At染色特异性定位于dLGN,而V1区有mCherry阳性细胞,证明ATLAS能够在野生型和转基因小鼠中从Cre阳性神经元实现顺向示踪。
通过补充外源BACE后评估ATLAS示踪效率变化,将AAV8-BACE-HA和AAV8-ATLAS-Cre以1:1比例共同注射到mPFC时,它对于 mCherry 标记的突触后细胞的数量没有显著影响,而将AAV8-BACE-HA和AAV8-ATLAS-Cre以5:1比例共同注射到mPFC时,Str中mCherry标记的细胞数量显著增加,约10%的突触后神经元被标记。因此,在补充外源性BACE后,ATLAS对Str细胞的标记密度与YFV(基于黄热病YFV-17D灭活疫苗顺向示踪系统)相当。

由于ATLAS的摄取是由GluA1受体介导的,而抑制性突触上不存在GluA1受体,因此如果在抑制性神经元中表达ATLAS,任何跨神经元标记都必然是非突触性的。在SST-Cre小鼠中,将AAV8-DIO-ATLAS-FLP和AAV8-fDIO-mCherry注射到V1,2周后发现几乎所有mCherry标记的细胞都与At共标记,表明ATLAS通过跨突触来标记突触后神经元。

为了测试 ATLAS 是否破坏突触传递,在野生型小鼠的mPFC共注射AAV8-ATLASsn-Cre、AAV8-BACE-HA和AAV8-DIO-ChR2-GFP,在Str注射AAV8-DIO-mCherry,4周后切片做脑片记录,结果发现当记录标记的突触后细胞时,与未标记细胞相比,ChR2诱发的EPSC的振幅表现出不显著的增加,表明ATLAS没有阻断突触传递,且ATLAS不引起可检测的毒性。
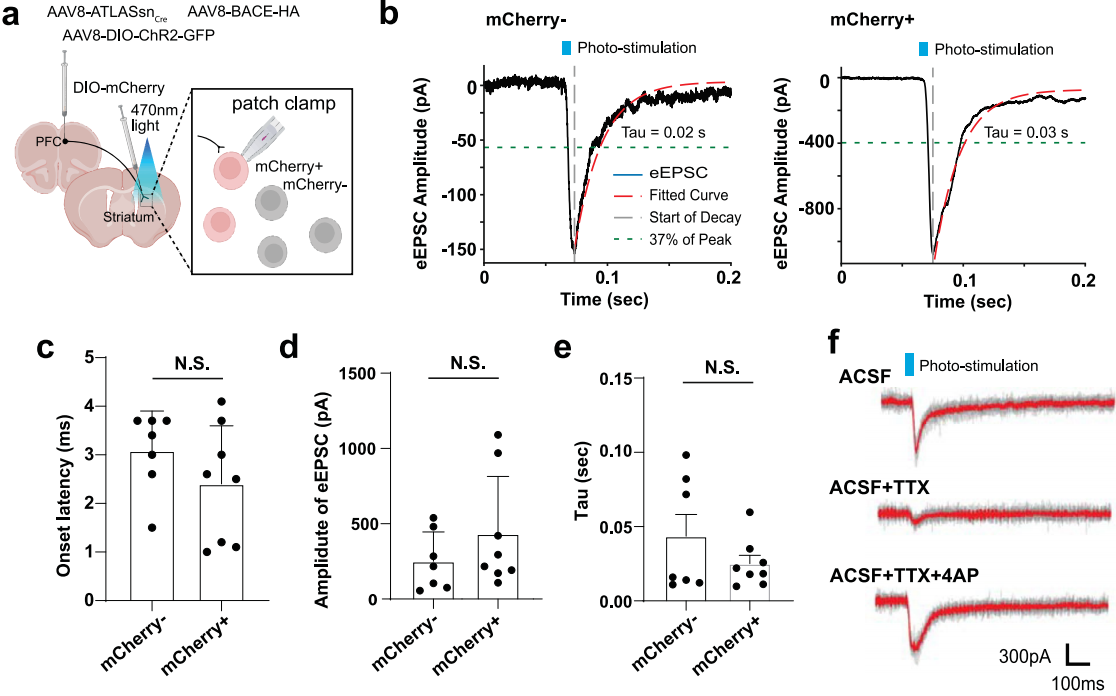
在V1-Str环路中测量光遗传诱发电流,将AAV8-ATLASsn-Cre和AAV8-BACE-HA混合注射到V1,并将AAV8-DIO-mCherry/tdTomato注射到背内侧纹状体(DMS)。两周后,在V1中与第一次注射相同的区域注射AAV8-DIO-ChR2-GFP,以操控由ATLAS标记的突触前输入,同时尽量减少ATLAS和ChR2之间的表达竞争。结果发现ATLAS标记的细胞比未标记细胞更可能接受突触输入,且突触连接更强的细胞更易被标记。
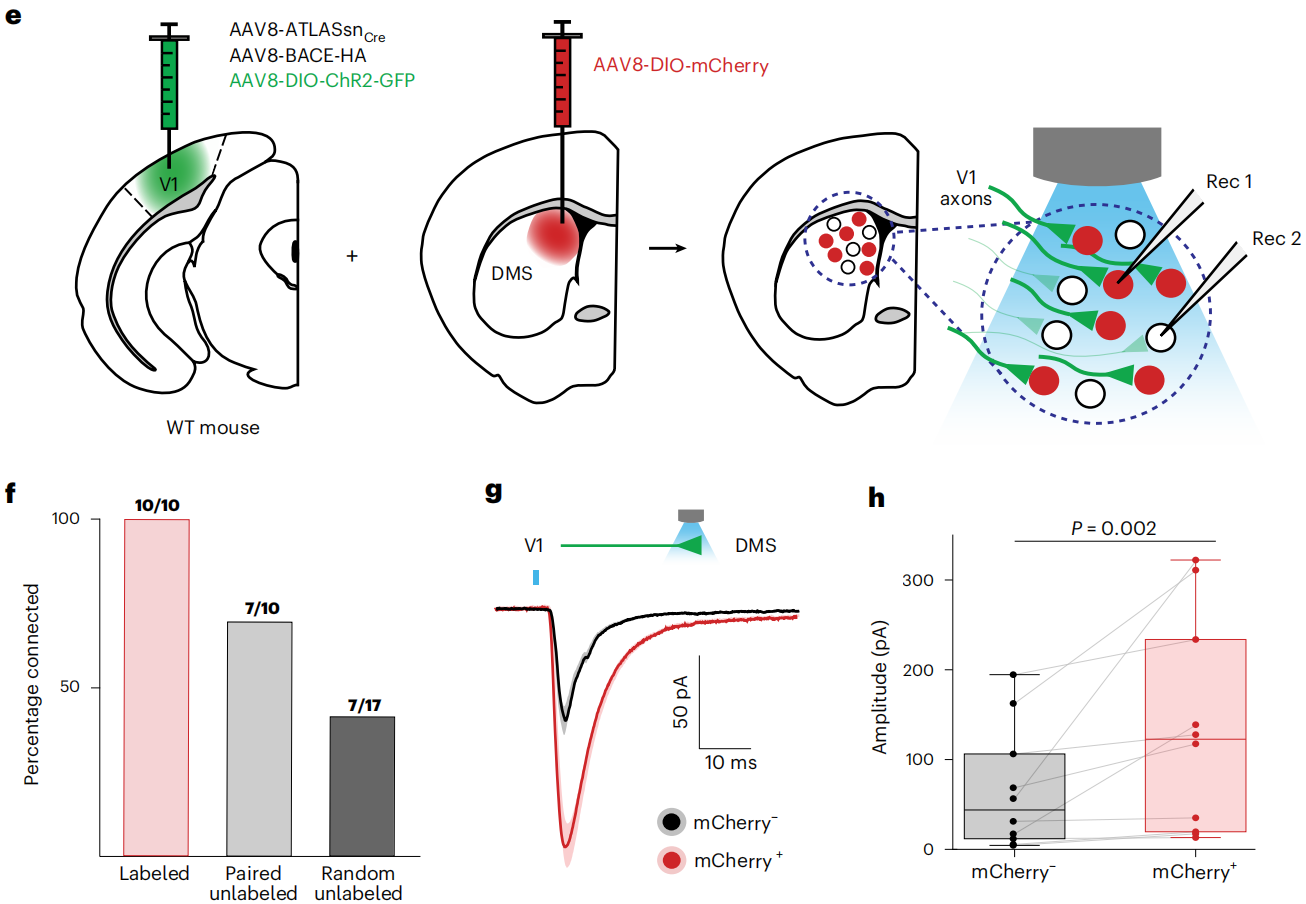
将AAV8-DIO-ATLAS-FLP和Lenti-hsyn-Cre注射到Str,AAV8-fDIO-mCherry注射到mPFC,结果显示在Str中具有丰富的At标记,表明ATLAS在高水平表达,但在mPFC中没有发现高于背景的标记,因为从mPFC到Str的投射是单向的,所以证明ATLAS不介导逆行标记。然后,示踪V1-SC-副视核(PBG)途径,将AAV8-ATLAS-Cre注射到V1,AAV8-DIO-mCherry注射SC和PBG,发现ATLAS只在SC有mCherry标记,而在PBG无明显高于背景的标记,表明其为单突触示踪。此外,将AAV8-ATLAS-Cre注射到SC,AAV8-DIO-mCherry注射到PBG,发现在PBG有标记,说明ATLAS能够追踪从SC到PBG的神经环路。因此,由ATLAS介导的跨突触标记完全是顺行性的单突触标记。
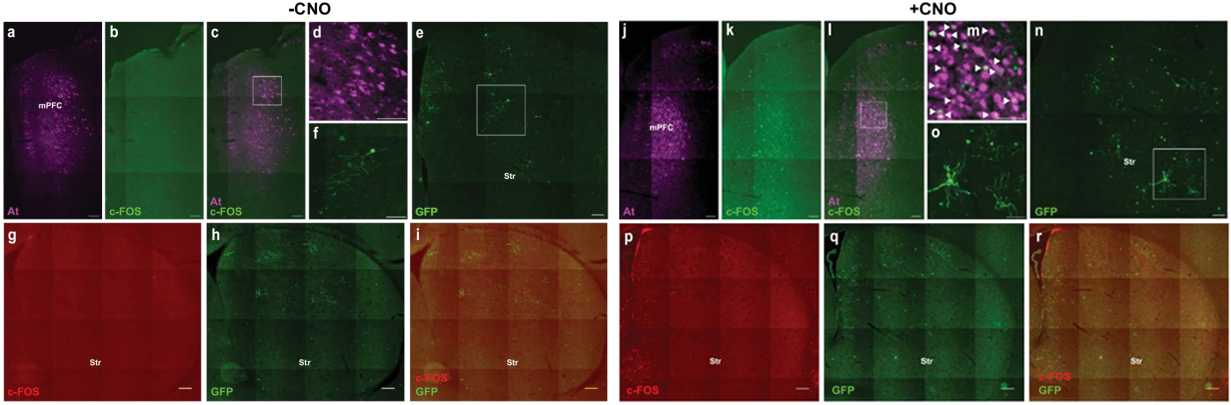
由于ATLAS通过从突触小泡中释放AF-重组酶来介导跨突触标记,因此跨突触标记很可能具有活动依赖性。为了在体内测试跨突触标记的活动依赖性,在mPFC注射AAV8-ATLASsn-Cre和AAV8-hHM3Dq-mCherry,在Str注射AAV8-DIO-GFP到Str,结果发现与CNO未处理小鼠相比较,用CNO处理小鼠的Str中GFP标记的细胞数量和总荧光强度显著增加,表明ATLAS介导的跨突触标记具有活动依赖性。
尽管VAMP2被广泛用作突触前标志物,但当高水平表达时会产生毒性,当ATLAS在mPFC中表达2周和4周时,可以观察到毒性。因此,对ATLAS进行了优化,将VAMP2的胞质结构域替换为抗突触结合蛋白1(SYTnb)的纳米抗体,构建SYTnb-VAMP2Δ-At-BACEcs-AF-Cre(ATLASsn-Cre),在mPFC中表达ATLASsnCre 2或4周时,没有观察到毒性。体外实验将ATLASsn-Cre转染至皮质神经元的解离细胞培养物中,同时用AAV8-DIO-mCherry感染细胞,观察到大量被mCherry标记但未被At标记的细胞,表明它们通过跨突触方式被标记。
在体内测试中,将AAV8-ATLASsn-Cre与AAV8-BACE-HA共同注射到小鼠mPFC,将AAV8-DIO-mCherry注射到Str。孵育2周后,在mPFC中观察到At的表达,Str中检测到大量mCherry标记。突触后mCherry标记的背侧区域与代表突触前末端的At标记几乎完全共定位,这与ATLASsn-Cre介导跨突触标记的结果一致。此外,在M1-Str和M1-丘脑(Thal)环路的示踪进一步证实了ATLASsn-Cre可以介导跨突触标记。
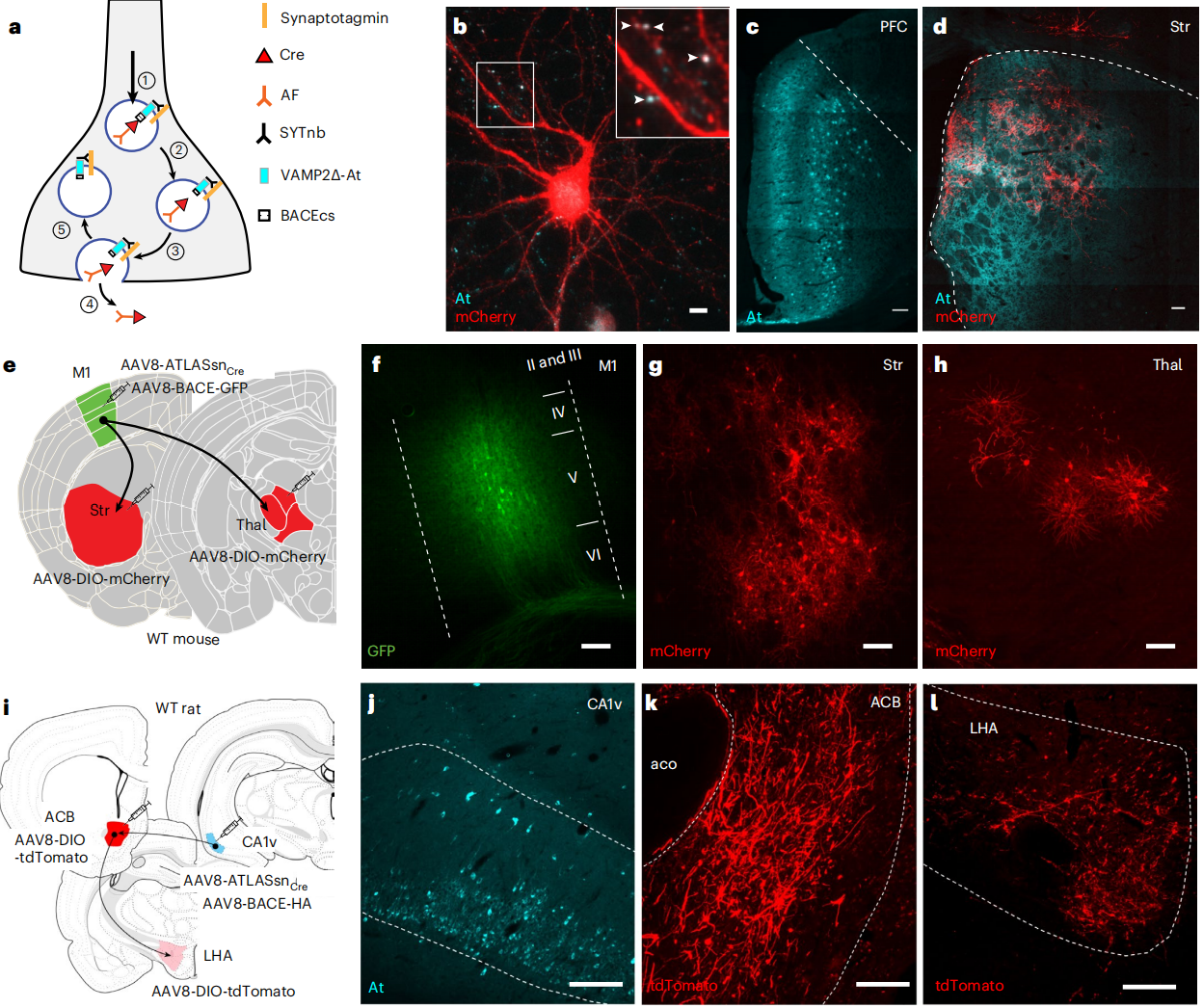
进一步验证ATLASsn-Cre的通用性,利用其示踪了三条额外神经环路:分别为听觉皮层(A1)至下丘、mPFC至屏状核,以及内嗅皮层至海马的投射。在每组实验中,均向突触前注射AAV8-ATLASsn-Cre和AAV8-BACE-HA,并向对应的突触后区域注射AAV8-DIO-GFP。孵育2周后,对突触前细胞进行At染色,对突触后细胞进行GFP染色。结果显示,每组实验中均观察到同时存在At和GFP标记的细胞,表明跨突触标记效率良好。这些结果表明,ATLASsn-Cre能够有效示踪多种不同神经环路。
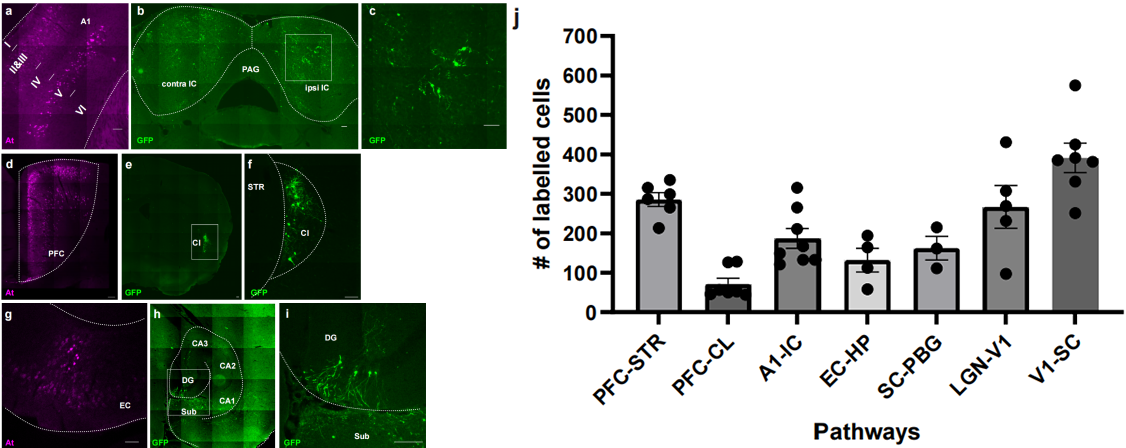
此外,为了了解跨突触标记发生的时间进程,在mPFC中共表达AAV8-ATLASsnCre和AAV8-BACE-HA,在Str中表达AAV8-DIO-GFPmPFC,分别感染4、7、14、21天,结果发现突触后标记细胞在注射后4-7天开始出现,7天后数量和标记强度显著增加,21天时仍有增长;突触前标记细胞在1周后数量基本稳定。ATLASsn-Cre跨突触标记的细胞数量在前7天显著增加,之后增速放缓,但总荧光强度呈相对线性增长;而突触前标记细胞数量在首周后基本保持稳定。
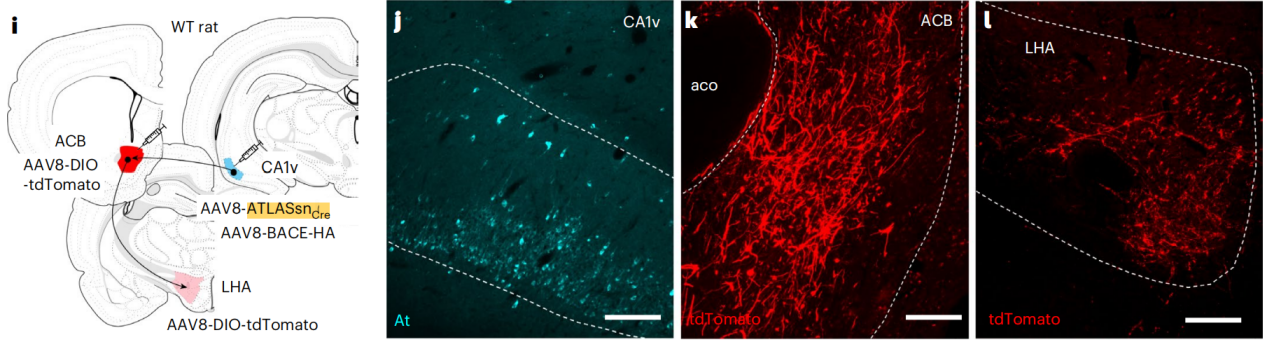
在大鼠中注射AAV8-ATLASsn-Cre和AAV8-BACE-HA到腹侧海马CA1区,AAV8-DIO-tdTomato到伏隔核(ACB),结果观察到CA1中有At染色,ACB有大量tdTomato标记细胞。此外,下丘脑外侧区(LHA)内也有tdTomato的轴突标记,证明ATLAS在大鼠中也能介导跨突触标记。
总 结
ATLAS示踪技术是一种基于合理设计蛋白质的顺向跨突触示踪方法,具有多方面优势:
仅顺向单突触示踪,可精准映射神经元连接;
不依赖病毒复制,无毒性,不影响突触传递;
具有活动依赖性,能标记与行为相关的活跃神经回路;
组件模块化可独立替换或修改去适配不同受体,能用于多种动物。
该技术存在局限性:
依赖重组酶报告系统,需在突触后细胞表达相关基因,操作复杂;
整体标记效率不足,且受时间影响,需补充外源性BACE酶改善。
文中相关病毒布林凯斯均可提供:

同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。