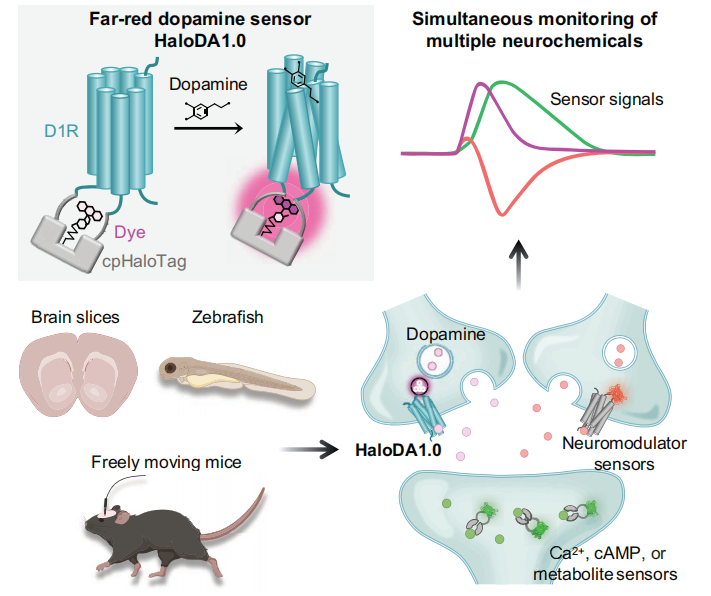
神经化学信号(包括神经递质、神经调质和细胞内信号分子)在调节各种大脑功能和介导神经疾病方面发挥着重要作用。多巴胺(DA)作为一种最重要的神经调质之一,与乙酰胆碱(ACh)、内源性大麻素(eCBs)等其他神经调质以及细胞内信号分子(如环磷酸腺苷cAMP和钙离子Ca²⁺)之间存在复杂的相互作用。解析这些神经化学网络对于理解行为的神经机制以及相关疾病至关重要。然而,目前的遗传编码传感器仅限于绿色和红色光谱范围,限制了对多种神经化学信号的同时实时检测。因此,迫切需要将神经调质传感器的光谱范围扩展到远红光和近红外(NIR)波长(即大于650nm)。

2025年6月5日,北京大学李毓龙课题组在《Science》杂志在线发表了一篇题为“In vivo multiplex imaging of dynamic neurochemical networks with designed far-red dopamine sensors”的研究论文。该研究开发了一种新型的远红光多巴胺传感器HaloDA1.0,该传感器结合了cpHaloTag-化学染料方法和基于G蛋白偶联受体激活(GRAB)策略,对多巴胺具有高灵敏度,能够在多种生物系统中实现多种神经化学信号的同时监测。研究团队利用这种传感器,成功实现了对多巴胺(DA)、乙酰胆碱(ACh)和内源性大麻素(eCB)等多种神经调质的动态监测,揭示了它们在不同生理和行为条件下的复杂相互作用。
研究人员以人D1受体(D1R)作为DA感知模块,D1R与其他DA受体相比,具有更优越的膜运输特性。首先,将D1R中的第三胞内环(ICL3)替换为优化的环状排列HaloTag蛋白(cpHaloTag),使用与HaloTag配体偶联的远红光染料标记嵌合变体,这种配体可与cpHaloTag形成共价键。当DA与D1R结合时,会引发受体的构象变化,进而带动cpHaloTag发生构象变化,使共轭染料的平衡状态从非荧光(L)态转向荧光(Z)态,最终导致荧光增强(图1A)。随后,研究人员主要以JF646作为远红外染料,系统优化了cpHaloTag的插入位点、连接序列以及cpHaloTag和D1R中的关键残基。通过筛选超过2000个变体,确定了响应最高的变体,将其命名为 HaloDA1.0。此外,他们还通过突变受体配体结合口袋中的位点,生成了DA不敏感的探针 (HaloDAmut),作为阴性对照(图1B)。
研究人员证实JF646偶联的HaloDA1.0传感器(HaloDA1.0-JF646)在HEK293T细胞中表达时会转运到质膜(图1C),并在配体应用时产生强烈的瞬时荧光增加,半数最大有效浓度(EC50)为150 nM,最大ΔF/F0约为 900%(图1D)。使用单光子激发证实HaloDA1.0-JF646在远红光范围内,激发峰在645nm处,发射峰在660nm处(图1E)。化学染料的结构和性质各不相同,会影响HaloDA1.0的性能,当用不同的远红外染料标记时,HaloDA1.0的峰值ΔF/F0响应范围为110%至1300%,EC50值范围为27 nM至410nM(图1F),且荧光亮度和染料标记率在不同染料间也有很大差异。无论使用何种染料,对DA不敏感的HaloDAmut传感器均未检测到荧光增强(图1D)。通过培养神经元观察染料标记的HaloDA1.0性能,发现与先前在HEK293T细胞获得的结果一致,可以观察到测试的四种染料在传感器的峰值响应和DA亲和力方面具有相似的等级顺序(图1G和1H)。这些结果表明,HaloDA1.0的特性,包括其光谱、亮度、配体响应和配体亲和力),可以通过用特定化学染料标记来精细调控。
同时,HaloDA1.0对DA具有较高的敏感性和特异性,DA诱导的HaloDA1.0荧光增强可被D1R特异性拮抗剂SCH的共同给药所阻断,但不受D2R特异性拮抗剂Etic的影响(图1I)。为了检查HaloDA1.0是否与下游细胞内信号通路偶联,使用荧光素酶互补测定和Tango测定分别测量Gs和β-arrestin介导的信号传导,结果发现HaloDA1.0仅诱导这两种信号通路的极小程度激活,相反作为阳性对照的D1R(WT)则对两种途径都具有强大的剂量依赖性偶联(图 1J和1K)。此外,研究人员在培养的神经元中共表达了远红外HaloDA1.0-JF646传感器、红色荧光5-HT传感器(r5-HT1.0)和绿色荧光NE传感器(NE2m),结果发现所有三个传感器均在同一神经元中表达,且通过施加各自对应的激动剂和拮抗剂,它们各自的荧光信号能够依次被激活和阻断,因此可以实时同步监测不同神经调质的动态(图1L和1M)。
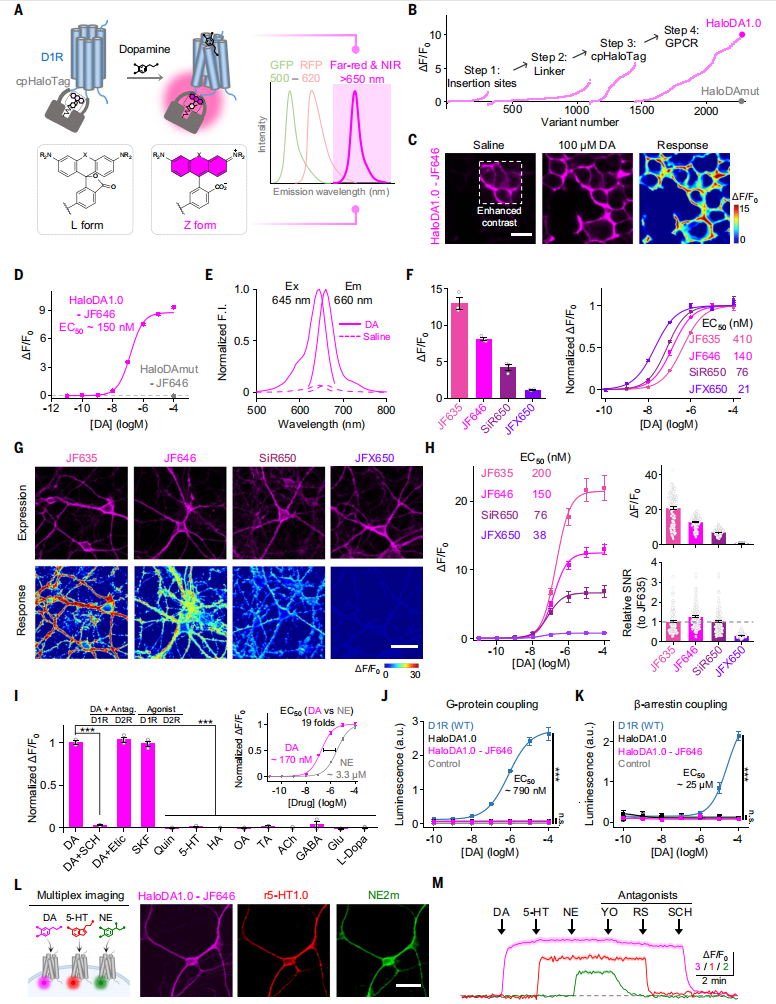
图1 HaloDA1.0多巴胺传感器的构建和表征
为了评估HaloDA1.0是否可以检测内源性DA释放,研究人员将表达HaloDA1.0的腺相关病毒(AAV)注射到小鼠的伏隔核(NAc)中,表达三周后取急性脑切片,将切片与JF646孵育1小时来标记传感器(图2A)。结果发现,以20 Hz的频率施加局部电刺激会引发强烈且短暂的荧光增强,且响应幅度与刺激次数相关,通过应用D1R拮抗剂SCH可以阻断内源性DA释放荧光信号的增加(图2B和2C)。同时,HaloDA1.0表现出高敏感,它能够检测由单个电脉冲诱导的DA释放,其荧光响应平均上升时间常数为150ms,平均衰减时间常数为8.3s(图2D)。
除了DA之外,NAc中还会释放多种其他神经调质,如乙酰胆碱(ACh)和内源性大麻素(eCBs)。研究人员向NAc注射了表达HaloDA1.0(之后通过尾静脉注射用远红染料SiR650标记)、rAChlh以及eCB2.0的病毒混合物(图2E),结果发现所有三个传感器都响应于20 Hz施加的场刺激,其各自的荧光信号都有显著增加,并且每个传感器的信号都可通过施用其相应的拮抗剂来阻断,从而证实了特异性(图2F-2H)。与DA和ACh信号相比,eCB信号的上升和衰减时间更慢,eCB释放发生在刺激结束之后(图2I),这与之前的电生理学研究一致, eCB需要时间合成以用于释放,而DA和ACh则是在受到刺激时直接从囊泡中释放。这些结果表明,HaloDA1.0适用于多重成像。
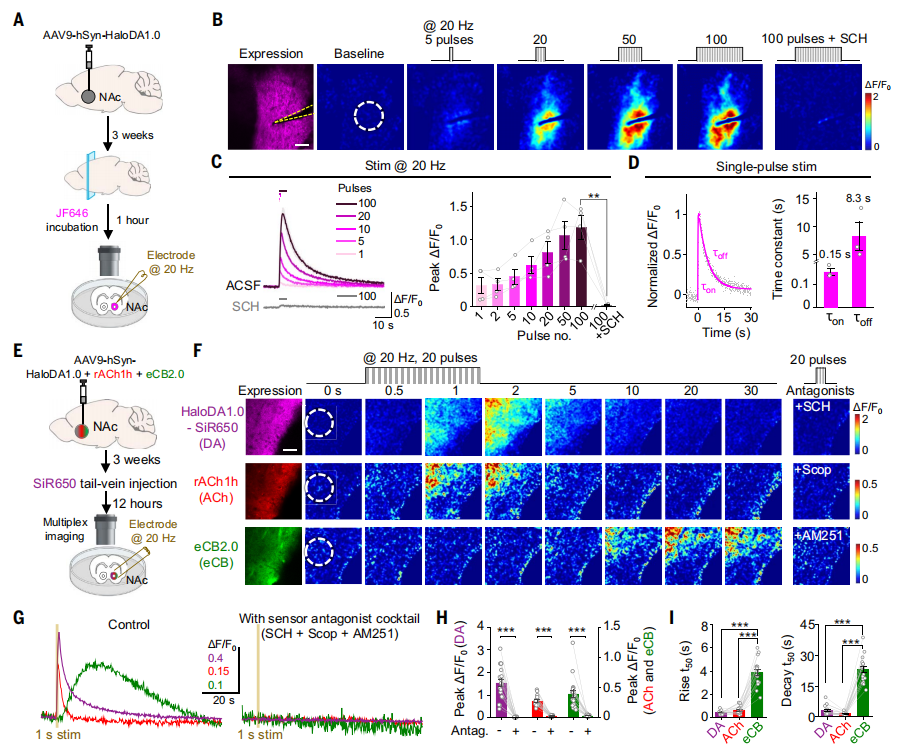
图2 在急性脑切片中使用HaloDA1.0进行多重成像
为了确定HaloDA1.0是否可用于在体内监测DA动态,在斑马鱼幼虫的神经元中瞬时表达该传感器。随后,用三种远红光染料(JF635、JF646和SiR650)标记该传感器,发现SiR650标记的传感器具有最强的基线荧光(图3A-3C)。JF646和SiR650均显示出相对较低的背景染色,约为传感器荧光的1%(图3D)。此外,局部施加场刺激可快速诱导强烈、短暂的荧光增强,其中JF646标记的传感器响应幅度最大(图3E)。SiR650和JF646标记的传感器具有相似的信噪比(SNR),优于JF635标记的传感器(图3F)。
接着,在斑马鱼幼虫中进行三色在体成像,将HaloDA1.0在神经元中瞬时表达,同时表达红色荧光钙传感器(jRGECO1a)和绿色荧光ATP传感器(ATP1.0)。在运动神经元中,HaloDA1.0传感器用SiR650标记,施加轻微电击后,可以观察到所有三种传感器的荧光增强,DA和ATP信号的动力学特征相似,但两者衰减速度均慢于神经元钙信号(图4)。这些结果表明,HaloDA1.0传感器可在体内可靠检测DA释放,且适用于斑马鱼幼虫脑部的三色成像。
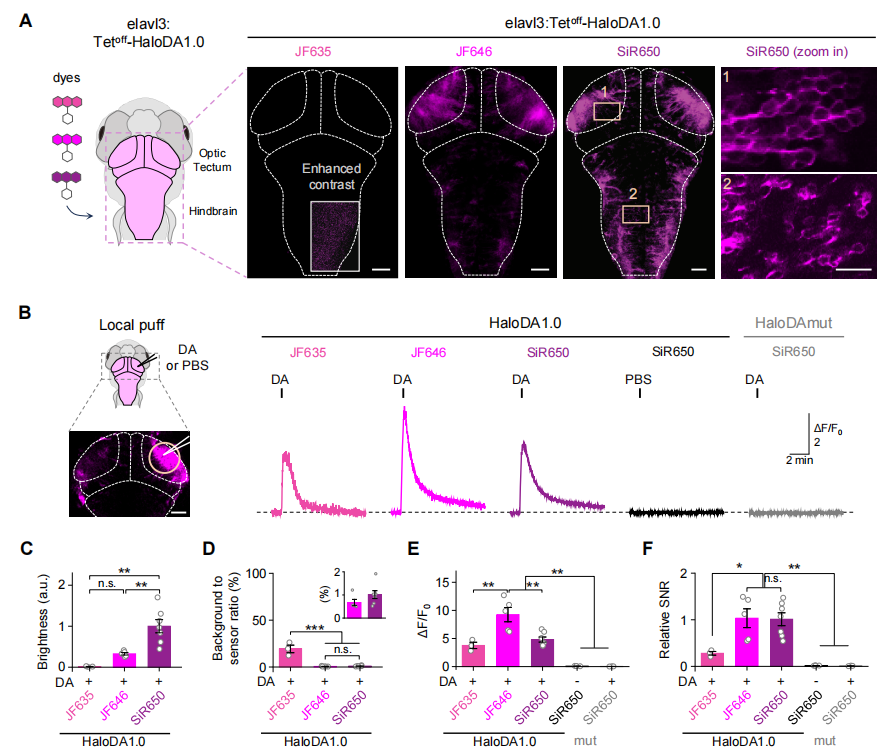
图3 斑马鱼中HaloDA1.0传感器的性能
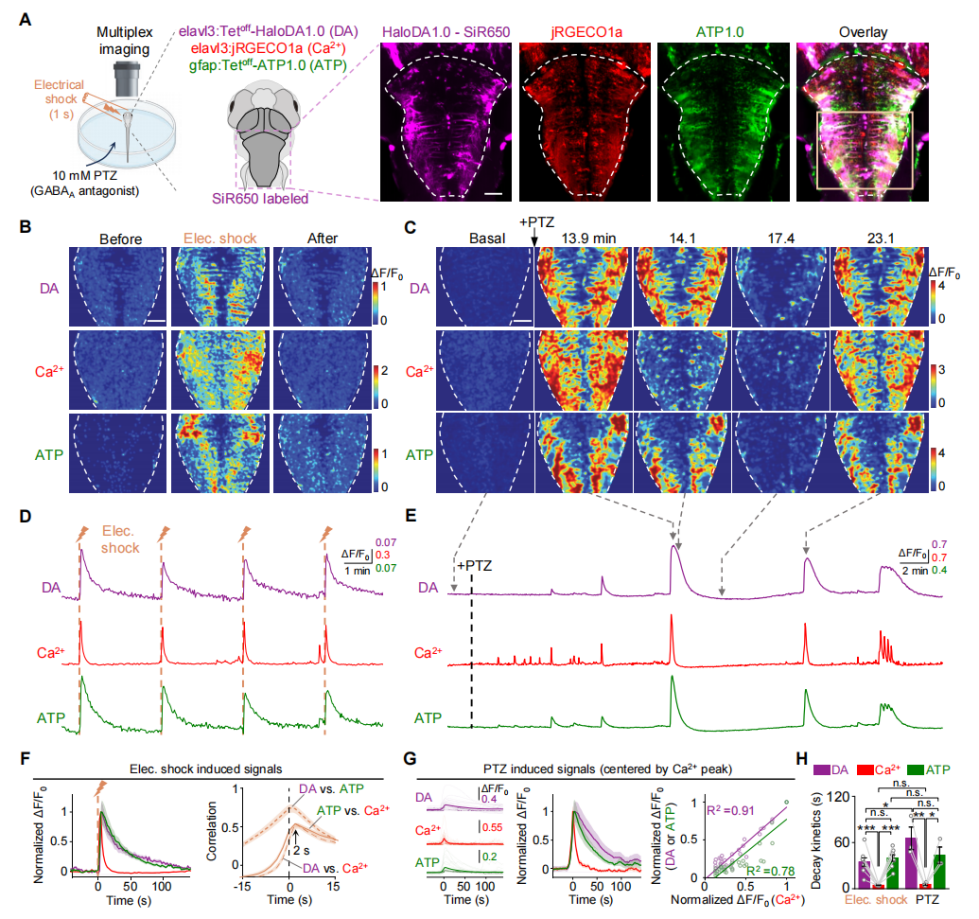
图4 在斑马鱼中使用HaloDA1.0进行多重成像
在小鼠腹侧被盖区(VTA)表达光遗传学ChR2病毒,并在NAc中表达HaloDA1.0传感器,它接收来自VTA的密集多巴胺能投射(图5A)。然后,将不同染料注射到尾静脉中用于标记,并在12小时后进行光纤光度记录。结果发现VTA的光遗传学刺激导致JF646标记的HaloDA1.0荧光增加,而JF635标记或JFX650标记的HaloDA1.0则无明显可测变化(图5B-5D)。相比之下,与在斑马鱼中得到的结果一致,SiR650标记的HaloDA1.0响应高得多。此外,腹腔注射DAT阻断剂GBR后,SiR650标记的HaloDA1.0的基础荧光缓慢升高,且光激活反应的幅度和衰减时间均增加(图5E-G)。而且,D1R拮抗剂SCH处理可消除基础荧光的升高以及光诱发的反应。
接下来,研究HaloDA1.0是否可用于监测神经元稀疏分布的脑区(如内侧前额叶皮层,mPFC)中的体内多巴胺释放。结果发现VTA中神经元的激活导致mPFC中SiR650标记的HaloDA1.0出现短暂升高,且这些反应可被SCH阻断(图5H-K)。为了测试HaloDA1.0是否适用于光遗传学刺激期间的双色记录,在D2R-Cre小鼠中表达DIO-ChR2,以特异性激活VTA中的DA神经元,在杏仁核(CeA)中共表达HaloDA1.0和DIO-jRGECO1a(图5L),结果发现光遗传学刺激触发了D2R阳性神经元中DA释放的增加以及Ca2+的减少。此外,用D2R拮抗剂Etic治疗可阻断Ca2+的变化,而不影响DA释放(图5M-5O),这表明DA可能通过激活抑制性D2R信号传导来抑制CeA中D2R阳性神经元的活动。
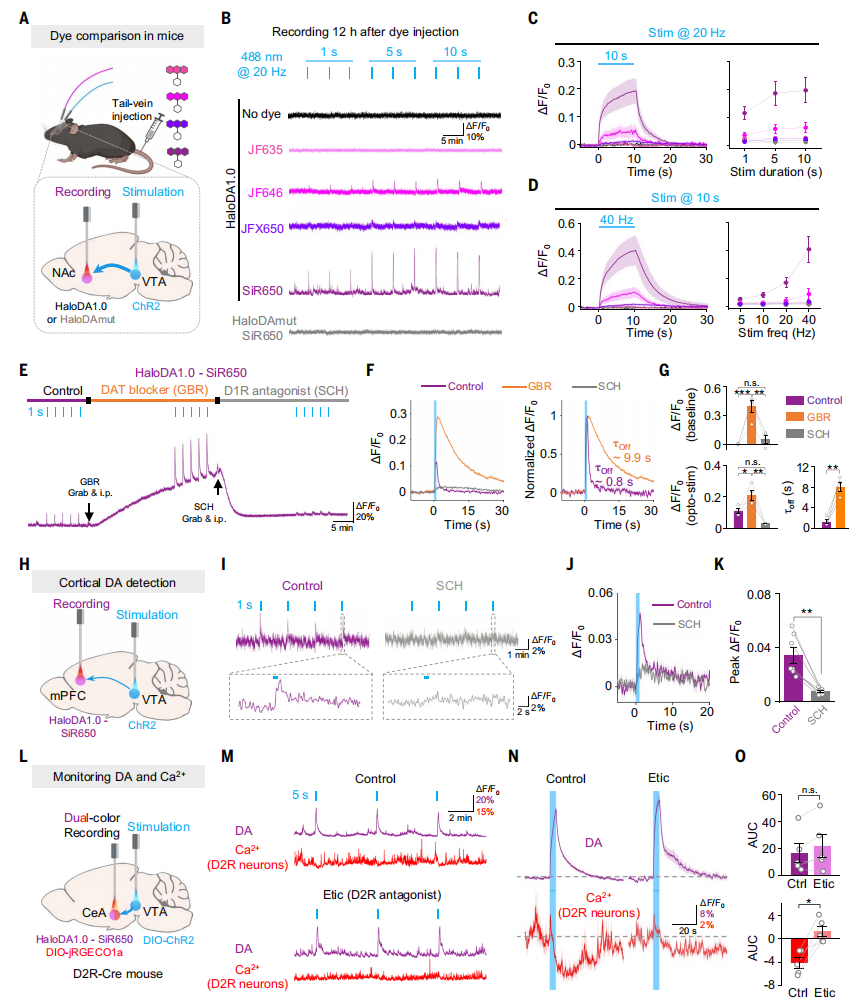
图5 HaloDA1.0用于检测自由活动的小鼠内源性DA释放
在D1R-Cre小鼠的NAc中共表达HaloDA1.0、rACh1h和绿色荧光cAMP传感器(DIO-GFlamp2)等病毒,用SiR650标记DA传感器,并使用三色光纤光度法同时监测体内的DA、ACh和cAMP(图6A和6B)。结果发现在无刺激情况下,所有三个信号都呈现自发波动(图6C)。以自发DA波动的峰值为中心,观察到cAMP信号有相应增加,而ACh信号出现阶段性下降(图6E和6I),DA的峰值先于ACh信号的低谷,随后是cAMP的峰值,这与DA需要结合D1R以产生cAMP的要求一致。此外,在给予无条件蔗糖奖励时,可以观察到一种类似于自发信号的模式(图6C、6F、6J);在施加1s的足部电击时,出现了一种不同的模式,所有三种信号均有明显变化(图6G、6K)。 最后,相关性分析显示,DA和cAMP之间存在直接相关性(滞后500ms),ACh和cAMP之间以及DA和ACh之间均存在负相关性(均滞后300ms)(图6M)。
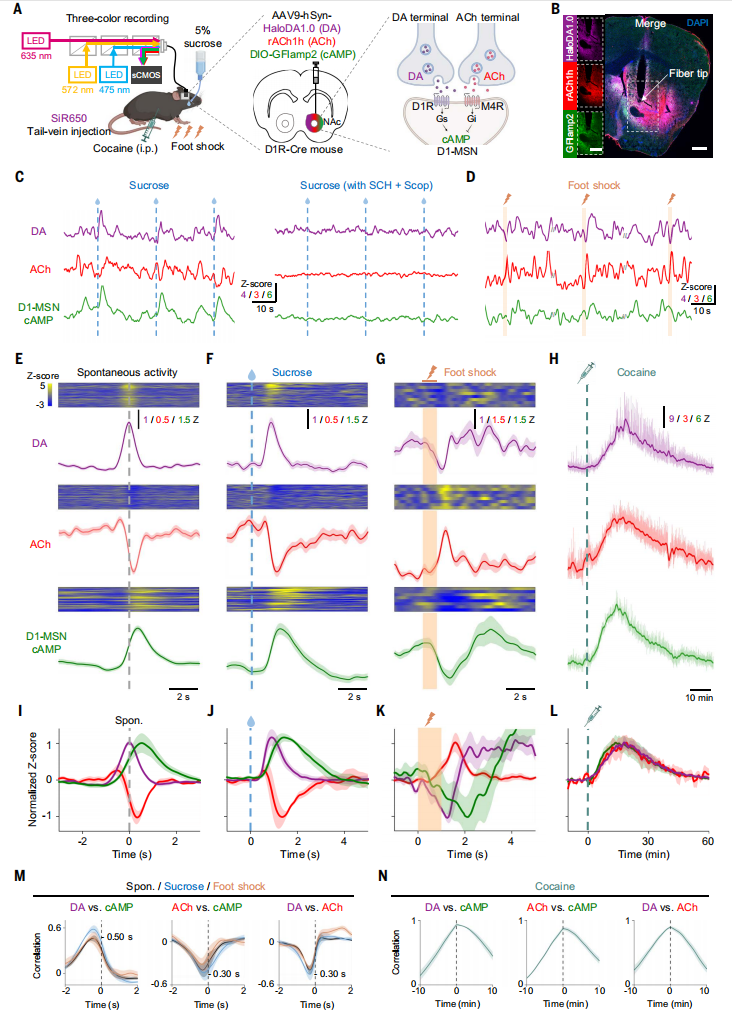
图6 同时监测体内DA、ACh和cAMP动力学
综上所述,研究人员开发了一种化学遗传学远红光DA传感器HaloDA1.0,该传感器能够在体外和体内实现对多巴胺的灵敏检测。HaloDA1.0传感器在多种生物系统中展现出显著的优势,可用于监测多种神经化学信号,这些系统包括培养的神经元、急性小鼠脑切片、斑马鱼和活体小鼠。这一策略加深了我们对各种神经化学信号之间复杂相互作用的理解,为深入探究神经环路功能以及更好地理解神经和精神疾病奠定了基础。
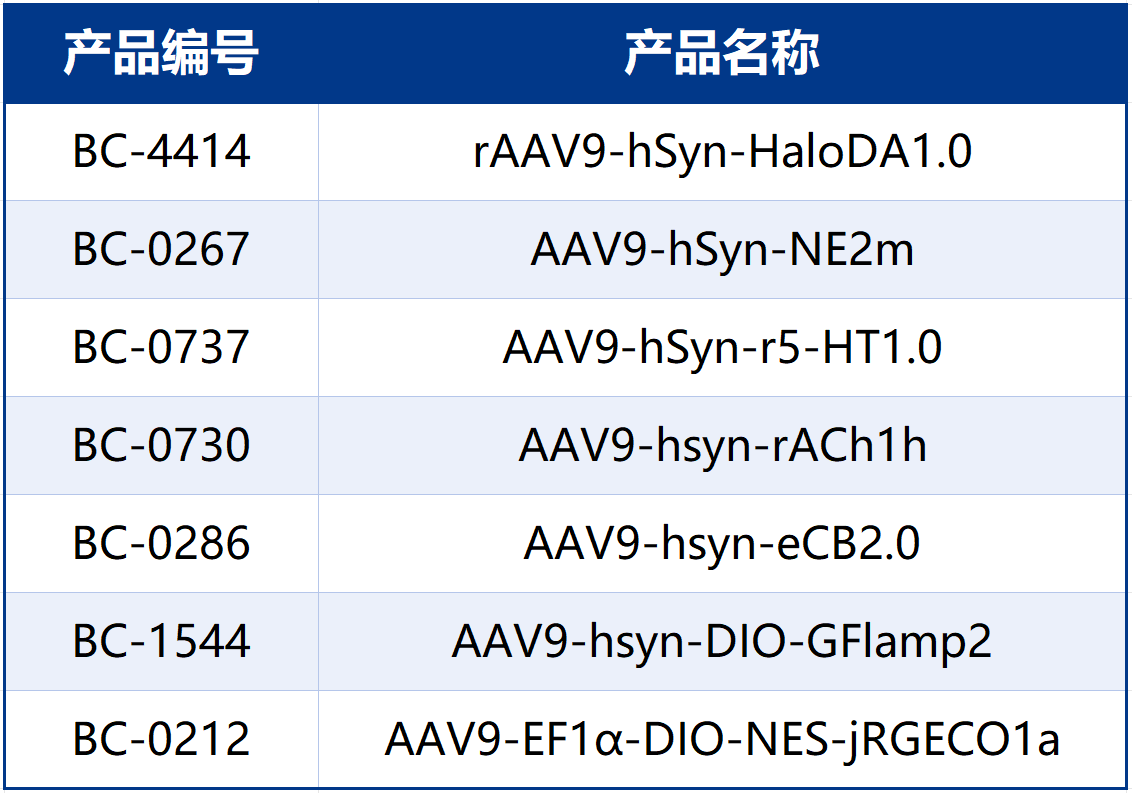
文中使用的探针工具布林凯斯均可提供:
同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。