2020年10月30日,斯坦福大学医学院在Nature Biotechnology期刊上发表题为“Generation of human striatal organoids and cortico-striatal assembloids from human pluripotent stem cells”相关文章,研究团队从人类多能干细胞(hPS细胞) 中开发出模拟人类纹状体的3D类器官(hStrSs),其包含功能性中型多棘神经元;并将其与皮质类器官组装成皮质-纹状体组装体,通过逆行病毒追踪、光遗传和钙成像等技术,证实皮质神经元向纹状体类器官投射轴突并形成突触连接,且组装后纹状体神经元电生理成熟度提升。此外,利用22q13.3缺失综合征患者的细胞构建组装体,捕捉到疾病相关的钙活动异常,表明该模型可用于研究皮质-纹状体回路的发育、功能及相关神经疾病。

用AAV-hSyn-eYFP标记人类皮质类器官(hCSs),以AAV-hSyn-mCherry标记人类纹状体类器官(hStrSs),将二者在锥形管中接触放置。72小时后,两区域特异性球体融合为皮质-纹状体组装体,随后转移至超低吸附培养板。21天内,hCSs向hStrSs的YFP+投射渐增(图1a-d),且为单向投射(hCSs→hStrSs,图1c),与体内皮质-纹状体回路特征一致。活细胞成像显示hCS神经元生长锥在hStrSs中动态移动(图1e)。融合后21天,hStrSs内的hCS eYFP+末端表达谷氨酸转运体VGLUT1(图1f),且投射的hCS神经元靠近hStrS神经元突触上的突触后致密蛋白95(PSD95)+斑点。
为明确从hCSs投射到hStrSs的皮质细胞类型,在组装体中用RV-ΔG-Cre-eGFP进行逆行和顺神经元标记(图1g)。具体而言,以RV-ΔG-Cre-eGFP及跨突触扩散所需的AAV-EF1a-G感染hStrSs;用Cre重组后驱动mCherry表达的AAV-DIO-mCherry感染hCSs。病毒递送2天后,将hCSs与hStrSs组装为组装体再培养28天。观察到hStrSs中大量GFP表达,组装体皮质侧有GFP与mCherry共表达细胞(图1h),及hCSs向hStrSs的mCherry+投射。hCSs中85.0%的GFP+mCherry+细胞共表达神经元标志物MAP2,仅7.92%表达神经胶质标志物GFAP(图1i)。已知投射至纹状体的主要为表达SATB2的皮质端脑内投射神经元,深层CTIP2+皮质神经元也有重要侧支投射。结果发现与hCSs同一切片中的所有其他细胞相比,GFP+mCherry+群体中SATB2+细胞的比例富集了3.4倍,约41%逆行标记hCS神经元为SATB2+(图1j);CTIP2+细胞约占34%。这些数据表明,组装体中的投射神经元倾向于某些特定的神经元群体。
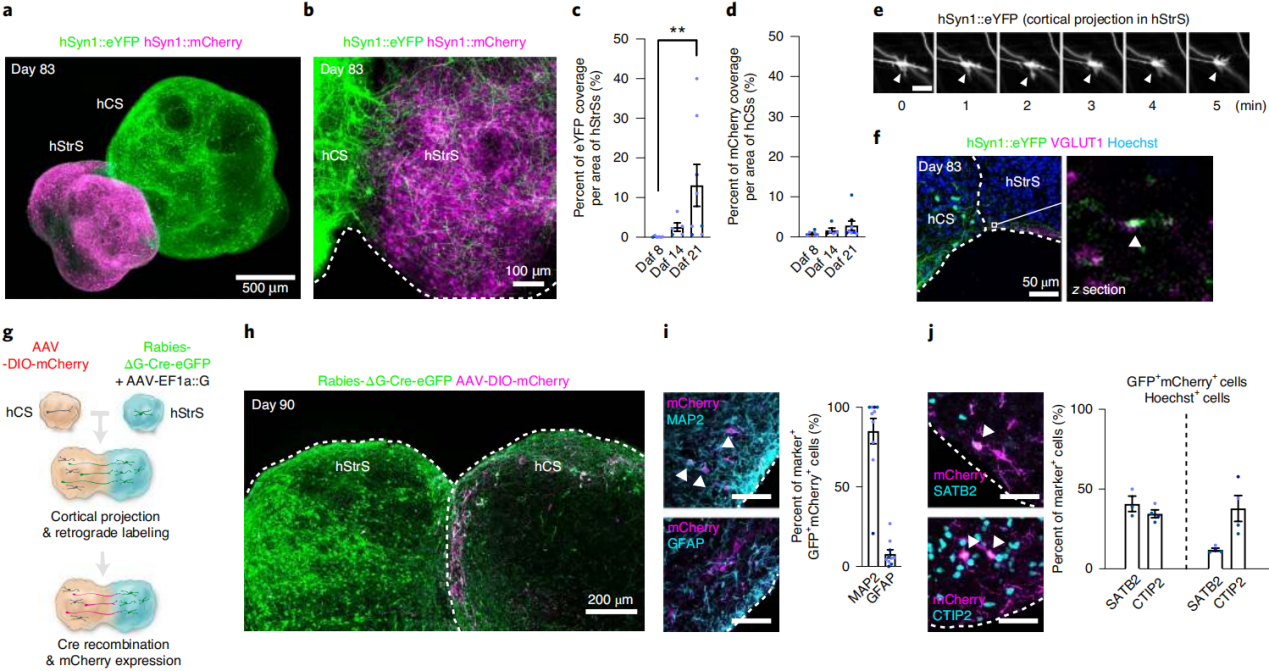
图1 皮质-纹状体组装体的生成
为明确hCSs投射神经元与hStrSs神经元是否形成功能性突触连接,在皮质-纹状体组装体中采用光遗传学结合同步钙成像技术。检测光诱发钙反应时,先在hCSs中病毒表达hSyn-ChrimsonR–tdTomato(响应红移光的视蛋白);在hStrSs中分别递送Ple94-iCre和DIO-GCaMP6s(图2a)。病毒感染2天后组装hCSs与hStrSs,于分化约90天时成像(图2b)。施加625nm光可在hStrS细胞中稳定诱发钙反应(图2c、d)。光刺激后GCaMP6信号中位ΔF/F值显著高于随机时间点。响应细胞能对不同频率光作出反应,但也存在非响应细胞或自发放电细胞(图2d)。AMPA受体拮抗剂NBQX(20μM)和NMDA受体拮抗剂APV(50μM)可阻断光诱导钙反应(图2d、e),且作用可逆,表明部分钙信号由hCSs向hStrSs的谷氨酸能传递介导。对hStrSs中ΔF/F GCaMP6信号的中位幅值进行测量,与100天前相比,100-120天和140-150天时光诱发的GCaMP6信号振幅增加,提示皮质-纹状体组装体中突触连接强度或频率可能随时间增强。
为进一步表征皮质-纹状体组装体连接性,结合光遗传刺激与切片电生理全细胞记录(图2f)。550nm光刺激可诱导hStrSs神经元产生光诱发兴奋性突触后电流(oEPSCs)、光诱发兴奋性突触后电位(oEPSPs)及放电(图2g),35个记录细胞中11个响应(图2h),平均oEPSC振幅约40pA(图2i),起始延迟6ms(图2j),表明hStrSs神经元与hCSs投射神经元形成突触连接。大脑皮质到纹状体的谷氨酸能投射对中型多棘神经元成熟至关重要。为探究组装对hStrSs神经元电生理特性的影响,对切片组装体行全细胞膜片钳记录(图2k)。结果显示,与同阶段hStrSs神经元相比,hCS-hStrS的hStrS侧hSyn-eYFP标记神经元内在兴奋性增加(图2l-n),振幅及阈值未变,与小鼠发育中纹状体研究一致。综上,源自人诱导多能干细胞的皮质-纹状体组装体可评估功能性连接,且组装会改变hStrSs神经元内在放电特性。
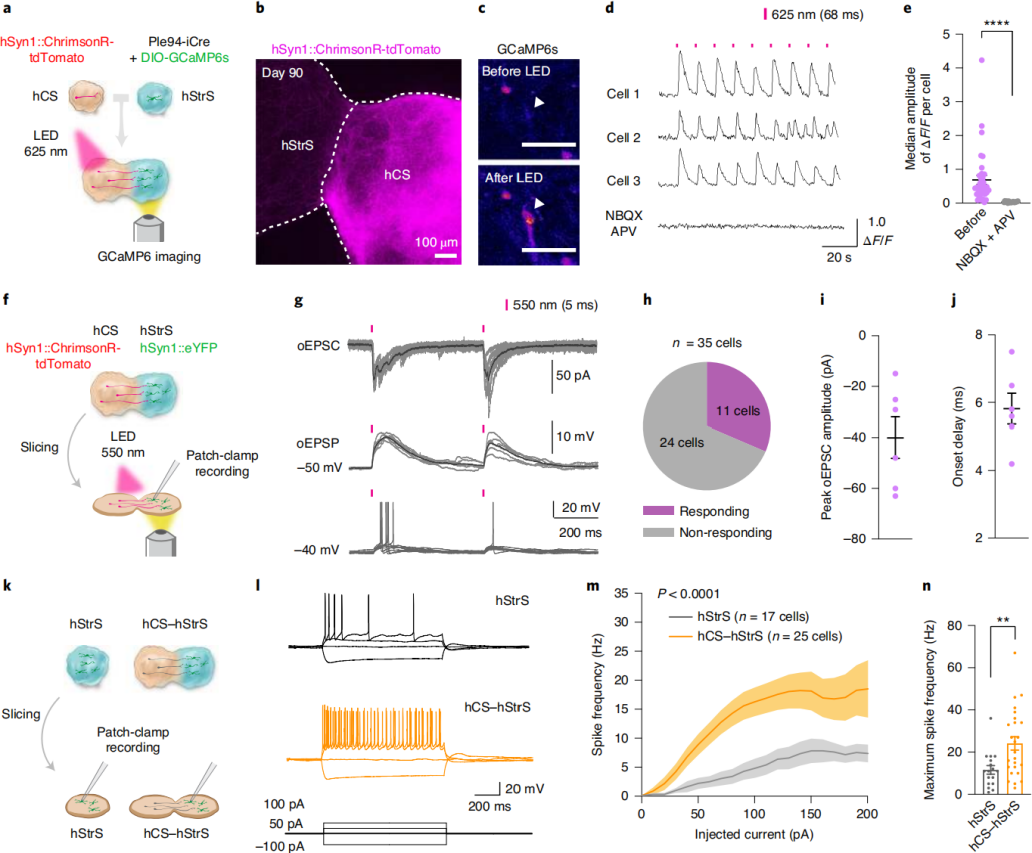
图2 皮质-纹状体组装体中的功能性神经环路
在皮质-纹状体组装体中模拟疾病相关细胞表型:研究其能否模拟遗传性神经发育疾病的细胞缺陷。费兰-麦克德米德综合征(22q13.3缺失综合征)由22号染色体q13.3区域缺失所致,含SHANK3基因(编码突触后支架蛋白),该基因在纹状体高表达,对皮质-纹状体回路发育和功能至关重要,其缺失是发病关键因素。Shank3敲除小鼠存在皮质-纹状体连接缺陷,但患者皮质 - 纹状体回路中杂合子人类细胞是否异常尚不明确。将三名22q13.3缺失综合征患者的诱导多能干细胞系分化为hCSs和hStrSs(图3a)。患者来源细胞可在3D培养中形成 hStrSs(图3b),表达前脑及LGE标志物,不表达脊髓标志物。患者来源hCSs和hStrSs的面积与对照组无差异(图3c),且能产生DARPP32⁺NeuN⁺神经元(图 3d)。从三名患者和三名健康对照生成皮质-纹状体组装体并进行钙成像(图 5e-g),发现组装体hStrS侧经标记的患者来源神经元钙spike事件增加(图3e-g),但同阶段患者来源单独hStrSs无此缺陷(图3h-j)。计算细胞间平均相关系数,显示患者来源 hStrSs 和组装体的网络同步性均降低(图3k-m)。综上,皮质-纹状体组装体可重现疾病中人类细胞的异常神经活动。
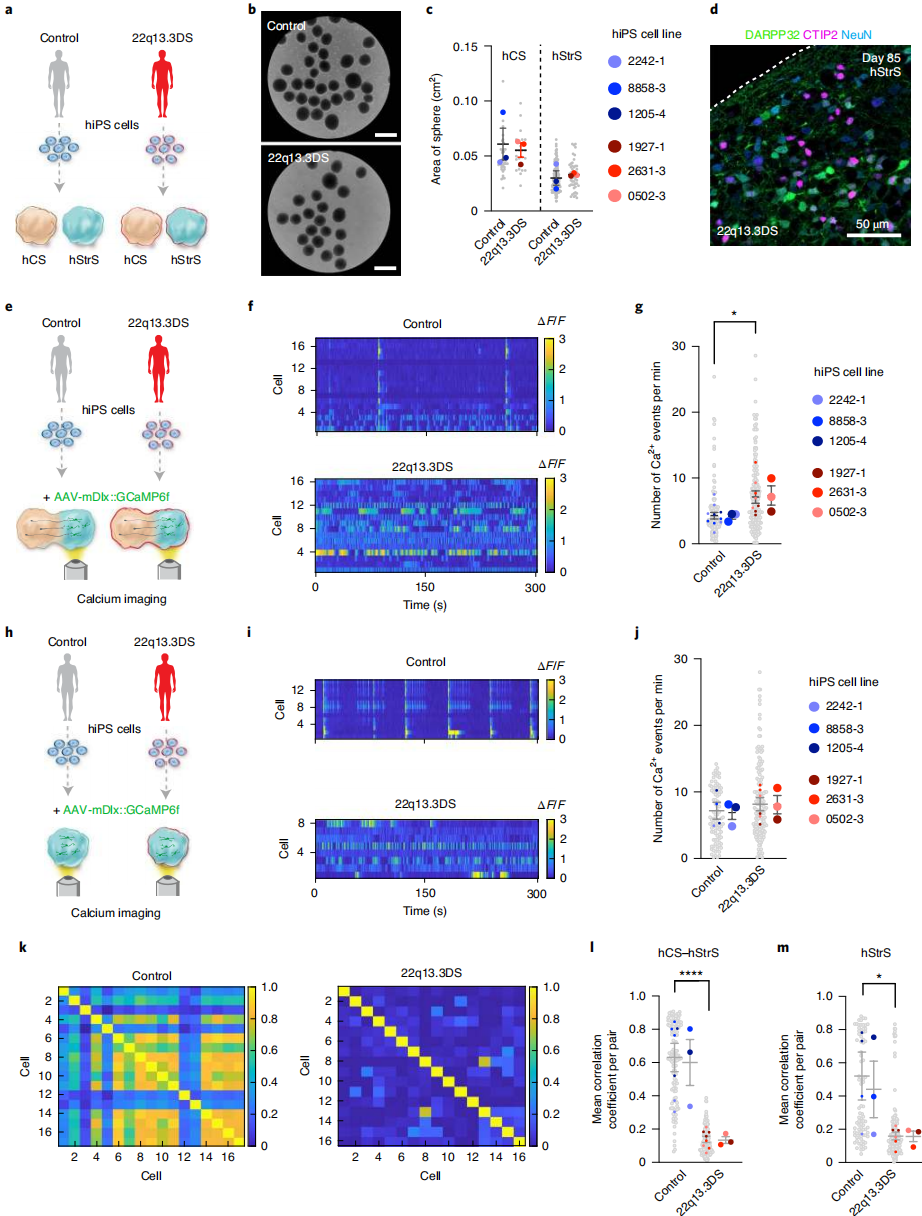
图3 模型改变了22q13.3DS患者皮质纹状体组装体的神经活动
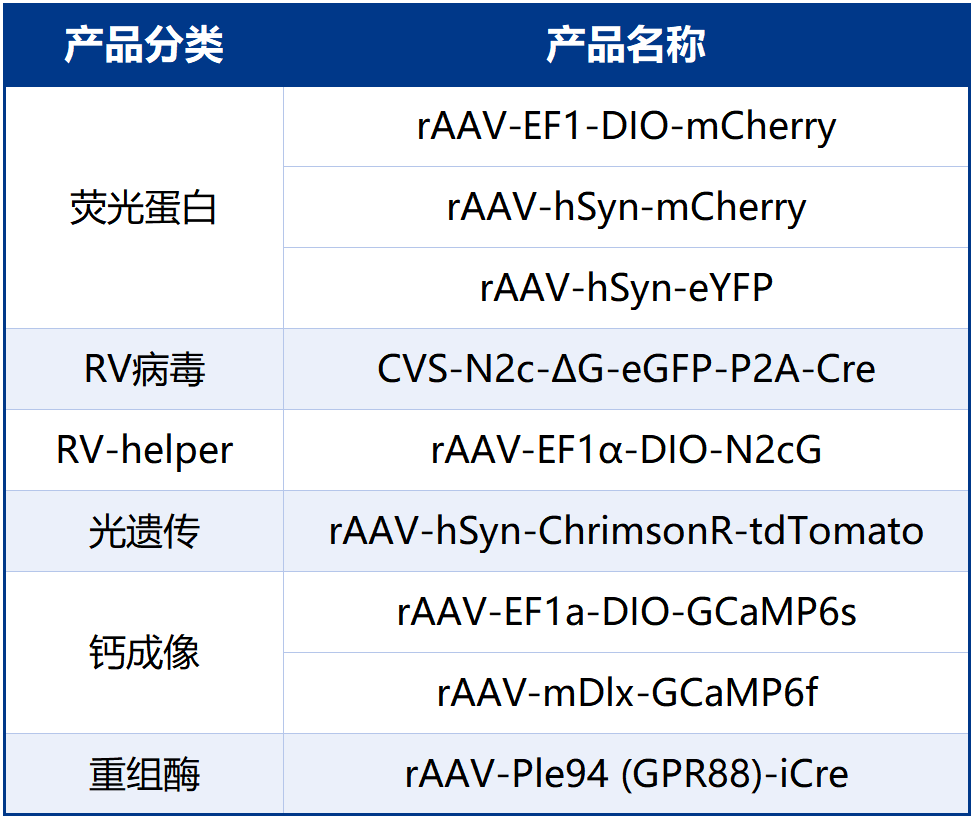
本文使用的工具病毒布林凯斯均可提供:
同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。