高级别胶质瘤(HGGs)是脑癌相关死亡的主要原因,其亚型在临床上、解剖学位置以及分子特征上有显著差异。这些亚型可以根据其生物学特性进一步分层。如,弥漫性中线胶质瘤(DMGs)是一种致命的儿童中枢神经系统癌症,特别是H3K27M基因突变型弥漫性内生性脑桥胶质瘤(DIPG),这类肿瘤特别侵袭性强且预后极差。另一类是半球型高级别胶质瘤(HGGs),如IDH野生型胶质母细胞瘤,它们通常发生在大脑半球,且具有独特的分子特征。这种分类有助于更精准地诊断和治疗,并为研究提供基础。神经元活动可通过旁分泌信号和神经元-胶质瘤突触驱动胶质瘤进展,但除谷氨酸外,其他神经递质介导的神经元-胶质瘤突触研究较少。有研究表明,正常少突胶质前体细胞(OPCs)与神经元存在GABA能突触通讯,且GABA对OPCs有去极化作用,因此推测GABA能突触可能在DMG进展中起作用。2025年2月19日,斯坦福大学的研究人员在Nature期刊上发表题为“GABAergic neuron-to-glioma synapses in diffuse midline gliomas”文章,揭示了DMG中GABA能神经元与胶质瘤细胞之间存在促生长的突触通讯,为脑癌神经生理学机制和治疗研究提供重要依据。
单细胞RNA测序分析:分析不同类型胶质瘤及肿瘤相关非恶性少突胶质细胞的单细胞RNA测序数据集,研究GABA能突触相关基因表达情况。
构建动物模型:构建患者来源的原位异种移植模型,将标记的DMG肿瘤细胞移植到小鼠海马体等部位,用于免疫电镜、免疫组化等实验,观察结构和功能。
电生理记录:对移植的DMG细胞进行全细胞膜片钳和穿孔膜片钳记录,研究细胞对刺激的电生理反应,分析GABA能突触功能及对膜电位的影响。
药物处理实验:用苯二氮卓类药物劳拉西泮处理荷瘤小鼠,观察对胶质瘤细胞增殖、肿瘤生长和小鼠存活的影响。

研究团队首先对不同类型胶质瘤及肿瘤相关非恶性少突胶质细胞进行单细胞RNA测序分析。结果发现,H3K27M+ DMG细胞广泛表达GABA受体亚基基因,以及与GABA能突触后结构相关的蛋白基因。这些基因在H3K27M+ DMG和IDH突变的高级别胶质瘤中,表达水平远高于IDH野生型高级别胶质瘤。进一步分析还发现,GABA能突触相关基因表达特征在H3K27M+ DMG的所有恶性细胞区室都存在,尤其在OPC样细胞区室中更为富集,而且不同患者样本之间存在明显的异质性。
为了亲眼“看到”GABA能突触的存在,研究人员通过多种实验进行验证。他们把标记的DMG肿瘤细胞移植到小鼠海马体,利用免疫电镜观察到了GABA能神经元和DMG细胞之间的突触结构。同时,在体外将DMG细胞与混合神经元共培养,以及在体内构建特定的小鼠模型,都证实了两者之间存在结构上的GABA能突触,约20%的胶质瘤细胞gephyrin斑点会与突触前的VGAT共定位。
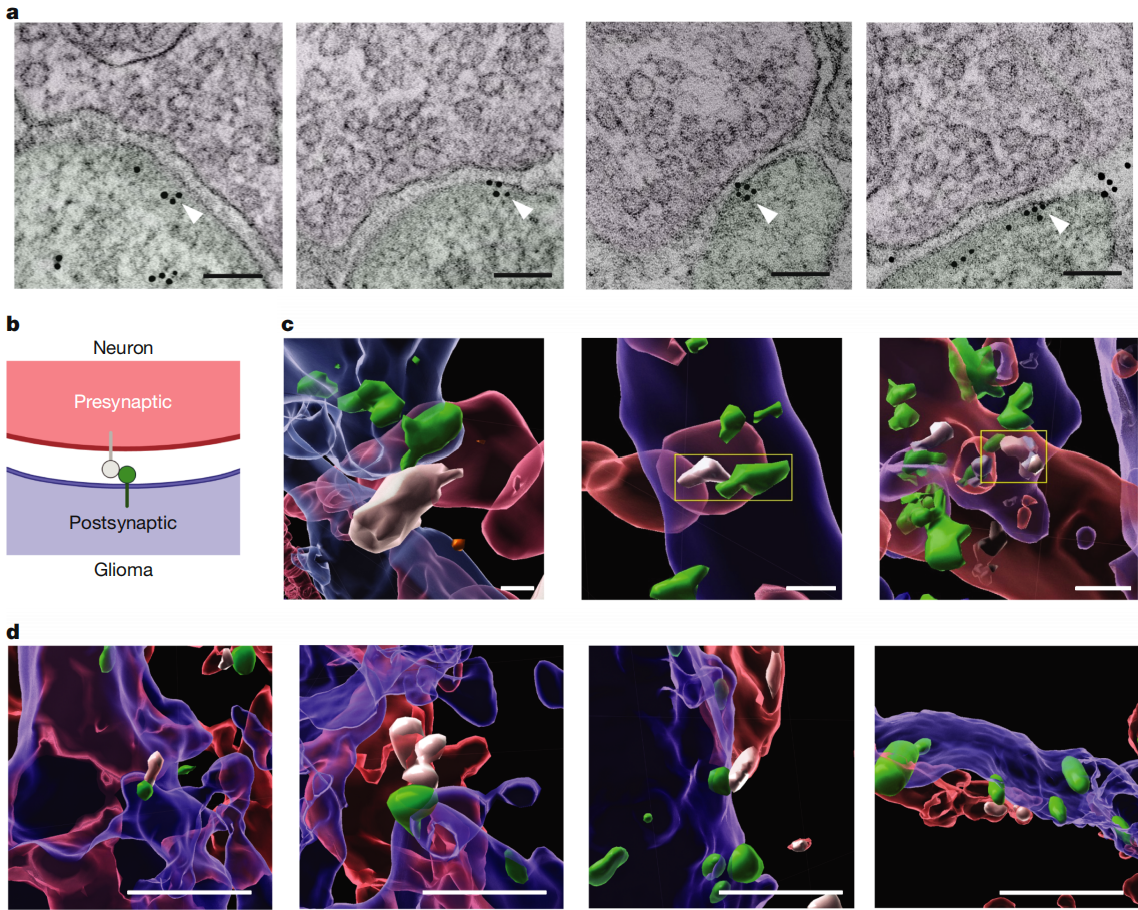
图1 DMG中的结构性GABA能神经元-胶质瘤突触
有了结构基础,那么这些突触是否有功能呢?研究人员对移植的DMG细胞进行全细胞膜片钳记录。结果发现,约40%的DMG细胞对局部神经元的低强度电刺激有GABA能突触反应,这种反应的上升时间、衰减时间和潜伏期都有特定数值。而且,这些GABA能电流由神经元动作电位引发,能被GABA抑制剂阻断,却不受谷氨酸受体抑制剂影响。
GABA对DMG细胞的膜电位有什么影响呢?通过穿孔膜片钳记录发现,GABA会使DMG细胞产生内向电流,进而导致膜电位去极化。这是因为DMG细胞内的Cl⁻浓度较高,与成熟神经元内的情况相反。研究证实,NKCC1氯离子转运体在其中起关键作用,它负责维持DMG细胞内高Cl⁻浓度,一旦抑制NKCC1,GABA电流的反转电位就会发生改变。
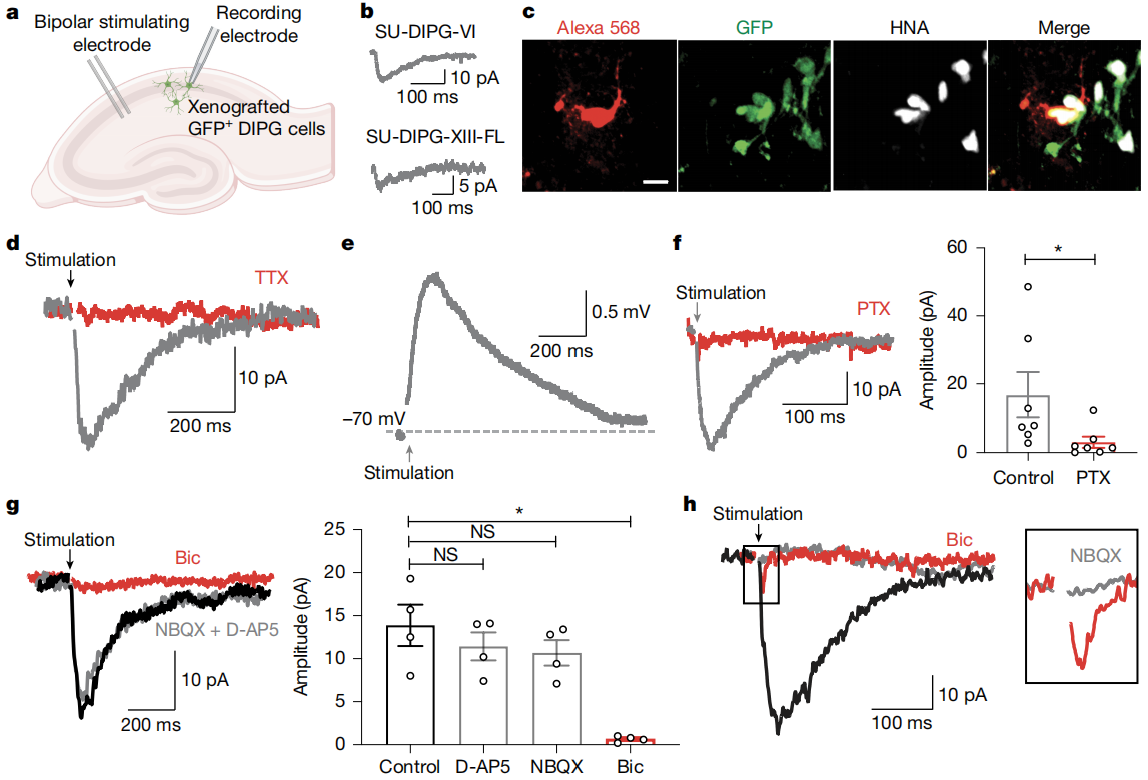
图2 去极化GABA能神经元到胶质瘤突触
在体内实验中,研究人员利用光遗传学技术刺激GABA能中间神经元,结果发现能显著促进DMG细胞的增殖,同时胶质瘤中Fos蛋白的表达增加,说明神经元活动确实能影响肿瘤细胞的行为。而且,与IDH野生型胶质母细胞瘤不同,在DMG微环境中,GABA能中间神经元的数量相对保留,这也为两者之间的相互作用提供了有利条件。
最后,研究团队关注到临床上常用的苯二氮卓类药物劳拉西泮。它是GABA受体的正性变构调节剂,能增强GABA介导的信号。实验发现,劳拉西泮可以增加DMG细胞中GABA能突触后电流的幅度,促进H3K27M+ DMG细胞的增殖和肿瘤生长,缩短荷瘤小鼠的生存期。对于H3/IDH WT半球高级别胶质瘤,劳拉西泮却没有这种效果,这再次凸显了不同胶质瘤亚型对GABA能信号反应的差异。

图3 GABA能神经元信号驱动DMG的增殖
这项研究首次清晰地揭示了GABA能神经元与H3K27M+DMG细胞之间存在促生长的突触通讯,这是一种肿瘤亚型特异性的脑癌神经生理学机制,有助于开发出更安全、有效的治疗方法。