2009年3月18日,“光遗传学之父”美国斯坦福大学的Karl Deisseroth教授带领团队在Nature上发表一篇名为“Temporally precise in vivo control of intracellular signalling”的文章,研究团队开发了一类基因编码的光学工具(optoXRs),其基于G蛋白偶联受体(GPCRs)的共通结构-功能关系,可通过光控实现对细胞内信号通路的高时空精度调控。其中,两种optoXRs(opto-α₁AR和opto-β₂AR)分别选择性激活不同的靶向信号通路,在体内对伏隔核神经元的放电活动产生相反影响;且通过精准光刺激伏隔核的optoXRs,可直接驱动自由活动小鼠产生条件性位置偏好。该工具为研究哺乳动物行为中生化信号(如细胞内的cAMP、IP₃、Ca²⁺等分子的变化及相关信号通路的激活)的因果作用提供了靶向性和时间精确性的新方法。

为了验证optoXR功能性表达,在单独转染了opto-α₁AR的HEK细胞中,或者同时转染了opto-β₂AR和cAMP门控的Ca2+通道CNGA2-C460W/E583M10的HEK细胞中,进行钙成像实验,结果显示60秒的绿光刺激(504±6nm,77mW/mm2)足以驱动optoXR下游的显著钙信号,但在对照组则没有(图1c)。为了测试由optoXR控制的信号传导的特异性,60秒的绿光刺激(504±6nm,77mW/mm2)转导的HEK细胞后,然后通过免疫分析法分析cGMP、cAMP和IP1(IP3的降解产物)的水平。给光刺激后表达opto-β₂AR的细胞中cAMP含量显著增加,不招募IP3;表达opto-α₁AR的细胞中IP3信号通路显著上调。
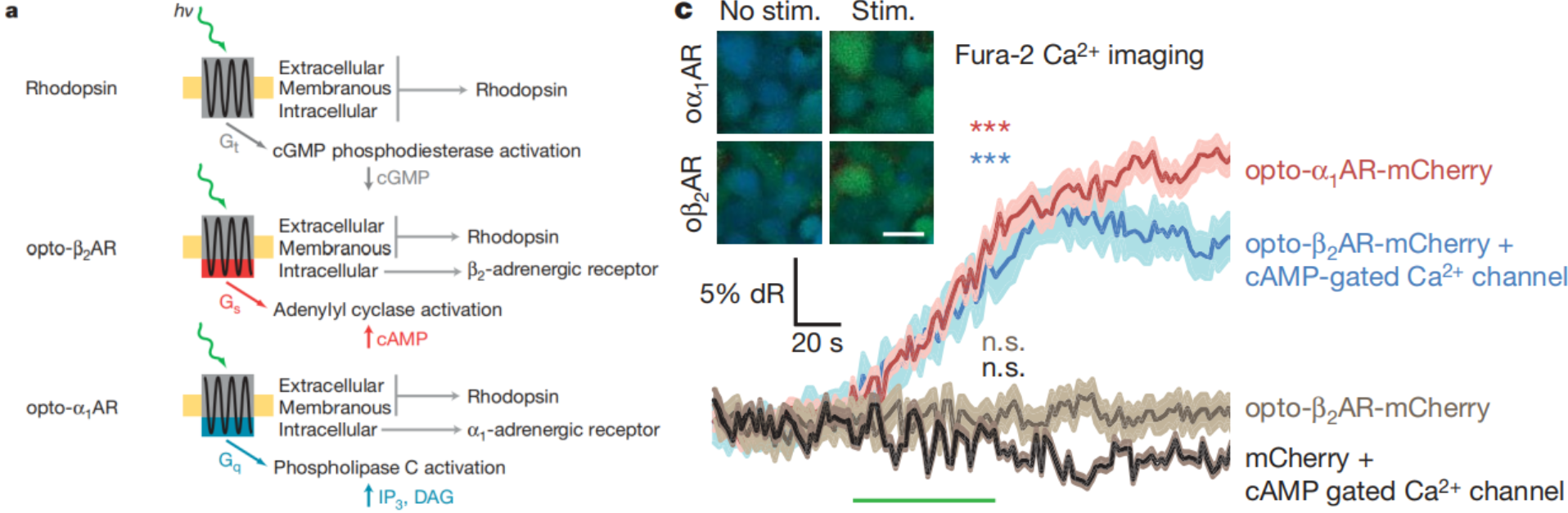
图1 OptoXR细胞内信号转导的光遗传学控制
为了测试optoXR在完整神经组织中的性能,将携带optoXR融合基因的慢病毒载体LV-hSyn-optoXR-XFP(图2b)立体定向注射到成年小鼠的伏隔核中。转导两周后,在人工脑脊液中制备伏隔核的急性冠状切片,进行10分钟的光刺激,随后立即固定并对Ser133磷酸化的CREB(pCREB)进行染色,pCREB是环磷酸腺苷和钙离子偶联信号级联反应的一种生化整合因子。事实上,在不补充外源性类视黄醇的情况下,观察到表达optoXR的细胞群中pCREB水平显著升高(图2b),而在未受光照的组织中则无此现象。
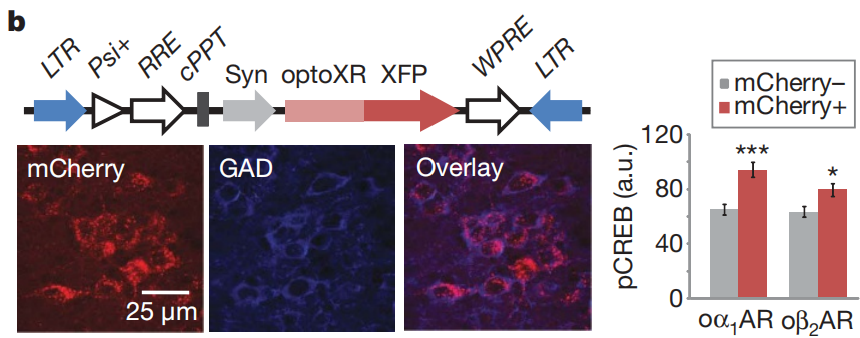
图2 信号特异性及体内功能
通过光电极记录伏隔核内的神经元放电活动,确定了optoXR激活对伏隔核局部电活动的功能性影响(图3a)。给光刺激时表达opto-β₂AR的伏隔核神经元放电减少,这与之前针对Gs的药理学研究结果一致。相反,光刺激增加了表达opto-α₁AR的伏隔核的放电(图3b-d)。尖峰频率直方图显示,optoXR对放电率影响的动力学与生化而非电信号的启动一致(图3d)。综上所述,optoXRs可在体内功能性表达,从而实现对细胞内级联反应的差异化光激活控制,并能调节网络生理活动。
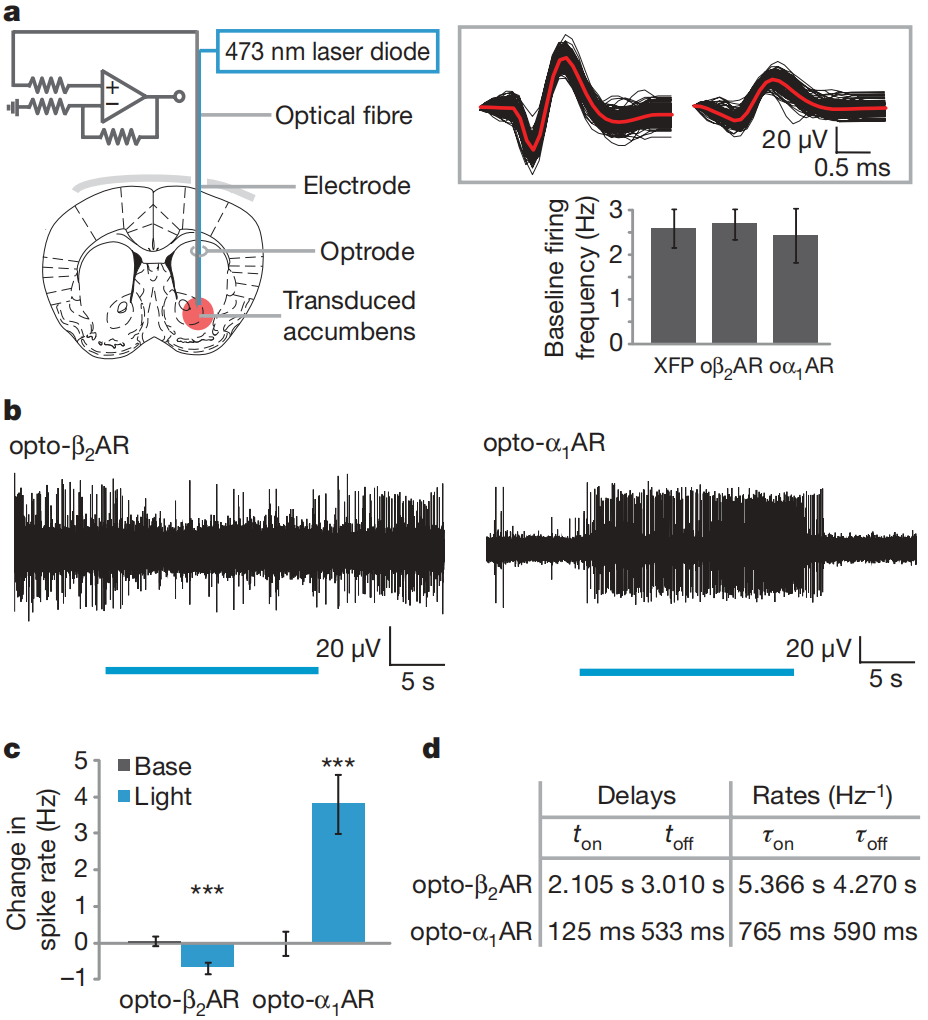
图3 体内optoXR对神经活动的调节作用
接下来,采用光遗传学方法评估了光刺激optoXR对自由活动小鼠行为的调控能力。将慢病毒LV-hSyn-optoXR-XFP注射在小鼠伏隔核,埋置光纤对神经元进行光学控制(10Hz,473nm)(图4a)。条件性位置偏好实验结果显示,表达opto-α₁AR的小鼠在光刺激后,对装置中条件侧的偏好显著增加(图4b),而表达opto-β₂AR和ChR2小鼠的偏好效果不明显。伏隔核神经元中opto-α₁AR刺激的效应特定于奖励相关行为,并不延伸至对焦虑相关行为或自发活动的直接调节,因为在旷场实验中对同一组小鼠施加相同的光学刺激后,其行进距离或靠墙偏好均未出现显著变化(图4c)。
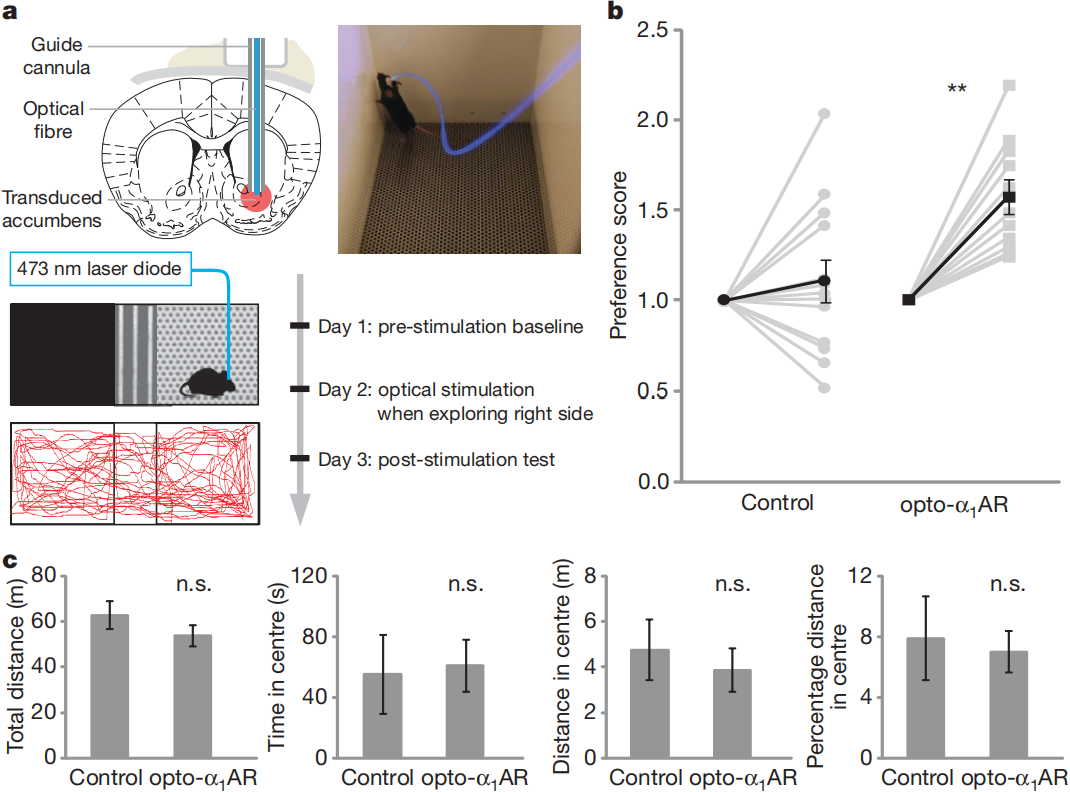
图4 奖励相关行为的光学控制
本文开发的optoXRs工具通过基因编码的光学调控方式,实现了对哺乳动物体内细胞内生化信号通路的高时空精度控制,首次在行为层面(如条件性位置偏好)验证了特定生化信号对哺乳动物行为的因果作用,补充了现有光遗传学技术在胞内信号调控中的空白,为解析神经环路功能、行为机制及疾病病理提供了靶向性强、时间精确的新手段。但其局限性在于,optoXRs可能无法覆盖配体偏向性信号传导中所有受体构象状态,目前仅验证了两种肾上腺素受体相关的嵌合体,适用范围有限,且依赖特定波长光刺激,可能限制多通路同时调控的灵活性。