腺相关病毒(AAV)载体是目前体内基因治疗递送的主要平台。AAV属于细小病毒科依赖病毒属,其生命周期依赖辅助病毒。重组AAV(rAAV)去除了病毒编码序列,保留反向末端重复序列(ITRs)用于基因组复制和包装,使其具有低免疫原性等优势。在载体设计方面,通过自然发现、理性设计、定向进化和计算机设计等方法开发新型衣壳,并对基因组进行优化以控制基因表达、容纳大基因和增强持久性。rAAV已在多种疾病的临床治疗中应用,如治疗脂蛋白脂肪酶缺乏症的Glybera和治疗视网膜营养不良的Luxturna已获批上市。然而,AAV基因治疗仍面临大规模生产、成本、质量控制、免疫屏障等挑战,未来需多学科协作推动其发展。
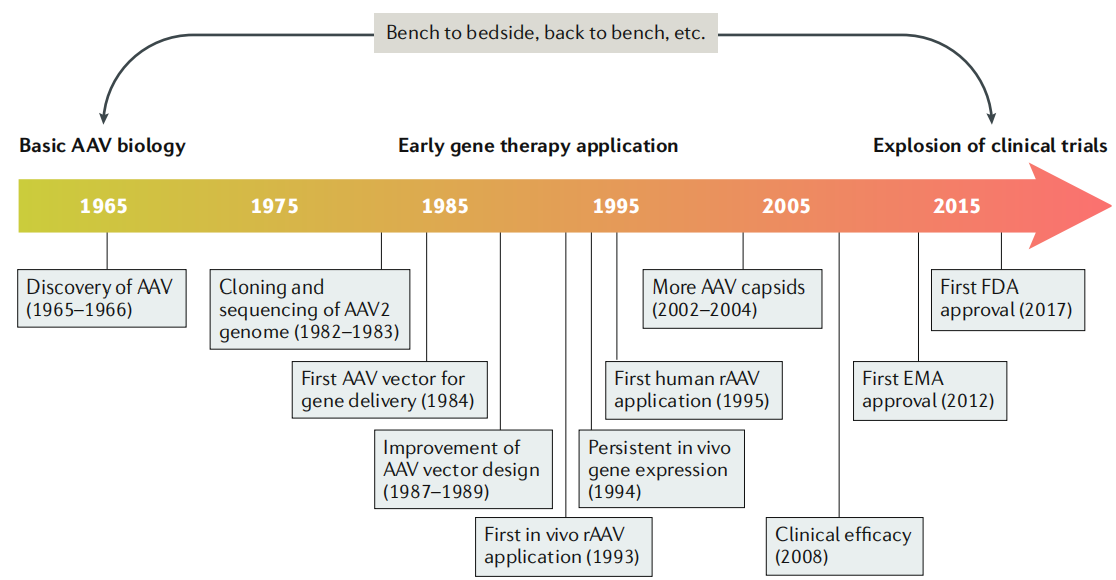
图1 AAV基因治疗开发的关键里程碑
AAV载体是基因治疗递送的重要平台,在疾病治疗方面展现出巨大潜力,但其发展也面临诸多挑战。
AAV病毒特性:AAV属于细小病毒科依赖病毒属,生命周期依赖辅助病毒,常见的辅助病毒如腺病毒(AdV)。AAV病毒由直径约26nm的二十面体蛋白衣壳和约4.7kb的单链DNA基因组构成,衣壳包含VP1、VP2和VP3三种亚基,这些亚基相互协作,共同保护内部的基因组,而基因组两端的ITRs则在复制和包装中起关键作用。其中,AAV基因组中的rep基因编码4种复制蛋白,参与病毒基因组的复制过程;cap基因编码衣壳亚基,决定衣壳的组成和结构;还有专门编码装配激活蛋白(AAP)的基因,该蛋白对病毒例子的装配至关重要。
rAAV载体特征:rAAV在保留野生型AAV的衣壳序列和结构的基础上,对基因组进行了改造,它去除了所有AAV蛋白编码序列,替换为治疗基因表达盒,仅保留ITRs。因此,rAAV的包装容量存在一定限制,小于5.0kb,在设计时需考虑治疗基因序列的长度和调控元件的大小。
rAAV转导过程:rAAV通过与细胞表面受体结合,经网格蛋白介导的内吞作用进入细胞,在细胞内经历一系列pH依赖的结构变化,通过细胞骨架网络运输,经核孔进入细胞核。此时,释放的单链基因组必须转化为双链才能进行转录,这一转化过程可通过第二链合成或链退火两种方式实现,之后基因组可环化形成游离 DNA,实现基因表达。
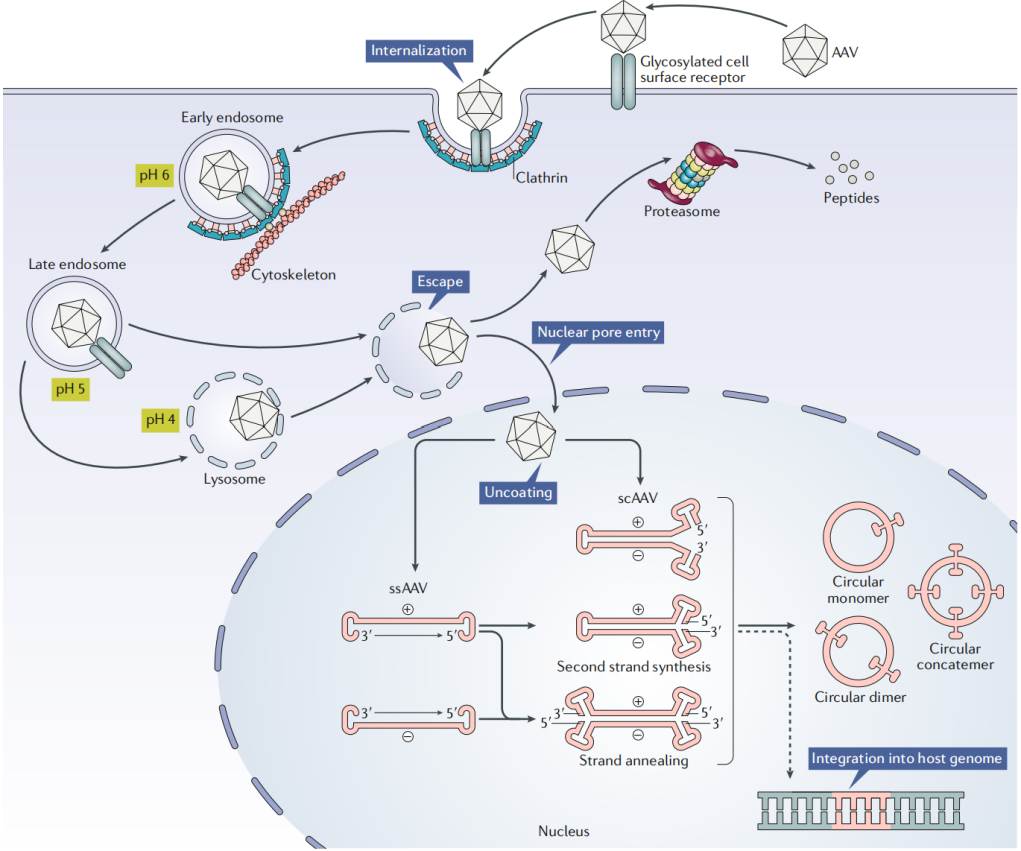
图2 rAAV转导途径示意图
衣壳开发策略:为获得新特性,研究人员采用多种方法开发新型衣壳,包括自然发现(如从人类肝脏组织分离出AAV9,可跨越血脑屏障)、理性设计(如对AAV2进行改造,改变其靶向性和免疫原性)、定向进化(如CREATE方法筛选出可跨越血脑屏障的AAV-PHP.B)和计算机设计(如预测出Anc80,在多种组织有良好疗效)。
基因组设计要点:首先是控制基因表达,通过选择合适的启动子控制其在特定的细胞或组织中精准表达,同时进行密码子优化提高基因表达的效率和特异性;采用设计缩短基因(如治疗杜氏肌营养不良症的微型肌营养不良蛋白基因),或者通过共递送两个AAV载体等策略容纳大基因;利用基因编辑促进基因组整合、插入支架/基质附着区域(S/MAR)序列等方法增强基因表达的持久性。
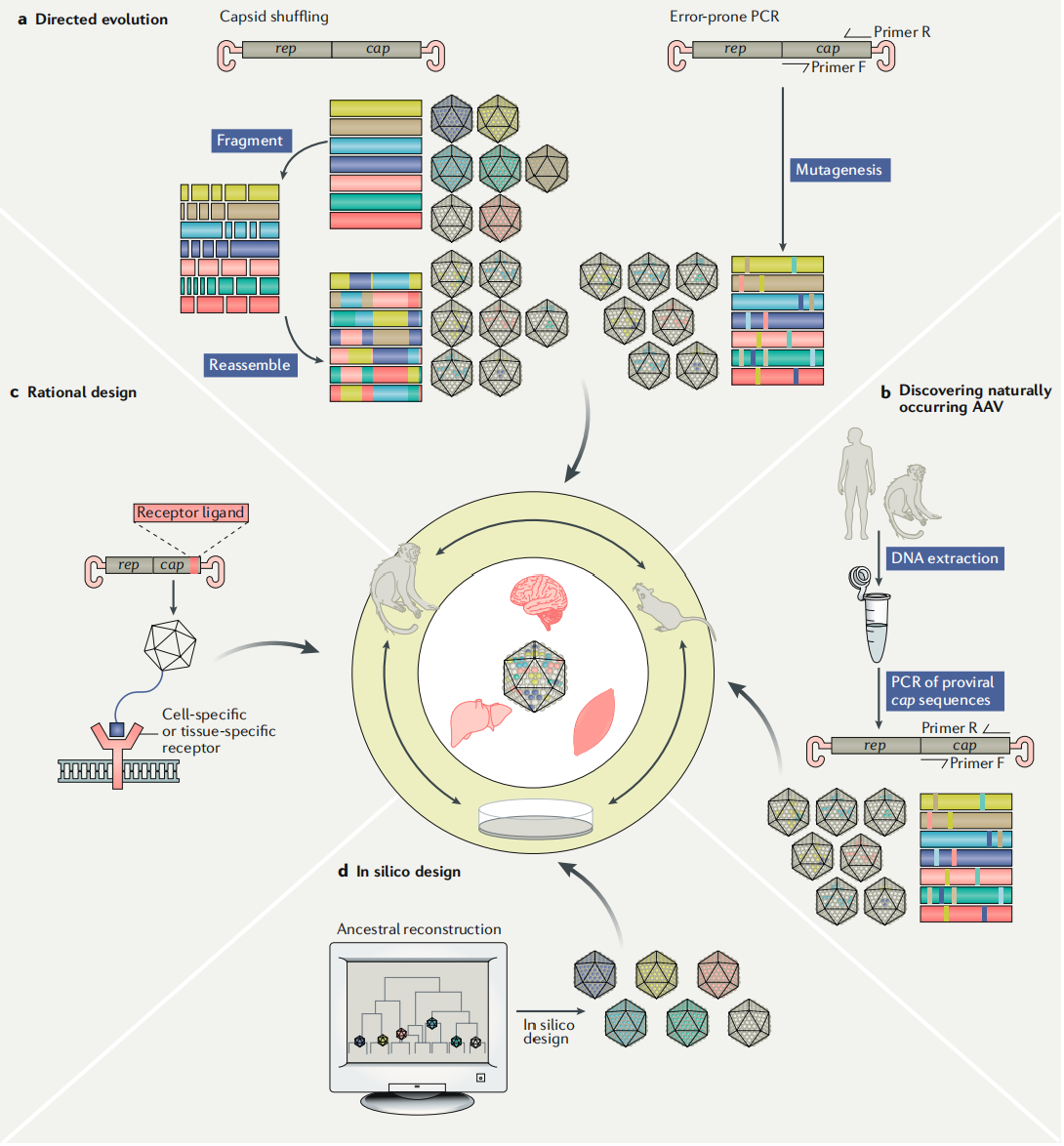
图3 衣壳发现与工程的四种主要方法的信息图
临床应用现状:截至2018年11月13日,已有145项涉及rAAV的干预性临床试验在ClinicalTrials.gov注册。AAV1(Glybera)和AAV2(Luxturna)已获监管批准用于商业用途,目前临床试验中常用的衣壳血清型包括AAV2、AAV8、AAV9等。
治疗策略分类:基因替换主要用于治疗隐性单基因疾病(如Glybera治疗脂蛋白脂肪酶缺乏症,Luxturna治疗视网膜营养不良);基因沉默主要针对毒性获得性突变的单基因疾病(如亨廷顿病),但目前大多处于临床前开发阶段;基因添加可用于治疗复杂遗传和获得性疾病(如通过rAAV递送重组抗体治疗HIV感染);基因编辑利用可编程核酸酶修复疾病相关突变(如体内rAAV基因编辑治疗溶酶体贮积症)。
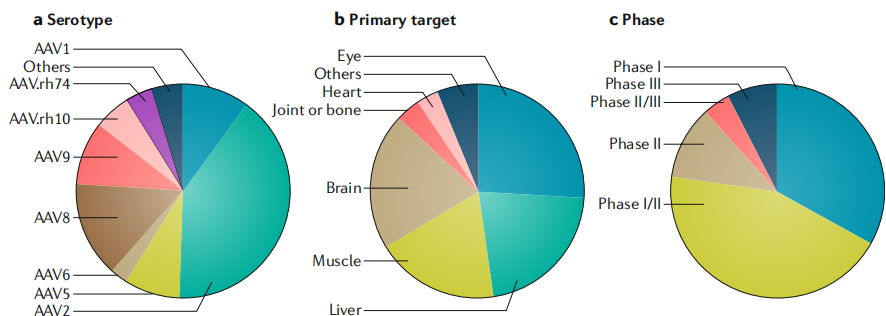
图4 rAAV介入基因治疗临床试验概述
生产与成本难题:AAV基因治疗药物价格昂贵(如Glybera曾达120万美元/患者,Luxturna为42.5万美元/眼治疗),造成这一现象的主要原因是生产规模扩大困难且成本高,目前的生产系统效率较低,临床试验成本也较高。
质量控制问题:空壳与完整颗粒比例在不同制备中差异大(空壳可占20%-98%);载体效力评估受多种因素影响,体内模型重复性差,体外替代试验发展迅速;DNA组成方面,杂质可能带来风险,目前缺乏统一的DNA含量评估标准;衣壳特性方面,新型衣壳需要准确评估稳定性和异质性。
免疫相关障碍:人体中存在针对AAV衣壳的中和抗体(NAbs),它们会阻碍基因递送,AAV给药后还会引发体液免疫和细胞免疫反应,影响治疗效果。此外,AAV载体还会激活先天免疫,需要采取策略降低免疫反应。
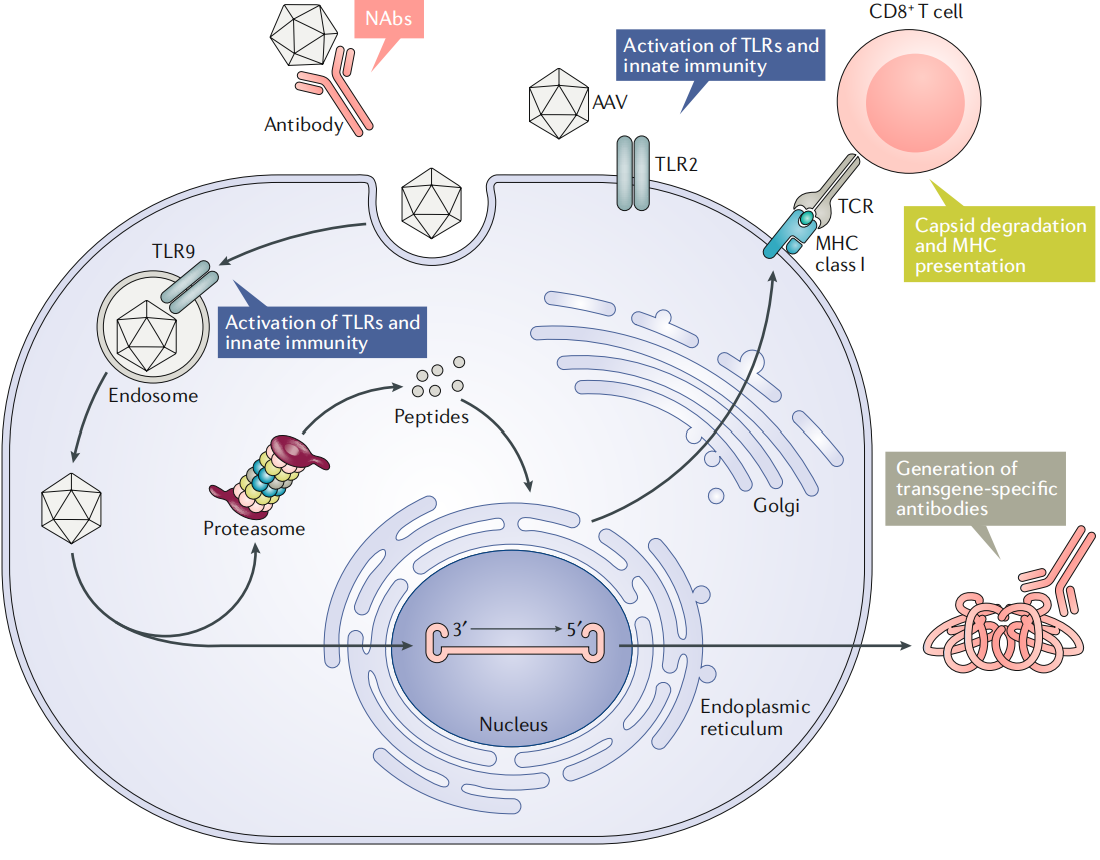
图5 成功递送rAAV基因的免疫屏障
AAV载体具有多种优势。其一,AAV目前被认为不引起人类疾病,安全性较高。其二,重组AAV去除了病毒编码序列,仅保留ITRs,这使得其免疫原性和细胞毒性较低。其三,AAV载体的宿主范围广泛,能够感染多种细胞和组织。其四,AAV载体可实现长期稳定的基因表达,其基因组可形成游离 DNA在细胞中持续存在。
AAV载体的免疫屏障对基因治疗影响显著。血液中存在的NAbs会有效阻止rAAV基因递送,尤其是静脉注射时;AAV给药后,载体衣壳会引发强烈的体液免疫反应产生NAbs,导致大多情况下无法再次给药;衣壳还能触发细胞毒性T淋巴细胞(CTL)介导的细胞毒性,可能清除转导细胞,造成转基因表达的丧失;转基因产物可能引发适应性免疫反应,产生转基因产物特异性抗体和CTL,影响治疗效果;此外,AAV载体还会激活先天免疫,促进炎症细胞因子产生,增强适应性免疫反应。
在生产与成本方面,研究开发更高效的生产系统,如优化细胞培养条件和转染方法,提高载体产量,降低成本;探索新的生产平台,如无细胞生产系统。质量控制上,开发更精确的检测方法,准确评估空壳与完整颗粒比例、载体效力、DNA组成和衣壳特性等;建立统一的质量控制标准。针对免疫屏障,研究如何改造AAV衣壳,消除NAb结合位点,降低免疫原性;探索免疫调节策略,如诱导免疫耐受,抑制免疫反应,以提高基因治疗效果。
原文链接: