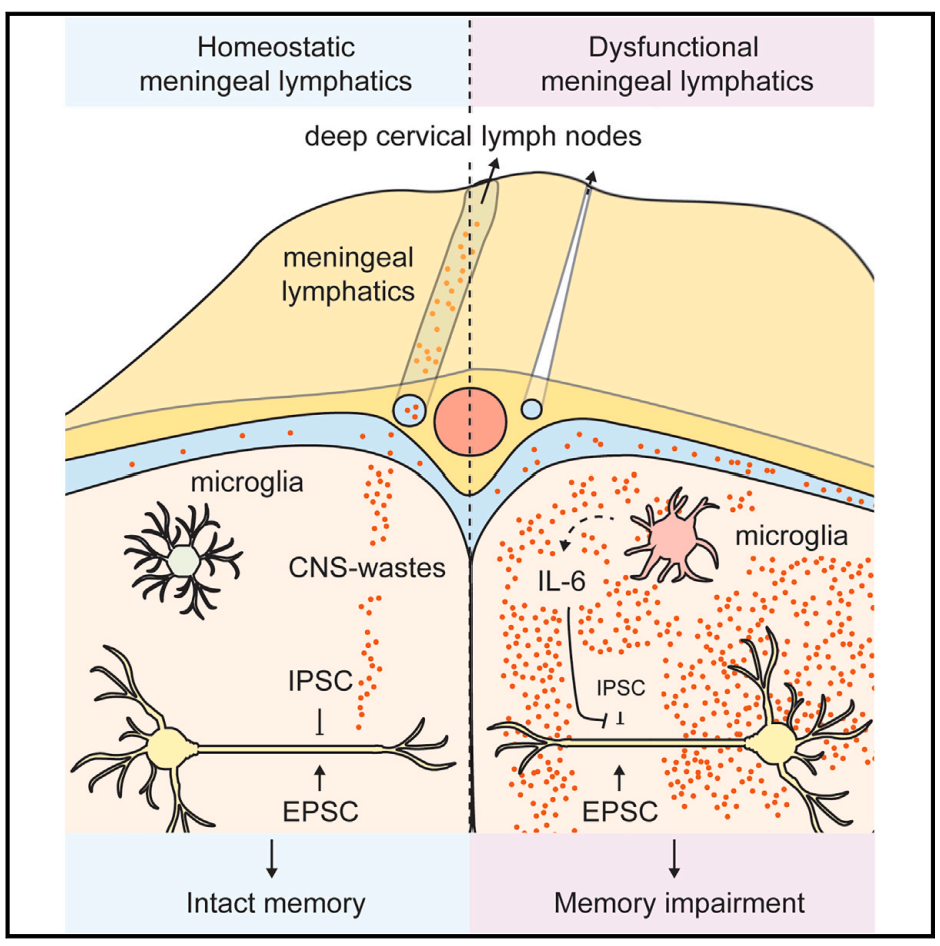
神经元通过整合兴奋性和抑制性突触输入来实现大脑功能,兴奋性/抑制性(E/I)平衡对神经计算(指神经系统尤其是大脑处理和分析信息的过程,涉及神经元之间的电信号和化学信号传递,以实现感知、学习、记忆、决策等功能)至关重要,E/I平衡的破坏与多种神经精神疾病相关。脑膜淋巴管负责引流脑脊液及中枢神经系统废物,其功能障碍与多种神经退行性疾病有关,但背后的神经机制尚不明确。
2025年3月21日美国华盛顿大学脑免疫学与神经胶质细胞研究中心Jonathan Kipnis团队在Cell杂志发表题为“Meningeal lymphatics-microglia axis regulates synaptic physiology”的文章,研究发现脑膜淋巴管-小胶质细胞轴对突触生理和认知功能至关重要。通过手术和基因模型研究表明,脑膜淋巴管功能障碍会破坏皮质兴奋性/抑制性(E/I)平衡,导致记忆受损,这一过程由小胶质细胞介导,其依赖的白细胞介素6(IL-6)增加会引起突触和行为改变。同时,增强老年小鼠脑膜淋巴管功能可缓解衰老相关的神经和认知衰退,为治疗衰老相关认知下降提供了潜在靶点。

为了探究脑膜淋巴管对神经回路稳态和行为的作用,通过手术结扎将脑脊液引流至深颈淋巴结(dCLN)的传入淋巴管(以下简称dCLN结扎)。4周后,评估dCLN结扎小鼠与假手术对照组的行为和电生理特征(图1A)。在新物体识别测试中,假手术小鼠对新物体的探索时间增加,而dCLN结扎小鼠对两个物体的探索时间相近,这表明dCLN结扎小鼠无法形成或提取对所探索物体的记忆(图1B)。为了验证这些结果,研究人员采用了水Y迷宫实验范式(图1C),假手术小鼠更倾向于探索新的臂,而dCLN结扎小鼠在两个臂上的探索时间相似(图1C)。还测试了记忆障碍不是由运动能力、焦虑、社交能力或抑郁样行为的改变引起的。
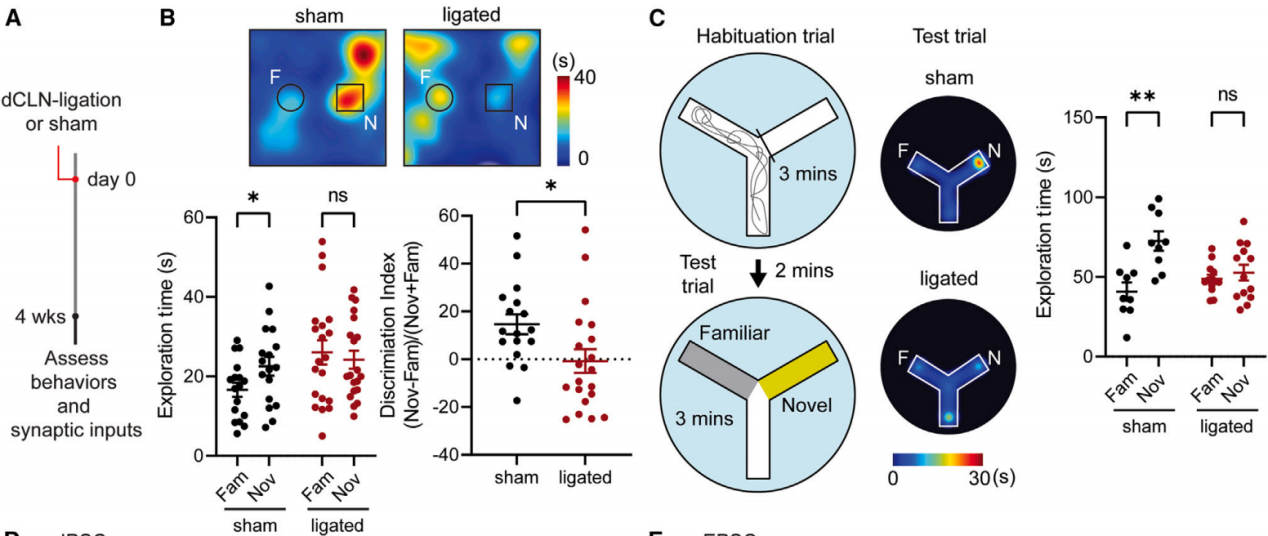
图1 脑膜淋巴管手术消融后记忆受损
已有研究表明脑膜淋巴管功能障碍会导致行为异常;然而,淋巴管功能障碍与行为变化之间的神经机制仍不清楚。由于内侧前额叶皮层(mPFC)参与决策和认知过程,对II/III层锥体神经元进行电生理学实验,结果发现与对照组相比,dCLN结扎小鼠的微小抑制性突触后电流(mIPSCs)频率降低了约20%,但幅度没有变化(图2D)。mIPSC频率的下降在结扎后3周显现出来。结扎4周后,在海马CA1突触中也观察到了类似的变化。相比之下,兴奋性突触相关参数,包括微小兴奋性突触后电流(mEPSC)的频率和幅度均保持不变(图2E)。蛋白质分析显示抑制性突触后gephyrin和抑制性突触前成分VGAT分别减少了约20%。兴奋性突触分子如PSD-95和vGlut1的水平没有变化。dCLN结扎小鼠单个神经元的自发抑制性突触后电流(sIPSC)频率和幅度均下降(图2F),此外,自发兴奋性突触后电流(sEPSC)频率也有下降趋势。这一结果表明,观察到的mIPSC频率降低确实会影响正常生理情况,且无法通过体内平衡机制得到补偿。为了证实这一点,研究人员比较了同一神经元在相同刺激后抑制性突触反应与配对兴奋性突触反应。电刺激I层轴突纤维,同时将膜电位分别保持在-70 mV或0 mV,以测量兴奋性或抑制性突触反应。与之前的实验一致,dCLN结扎小鼠神经元中诱发的IPSC/EPSC比值比假手术对照组降低了约20%(图2G)。
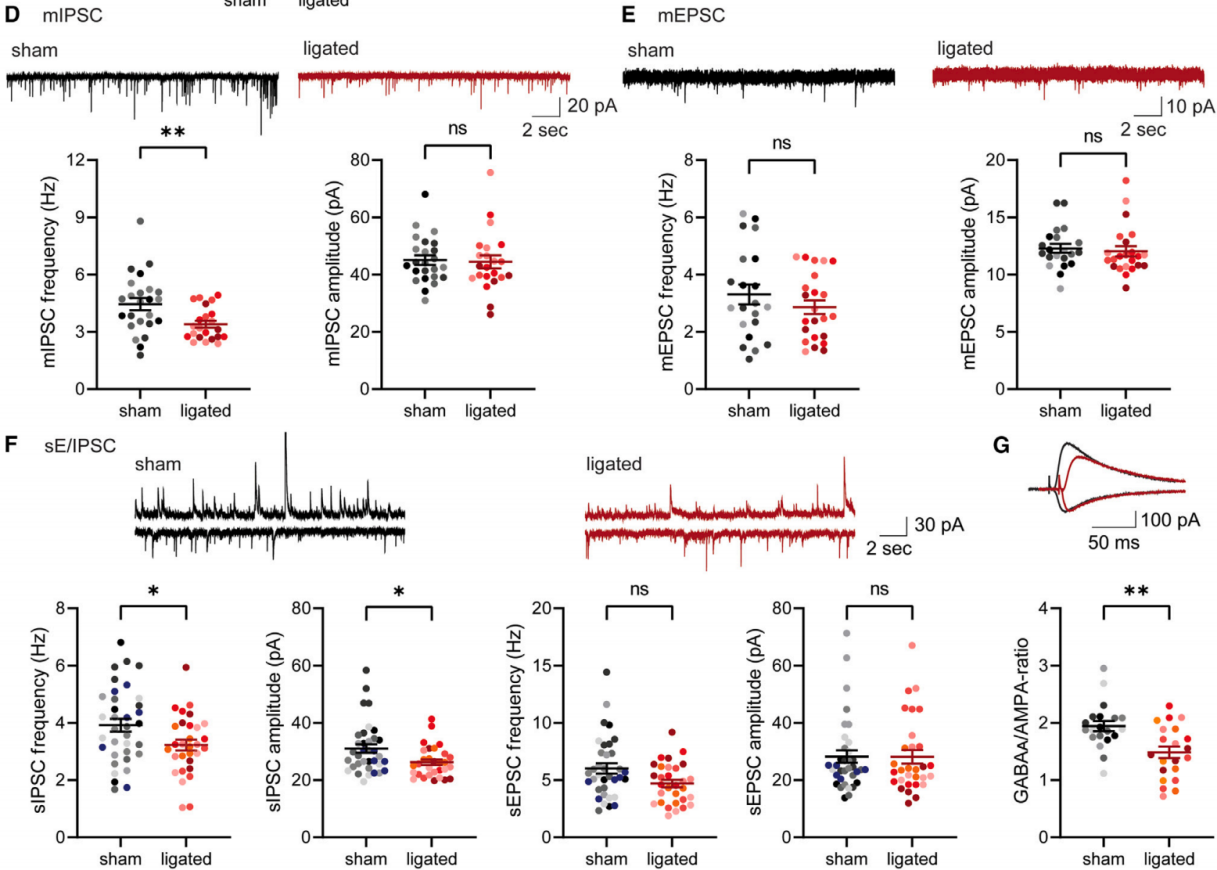
图2 脑膜淋巴管功能失调导致突触E/I输入失衡
由于脑膜淋巴管负责引流脑脊液,研究人员分析了假手术和dCLN结扎小鼠的脑脊液蛋白质组和代谢组结果显示某些细胞代谢产物增加。这些代谢物可能通过与实质中的神经元或非神经元细胞相互作用,导致突触和行为异常的反应。小胶质细胞是大脑中的常驻巨噬细胞,它会对脑膜淋巴管的变化做出反应,并通过一系列机制监测神经网络活动以优化神经回路,这些机制包括吞噬作用、细胞外基质重塑和调整放电活动。为了测试小胶质细胞对于脑膜淋巴管功能障碍小鼠所表现出的行为和突触表型是否必要,将dCLN结扎与小胶质细胞损耗实验相结合。集落刺激因子1受体(CSF1R)信号通路对包括小胶质细胞在内的巨噬细胞存活至关重要。从dCLN结扎/假手术当天开始,将CSF1R拮抗剂 PLX5622混入食物中喂给小鼠,结果显示小鼠大脑中的小胶质细胞大量减少(图3A),dCLN结扎小鼠的行为和突触改变消失(图3B-3D),且运动活动不受影响。
为了确认小胶质细胞在介导dCLN结扎小鼠突触表型中的作用,结扎了Csf1r ΔFIRE/ΔFIRE小鼠(这种小鼠缺乏小胶质细胞)的dCLN传入血管(图3E),但其他巨噬细胞群保持正常。与前面实验结果一致,Csf1r ΔFIRE/ΔFIRE小鼠在dCLN结扎后mIPSC频率没有变化,而Csf1r WT/WT同窝对照小鼠的mIPSC频率下降(图3F),两者的mIPSC幅度均未观察到变化(图3F)。另一方面,dCLN结扎使Rag2 KO小鼠(缺乏T细胞和B细胞)的mIPSC频率降低,与野生型(WT)小鼠相似。
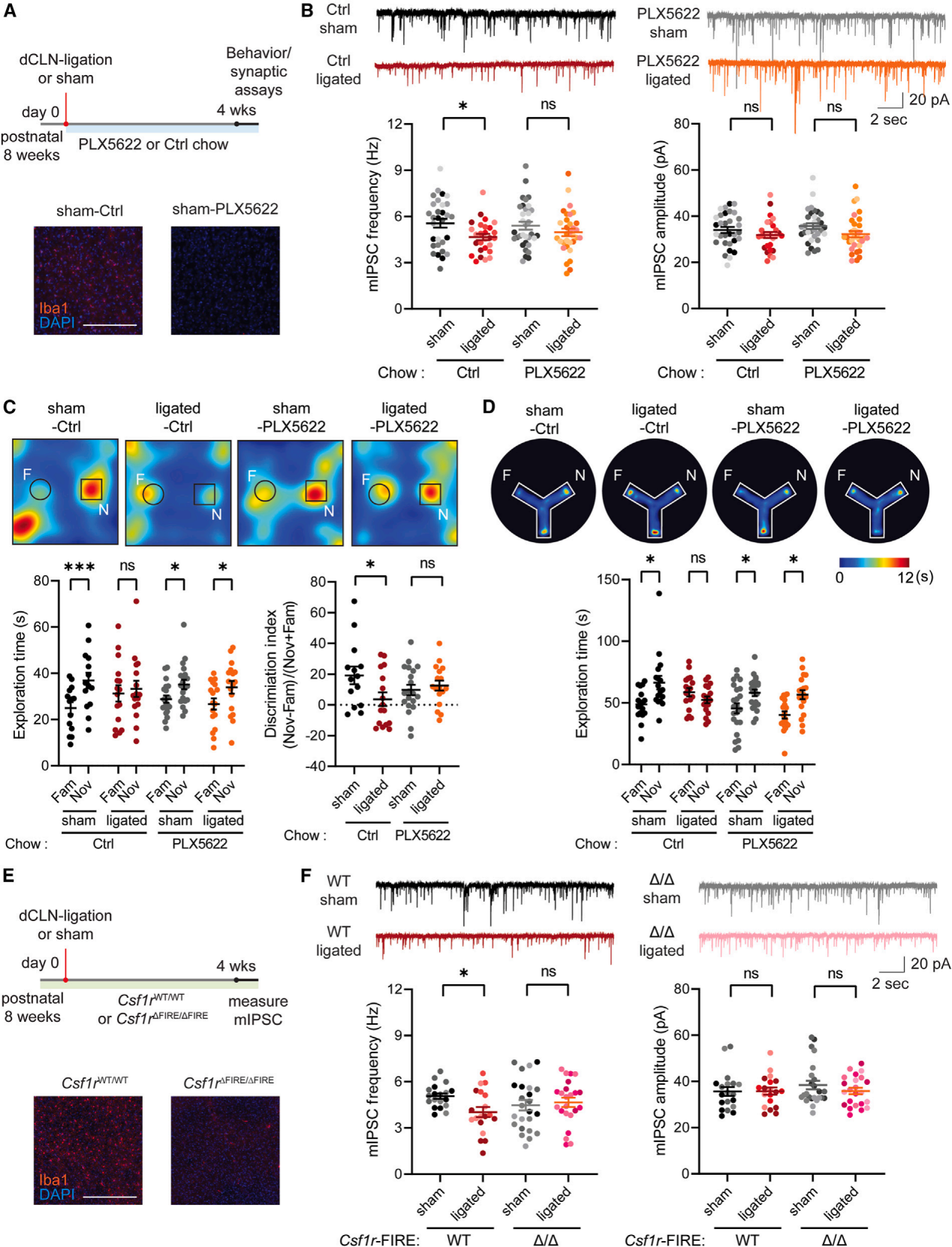
图3 小胶质细胞介导 dCLN 结扎小鼠的突触和行为表型
为探究功能异常的脑膜淋巴管对小胶质细胞的影响,研究人员对假手术组和dCLN结扎组小鼠的前额叶皮层(PFC)中分选出CD45+细胞,进行单细胞测序(图4A-4D),结果显示,dCLN结扎组小胶质细胞中与吞噬功能、疾病相关小胶质细胞特征相关的基因表达上调,且损伤相关分子表达增加(图4F)。dCLN结扎后单个小胶质细胞的体积增加了约20%,但小胶质细胞密度和形态复杂性并未改变(图4G-4H),小胶质细胞溶酶体体积增加了约50%(图4I-4L)。此外,作为关键吞噬作用受体的Mer原癌基因酪氨酸激酶(MerTK)在dCLN结扎小鼠的小胶质细胞中的表达也显著增加(图4M-4N)。这些结果表明,小胶质细胞会响应功能异常的脑膜淋巴管而改变其转录组、形态和功能。
小胶质细胞在发育或神经退行性变过程中会吞噬突触。为了测试观察到的突触表型是否归因于小胶质细胞吞噬活性的变化,研究人员用AAV9-InhiPre(AAV9-GAD67-synaptophysin-mCherry-EGFP)标记抑制性突触前结构,在生理pH条件下可检测到mCherry+EGFP双信号,而在低溶酶体pH条件下EGFP信号会消失,仅留下mCherry信号。在假手术/dCLN结扎手术后1周将AAV9 - InhiPre注射到mPFC中(图4O)。注射3周后,用抗Iba1抗体对PFC进行标记(图4P)。结果显示假手术组和dCLN结扎小鼠mPFC中被小胶质细胞吞噬的突触(mCherry+Iba1+)体积相当(图4Q-4R)。
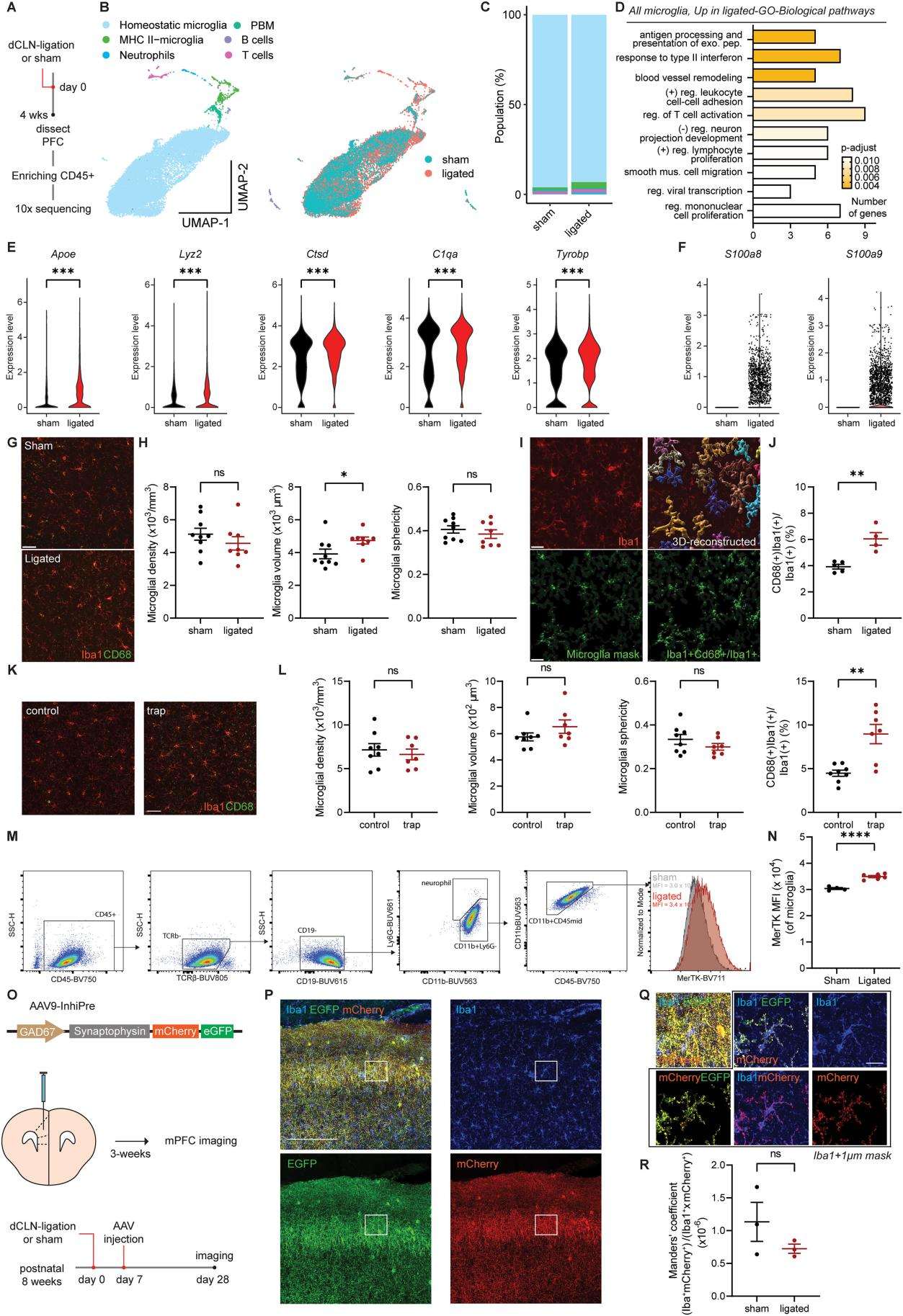
图4 dCLN 结扎小鼠皮质小胶质细胞的改变
为了探究小胶质细胞调节抑制性突触的潜在机制,定量PCR结果发现dCLN结扎小鼠的前额皮质中Il6表达增加了3.5倍(图5A),巨噬细胞- 1抗原(CD11b)阳性的组分中Il6表达也升高了4-6倍(图5B)。已有研究表明,急性IL-6处理脑切片可特异性降低抑制性突触反应,其机制涉及γ-氨基丁酸(GABA)受体的运输和/或内化过程的改变。为了验证过量的IL-6可能介导dCLN结扎诱导的电生理和行为表型,在Il6基因敲除(Il6 KO)小鼠和年龄匹配的野生型(WT)小鼠中,测量mIPSC并进行行为学测试,这些小鼠分为dCLN结扎组和非结扎组(图5C)。与假手术的Il6 KO小鼠相比,dCLN结扎的Il6 KO小鼠的mIPSC频率显著升高(图5D)。此外,与dCLN结扎的Il6 WT同窝小鼠不同,在新物体识别测试中dCLN结扎的Il6 KO小鼠对新物体的探索时间比熟悉物体更长,且运动活性未发生改变(图5E-5F)。虽然目前尚不清楚Il6基因敲除导致dCLN结扎后mIPSC频率增加的潜在机制,但这些结果表明,IL-6信号通路可能是dCLN结扎表型的潜在介导因素。
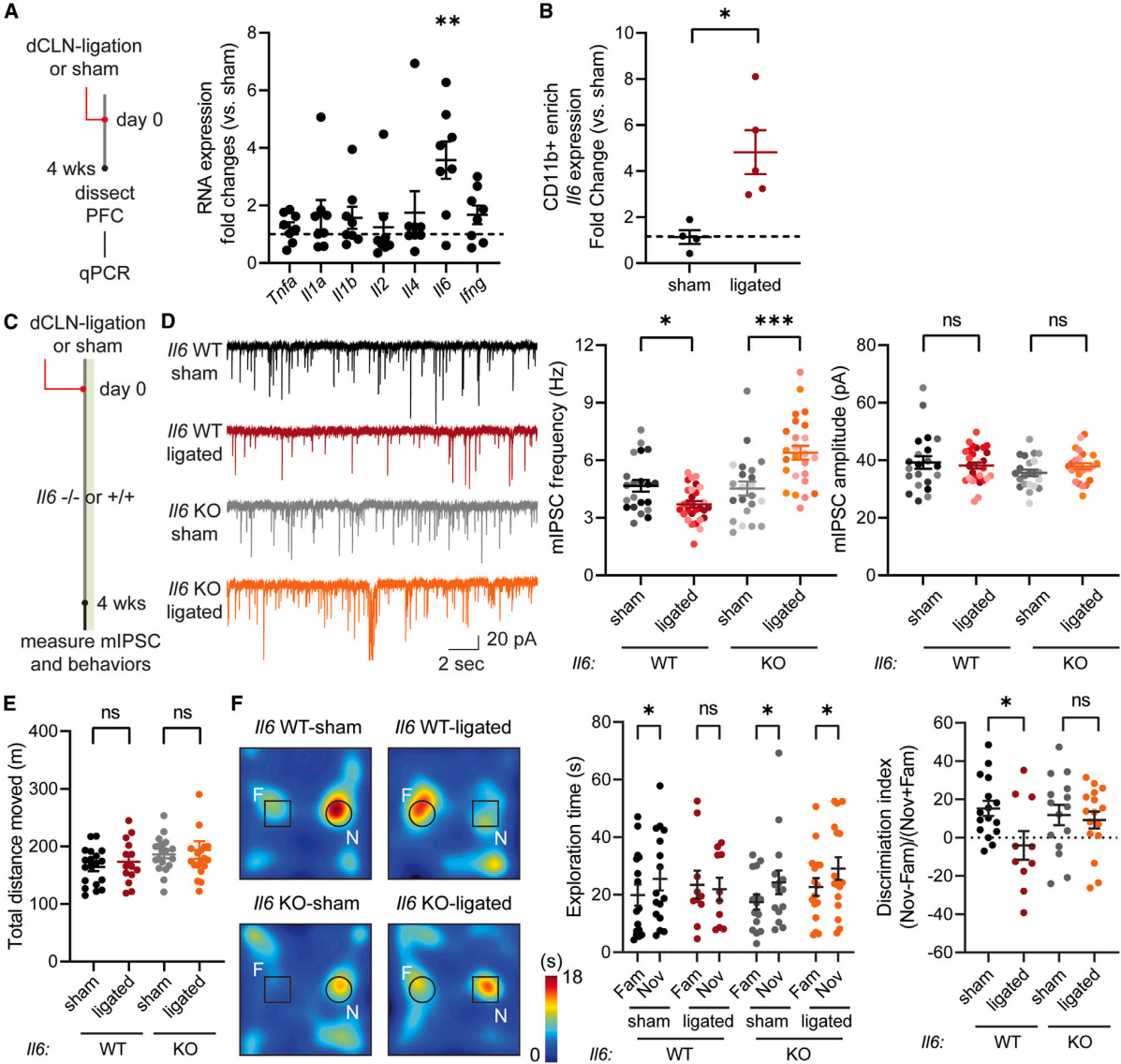
图5 在 Il6 KO 小鼠中 dCLN 导致的突触和行为表型消失
IL-6是一种促炎细胞因子,通过两条途径发挥其下游信号传导作用 。IL-6与膜结合受体IL-6Ra结合,通过gp130启动下游信号传导(经典IL-6信号传导);或者IL-6可以在细胞外空间与可溶性IL-6Ra结合,形成IL-6-可溶性IL-6Ra复合物,该复合物通过膜结合的gp130在不表达IL-6Ra的细胞上启动信号传导(反式IL-6信号传导)。利用sgp130Fc(与Fc融合的gp130可溶性结构域)结合并清除细胞外的IL-6+可溶性IL-6Ra复合物,抑制反式IL-6信号传导。给dCLN结扎小鼠的mPFC植入含sgp130Fc或aCSF的渗透泵(图6A),发现阻断反式IL-6信号传导可部分缓解mIPSC频率的降低(图6B)。将Il6rafl/fl小鼠与Syn1-Cre小鼠杂交,条件性敲除神经元中的IL-6Ra(Il6ra cKO),进行dCLN结扎或假手术(图6C)。结果显示,Il6ra cKO小鼠中与dCLN结扎相关的抑制性突触表型消失(图6D),而兴奋性突触特性在Il6ra cKO和WT小鼠中相当。这表明经典和反式IL-6信号传导均介导了dCLN结扎后mPFC中mIPSC频率的降低。给WT小鼠的mPFC植入含不同浓度IL-6(0.25、0.5、1.0 ng IL-6/h)或aCSF的渗透泵,2 周后评估突触表型(图6E)。发现慢性暴露于0.5和1.0 ng/h的IL-6会降低mIPSC频率(图6F),慢性IL-6处理对mEPSC的频率和幅度也无影响。这些结果表明,长期暴露于IL-6可能会改变抑制性突触的功能。
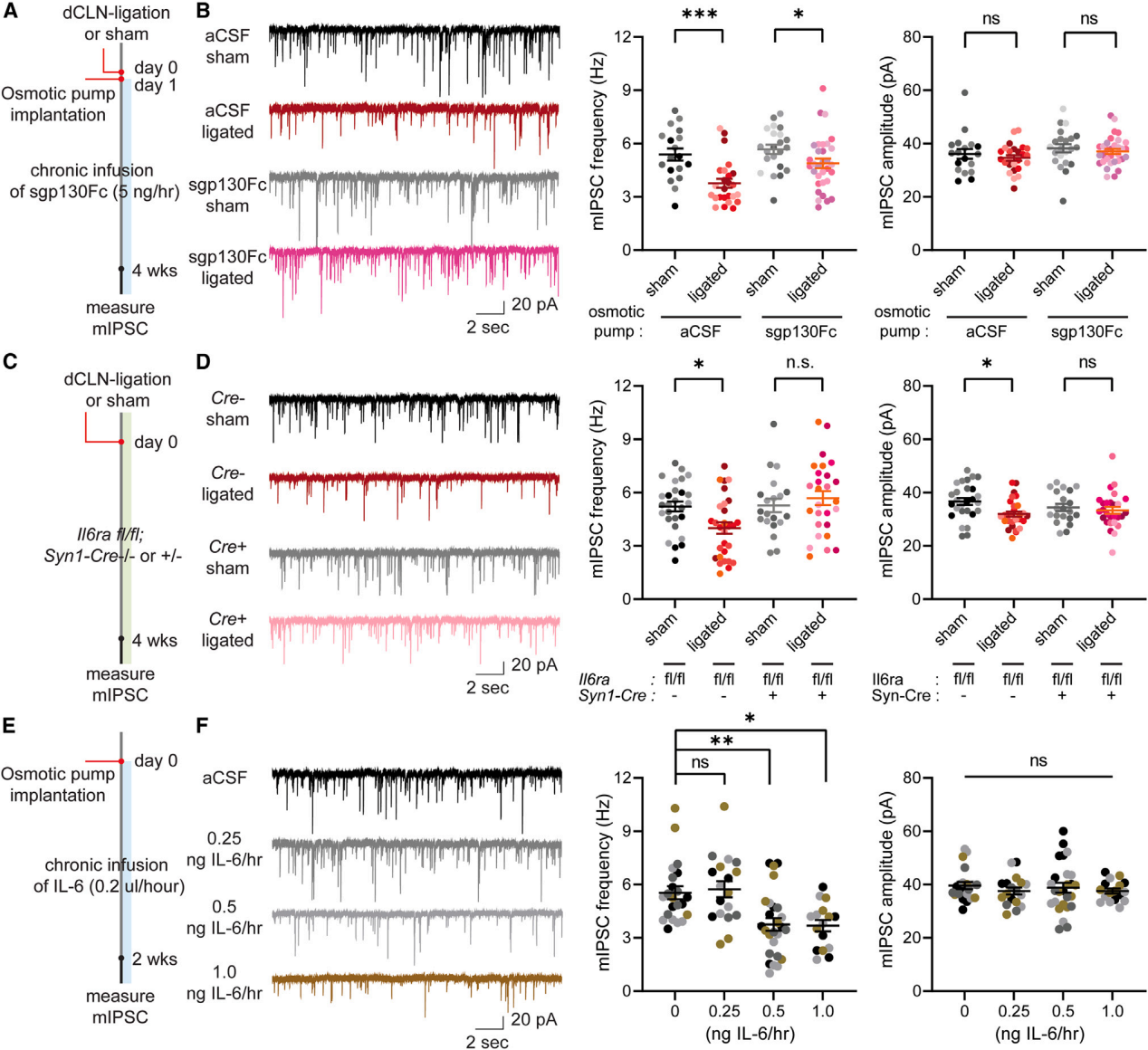
图6 IL-6信号通路介导 dCLN 结扎小鼠的突触和行为表型
对比20-24月龄的老年小鼠和2月龄的年轻小鼠,发现老年小鼠mPFC层 II/III锥体神经元的mIPSC和mEPSC频率分别下降22%和46%,但幅度不受影响(图7A-7B)。向老年小鼠脑池内注射AAV1-CMV-mVEGF-C过表达血管内皮生长因子C,可增强脑膜淋巴管的覆盖范围和功能,增加 Lyve1(淋巴管标记物) 阳性区域覆盖(图7C-7D)。与注射 EGFP 的对照组相比,VEGF-C 处理能恢复老年小鼠 mPFC中降低的mIPSC频率(图7E),mEPSC频率和幅度不受影响(图7F),sE/IPSCs 的两个频率均增加。VEGF-C 处理的老年动物在新物体识别测试中的表现得到改善(图7G),同时 Il6水平降低(图7H)。将AAV1-CMV-mVEGF-C(或EGFP)脑池内注射与老年小鼠的假手术或 dCLN 结扎手术相结合(图7I),发现VEGF-C处理可使假手术组小鼠mIPSC频率增加(图7J),而dCLN结扎会消除VEGF-C的这种效果(图7J),表明VEGF-C对突触回路的影响是通过增强淋巴管功能介导的。

图7 增强老年小鼠的脑膜淋巴管功能可减轻与衰老相关的突触和行为改变
这项研究首次清晰地揭示了脑膜淋巴管-小胶质细胞轴对突触生理和认知功能的重要调节作用,为我们理解神经退行性疾病的发病机制提供了全新视角。尽管目前研究仍存在一些局限,如 mIPSCs 频率降低的具体原因还不完全明确,但它已经为未来的研究指明了方向。