在大脑中,神经元自身缺乏大量的代谢储备物质,因此需要持续不断地获得能量底物的供应。星形胶质细胞能够以糖原的形式储存化学能,并在邻近神经元活性增强时,通过快速激活葡萄糖代谢过程来作出响应。现有证据表明,神经元与星形胶质细胞之间存在的代谢偶联机制,对于维持那些控制核心行为的神经回路的正常功能起着至关重要的作用。然而,目前我们还不完全清楚星形胶质细胞究竟是如何精准监测邻近神经元的代谢需求的,也尚不明确哪些细胞外和细胞内的信号通路在调控着星形胶质细胞的葡萄糖代谢,从而支持神经元的正常活动。2024年7月3日发表在Nature杂志上“Adenosine signalling to astrocytes coordinates brain metabolism and function”一文,揭示了神经活动所依赖的星形胶质细胞代谢激活是通过神经调节因子腺苷作用于星形胶质细胞上的A2B受体来实现的。当A2B受体受到刺激后,在环腺苷酸(cAMP)-蛋白激酶A(PKA)信号通路的作用下,迅速激活星形胶质细胞的葡萄糖代谢过程,进而释放出乳酸,以此来维持大脑诸如睡眠和记忆等基本功能的正常运行。

研究人员利用基因编码的荧光cAMP传感器Epac-SH187以及PKA活性传感器AKAR4 进行试验。这两种传感器在GFAP启动子的调控下表达,可用于监测大鼠海马CA1区星形胶质细胞内的相关变化(图1a-b)。实验结果显示,当对Schaffer侧支纤维(SC)进行刺激后,星形胶质细胞内的cAMP水平和PKA活性显著升高。而在使用谷氨酸受体阻断剂(GluR block)处理细胞后,细胞内cAMP水平的升高以及PKA活性的增强并未受到抑制。这一结果表明,当神经元活动增强时,星形胶质细胞中的cAMP-PKA信号途径是通过谷氨酸以外的信号被神经元的活动所激活(图1c-e,图2a-b)。
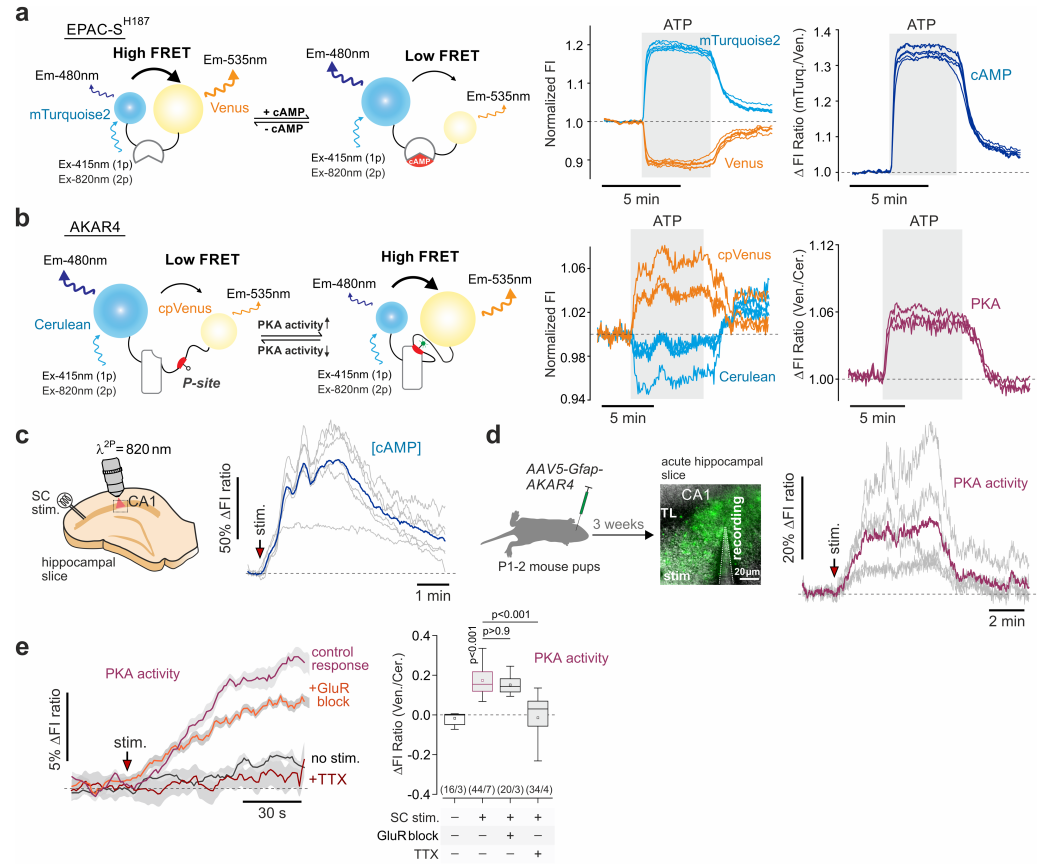
图1 星形胶质细胞中cAMP和PKA活性变化的记录
大量数据显示,大脑中神经元活动增强会促使嘌呤释放至细胞外空间。研究人员发现,嘌呤核苷酸ATP和ADP能够使脑切片中的星形胶质细胞内的cAMP水平和PKA活性升高(图2c和3a)。腺苷酸环化酶激活剂(forskolin)可显著提升星形胶质细胞内的cAMP水平,而腺苷酸环化酶抑制剂(SQ22536)则能显著抑制ATP诱导产生的cAMP响应。同时,抑制离子型嘌呤能受体P2X(PPADS)、代谢型嘌呤能受体P2Y(MRS 2179、MRS 2500),或者阻断钙离子活性(thapsigargin and 0 Ca2+),均不会对ATP引起的cAMP活性变化产生影响(图3b-e)。
此外,腺苷(ADO)同样可以引起星形胶质细胞内cAMP和PKA活性大幅提升,并且这一反应能够被腺苷A2受体拮抗剂(ZM241385)完全阻断(图2c-f)。综合这些结果表明,ATP对星形胶质细胞cAMP-PKA信号通路的影响是间接的,不依赖于细胞内钙离子信号,而是由胞外核苷酸酶活性分解ATP后所产生的ADO来介导的。
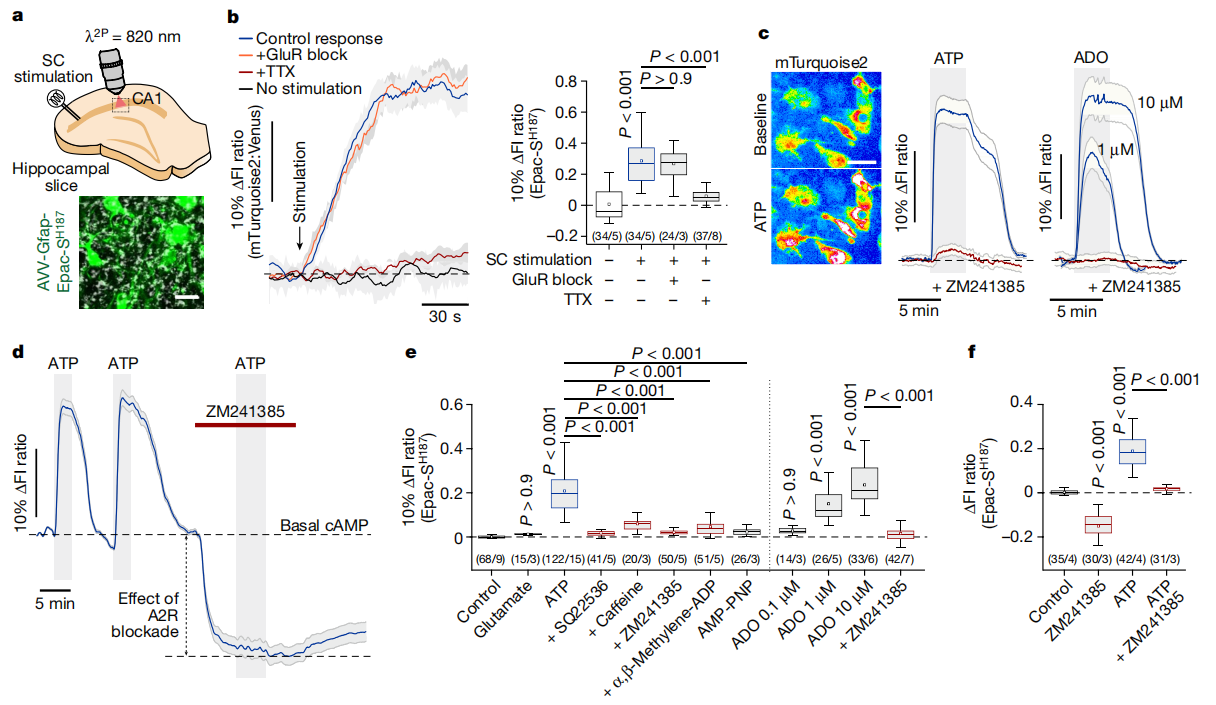
图2 神经元活动在星形胶质细胞中募集cAMP-PKA信号
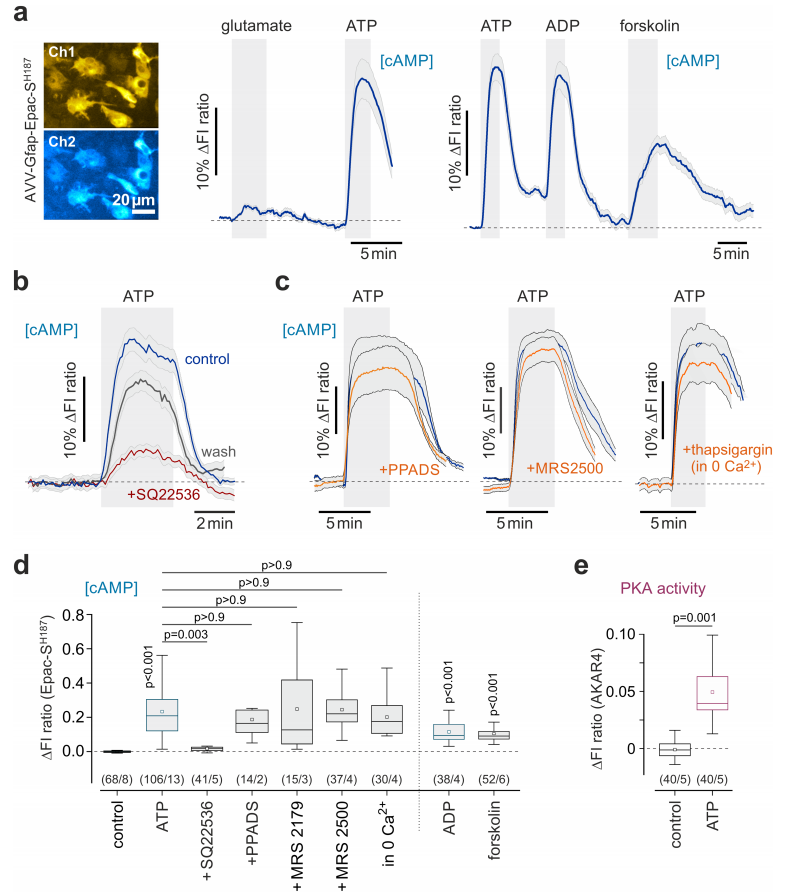
图3 ATP对星形胶质细胞cAMP信号通路的激活作用
对小鼠大脑进行单细胞RNA测序(RNA-Seq)数据分析后发现,星形胶质细胞中腺苷A2B受体(Adora2b)呈现出强烈且特异性的表达,而腺苷A2A受体(Adora2a)在星形胶质细胞中几乎不表达(图4a-b)。实验结果显示,A2B受体拮抗剂(PSB 603)能有效阻断ADO在星形胶质细胞中诱导的cAMP反应,而A2A受体拮抗剂(SCH442416)对该反应无影响,A2B受体激动剂(BAY 60)可模拟ADO对细胞内cAMP的作用,而A2A受体激动剂(CGS21680)则无此效果(图4f)。
在Adora2bf/f的小鼠体内,借助AAV5-Gfap-iCre-mCherry载体表达iCre重组酶,从而删除A2B受体。随后,即使用高达100 µM的ADO处理,细胞内cAMP和PKA活性也不再有变化,但直接用forskolin所诱发的cAMP和PKA响应却不受影响(图4c-g)。此外,抑制A2受体(使用ZM241385)或通过基因手段删除A2B受体(构建A2BR-Astro-KD模型),都会阻断因刺激SC引起的CA1区星形胶质细胞内cAMP和PKA活性的增加(图4h-j)。这些结果充分说明,腺苷是通过作用于A2B受体,来介导星形胶质细胞中cAMP-PKA信号的神经元活动依赖性募集过程。
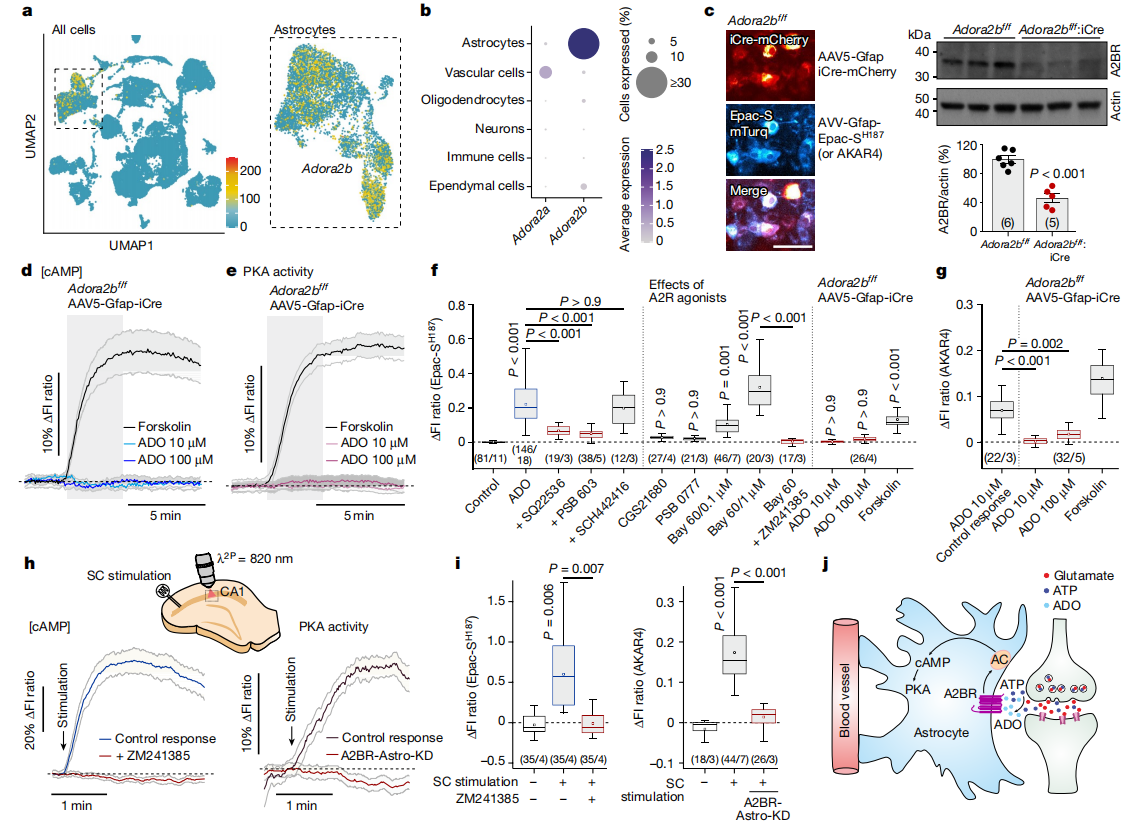
图4 星形胶质细胞中cAMP-PKA信号的神经元活动依赖性募集是由腺苷A2B受体介导的
研究人员利用基因编码的葡萄糖荧光传感器FLIP12glu-700μΔ6和胞质NADH-NAD+氧化还原状态传感器Peredox进行观察,发现ATP和ADO能够显著提高星形胶质细胞的葡萄糖消耗速率和糖酵解速率(图5a-d)。A2B受体激动剂(BAY 60 - 6583)也有相同作用,但在A2B受体基因删除的情况下(A2BR-Astro-KD组),该作用消失(图5a)。接下来,研究人员使用酶微电极生物传感器对大鼠脑急性切片进行检测,结果显示ATP和腺苷都能引发明显的乳酸释放现象。使用ZM241385处理后,AMPA诱导的乳酸释放量显著降低,用Oxamate抑制乳酸脱氢酶可使基础乳酸释放减少约90%,而用PSB 603或ZM241385阻断A2B受体可使乳酸释放减少60-70%(图3e-f)。
随后,研究人员将Adora2bf/f小鼠与 Aldh1l1Cre/ERT2+/-小鼠杂交,构建了星形胶质细胞中A2B受体条件性删除的小鼠模型。经他莫昔芬处理后,小鼠大脑A2B转录水平降低60%,脑切片中乳酸基础释放量减少41%,且cAMP水平也显著降低(图5g-i)。对脑组织进行靶向代谢组学分析发现,A2B受体缺失导致大脑代谢重编程,柠檬酸循环、酮体代谢和 Warburg效应等过程显著下调(图j-l)。这表明,A2B受体介导的信号传导对控制星形胶质细胞葡萄糖代谢、维持全脑代谢活动起着不可或缺的作用。
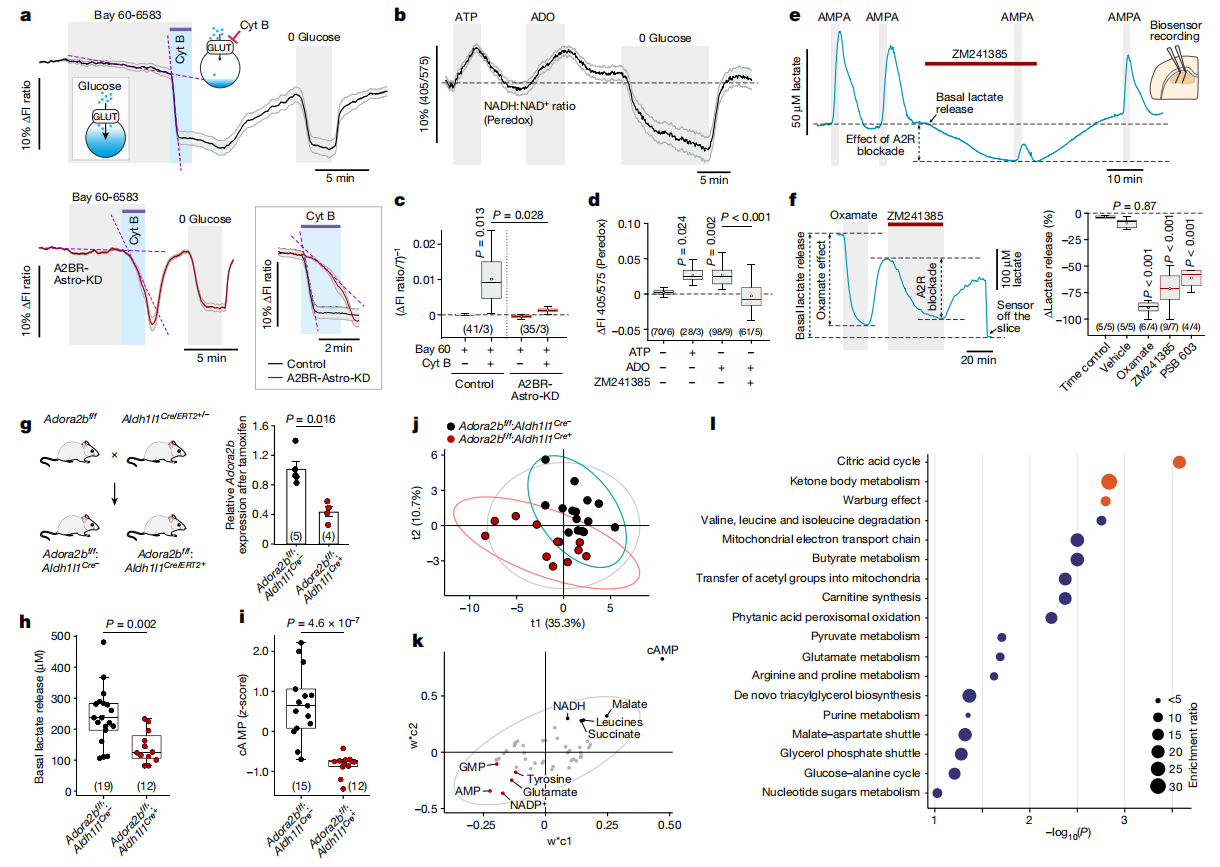
图5 星形胶质细胞中腺苷A2B受体介导的cAMP信号调节脑葡萄糖代谢
海马体的神经回路在学习和记忆中起着至关重要的作用。研究人员在Adora2bf/f小鼠模型中分别注射AAV5-Gfap-eGFP-iCre(A2BR-Astro-KD)和AAV5-Gfap-tdTomato(Control)病毒载体,结果显示,A2BR-Astro-KD组由ADO或AMPA诱导的乳酸释放量减少(图6a-c)。在急性海马切片实验中,当研究人员将培养基中的葡萄糖浓度从10 mM降低到2 mM时,通过记录SC场兴奋性突触后电位(fEPSPs)来评估突触功能。结果发现,野生型小鼠海马切片的突触活动能够得以维持,而A2B受体敲低或被药理抑制的小鼠,突触活动在30分钟内消失,相反补充乳酸又可部分恢复其兴奋性突触传递效能(图6d-f)。此外,在海马切片实验中,经典的高频刺激诱导长时程增强(LTP)的实验结果表明,A2B受体敲除小鼠无法产生LTP,补充乳酸或使用β-肾上腺素受体激动剂异丙肾上腺素(isoproterenol)可部分挽救 LTP(图6g-h)。这一系列实验充分证明,在高能量需求或者能量供应减少的情况下,腺苷介导的代谢信号对于维持突触功能起着至关重要的作用。
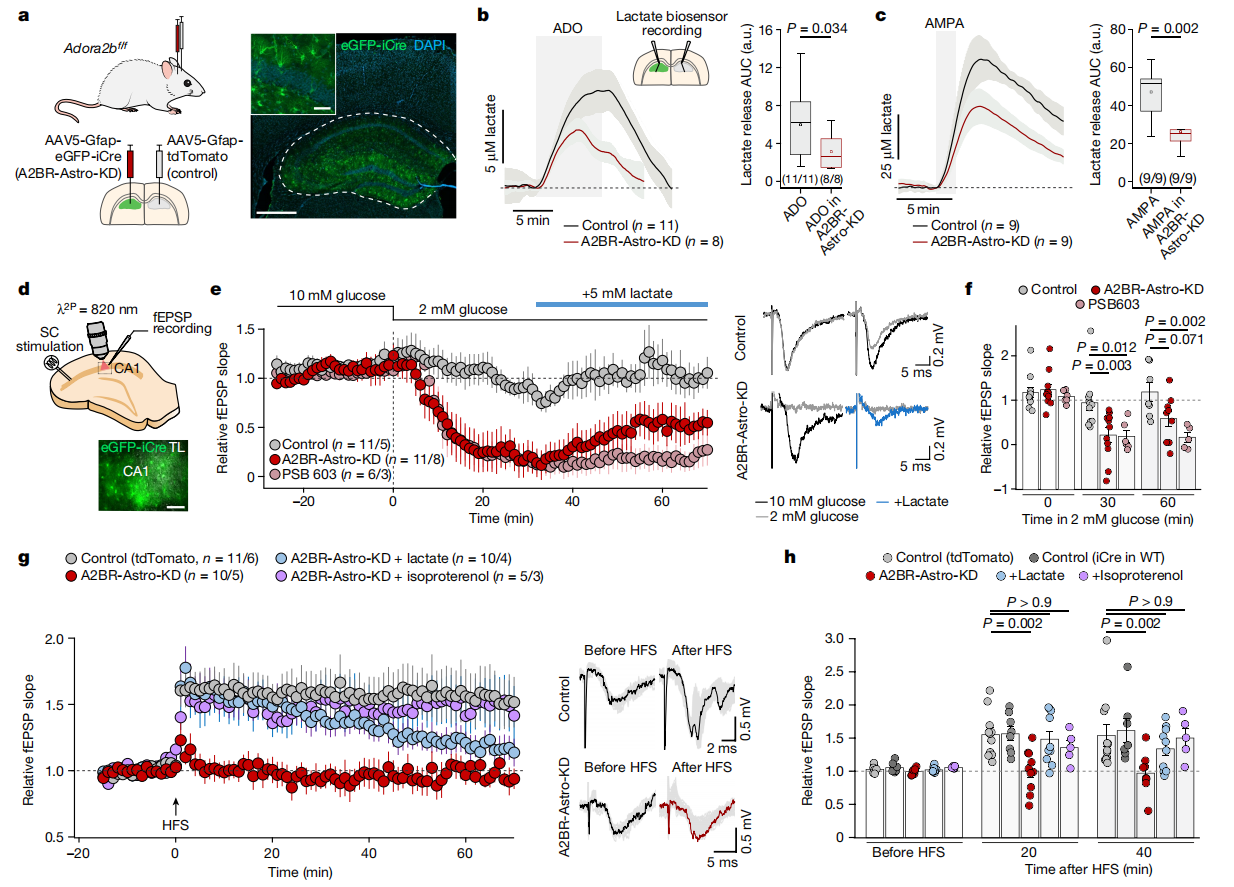
图6 星形胶质细胞中的腺苷A2B受体介导的信号转导维持突触活性和可塑性
随后,研究人员通过物体识别测试评估小鼠的学习记忆能力。结果显示,Control组小鼠在测试中会花费更多时间探索新物体,而A2BR-Astro-KD组小鼠对熟悉物体和新物体的探索时间无明显差异,表明其识别记忆能力受损(图7a-d)。在星形胶质细胞A2B受体条件性删除的小鼠模型(Adora2bf/f :Aldh1l1Cre/ERT2+/-)中,同样出现严重的识别记忆障碍(图7e-f)。当给予β-肾上腺素受体激动剂clenbuterole(0.25 mg/kg;腹腔注射)后,A2B受体敲低小鼠的识别记忆能力得到部分恢复(图7c)。
在睡眠-觉醒调节方面,研究发现特异性敲除大脑星形胶质细胞中A2B受体,会导致小鼠在光期(休息期)的睡眠和觉醒碎片化,非快速眼动(NREM)睡眠期缩短,觉醒事件增多(图7g-h)。通过分析NREM睡眠期间的慢波活动来衡量睡眠压力,研究人员发现A2B受体缺失小鼠慢波活动(0.5-4.0 Hz)和低频慢波活动(0.5-1.5 Hz)显著降低,表明睡眠压力下降(图7i-j)。这表明星形胶质细胞A2B受体介导的信号传导在调节睡眠-觉醒、促进NREM睡眠同步慢波活动方面发挥着重要作用。
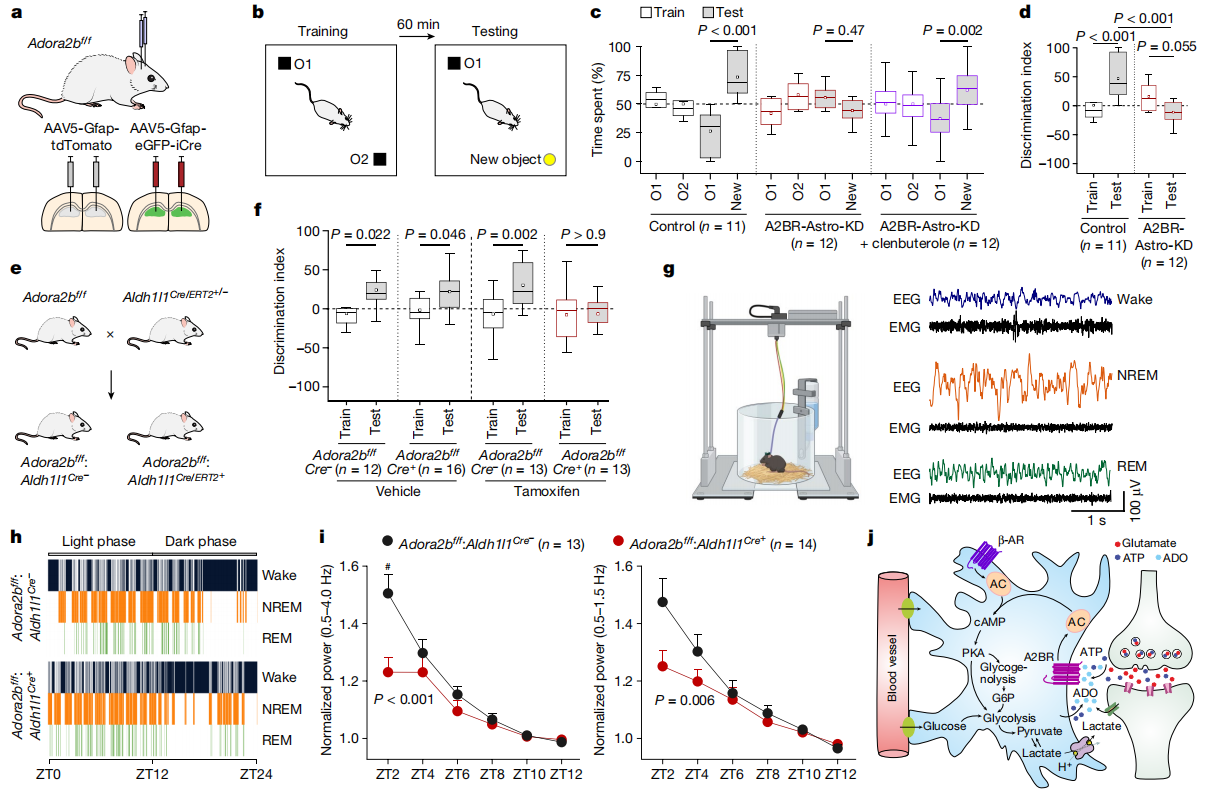
图7 星形胶质细胞中腺苷A2B受体介导的信号转导调控学习记忆和睡眠
综上所述,该研究明确了腺苷A2B受体作为神经元活动的星形胶质细胞传感器的关键地位,表明星形胶质细胞中的cAMP-PKA信号可调节大脑能量代谢,进而支持睡眠和记忆等大脑基本功能。这一成果为理解大脑代谢与功能协调机制提供了重要依据,也为相关神经系统疾病的治疗提供了潜在靶点和理论支撑。
文中用到的病毒产品如下:

布林凯斯可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。