腺相关病毒(AAV)重组载体(rAAVs)是用于人类基因治疗应用的首选工具之一,因为它们在临床试验中表现出良好的安全性,包括能够转导分裂和非分裂细胞、引起有限的细胞毒性,以及允许长期转基因表达。rAAV已被证明能有效地感染许多组织,包括肝脏、肺、眼睛和骨骼肌,它们对组织的转导靶向取决于衣壳属性和给药途径。
成人骨骼肌占体重的40-50%,包括多种不同的肌肉,这些肌肉中的每一个都由收缩性肌纤维组成,这些肌纤维是后有丝分裂的多核细胞,被一种特殊的细胞膜——肌膜和一层称为基底膜的细胞外基质(ECM)所包围。通过系统给药主要研究了rAAV血清型在肌肉中的嗜性:rAAV血清型1、6、7、8和9在大多数动物模型中显示出对骨骼肌的有效转导。

靶向肌肉的AAV血清型主要为AAV1, AAV6, AAV8和AAV9。其中,对骨骼肌和心肌的组织特异性以AAV8, 9较高。
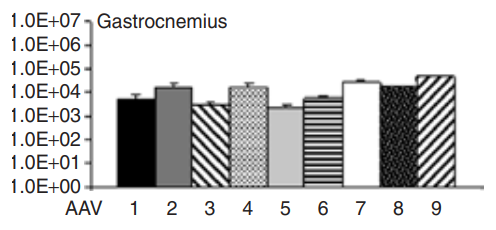
图1 不同血清型在腓肠肌中载体表达情况
应用病毒载体感染肌肉组织进行研究,一般分为系统注射和肌肉内注射。
1、肌肉注射
一般选取鼠前后肢部位注射,注射时针头要垂直快速刺入肌肉,如无回血现象即可注射。肌肉内注射是一种定点注射,可以在注射点附近高效表达,但缺点是病毒扩散十分有限,因此往往需要多点注射,一般每个点在5-10uL。
2、 尾静脉注射
从动物尾部的静脉注射病毒,以输送到全身各处肌肉。这种方式病毒表达较均匀,但是大部分会被其他脏器组织吸收,导致靶向肌肉的病毒较少。
实例1:利用AAV载体介导营养不良小鼠肌肉细胞的体内基因编辑[2]
血清型:AAV9
启动子:CAG
实验动物:mdx;Ai9小鼠
注射方案:胫骨前肌(TA)注射,7.5×10^11 vg/只,表达4周
实验结果:将AAV9-SaCas9+AAV9-Dmd23 gRNAs(以下简称AAV-Dmd CRISPR)注射到mdx;Ai9小鼠的胫骨前肌(TA)中,利用AAV9-CRISPR-Cas9核酸内切酶系统携带成对的gRNAs靶向识别并切除了DMD基因外显子23突变位点序列,成功构建了DMD外显子23缺失的mRNA转录本,恢复了小鼠体内具有生物学活性的抗肌萎缩蛋白的表达。
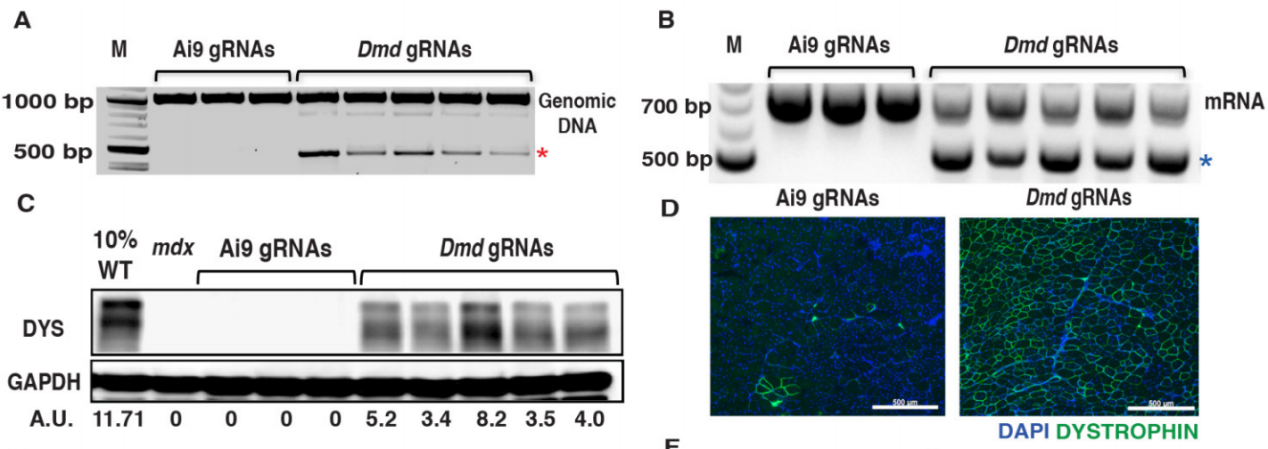
图2 经过AAV9-CRISPR修饰的肌营养不良卫星细胞中目的基因表达
实例2:rAAV血清型1-10在C57BL/6小鼠骨骼肌局部注射的转导效率[3]
血清型:AAV1-AAV10
启动子:CMV
实验动物:C57小鼠,3月龄
注射方案:胫前肌(TA)注射,3.5×10^10 vg/只,表达4周
实验结果:将AAV1-10(rAAV-CMV-LacZ,LacZ是β-半乳糖苷酶的编码基因)通过原位注射至3月龄雄性C57BL/6J的胫前肌(TA)。4周后β-gal染色结果显示,与注射其他血清型的小鼠相比,注射AAV9血清型小鼠的TA肌肉的β-半乳糖苷酶表达量最高,同时AAV基因组拷贝数也最高,说明肌肉局部注射AAV9的转导效率最高。
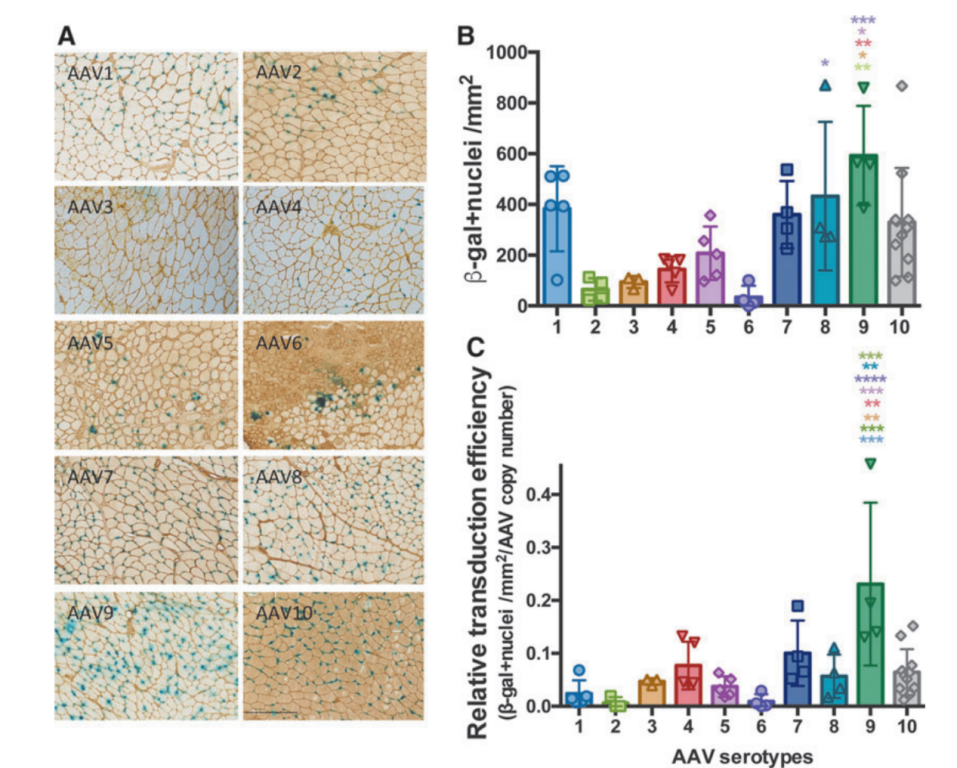
图3 对比C57BL/6小鼠肌肉中AAV转导效率
实例3:衣壳变异的AAV能够进行有效的肌肉定向基因传递[4]
血清型:AAV9、MyoAAV1A
启动子:CMV
实验动物:C57小鼠
注射方案:静脉注射,1.0×10^12 vg/只,表达2周
实验结果:为了研究MyoAAV1A在系统注射后的转导谱和生物分布,给成年C57BL/6J小鼠注射1.0×10^12 vg(约4.0×10^13 vg/kg)AAV9或MyoAAV1A-CMV-EGFP,并分析注射2周后不同组织中的转基因表达和载体基因组丰度。组织荧光成像显示,与注射AAV9的小鼠相比,注射MyoAAV 1A的小鼠肌肉荧光信号更强。重要的是,MyoAAV1A转导心脏的效率比AAV9更有高,而心脏是许多遗传性肌肉病中损伤较大且最重要的器官。
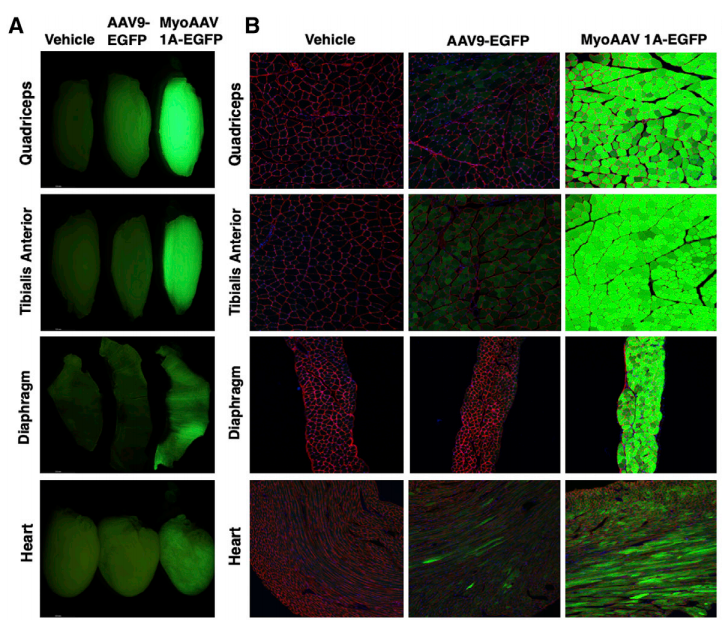
图4 MyoAAV1A能高效地转导小鼠骨骼肌
实例4:低剂量LICA1-SGCA治疗恢复了严重SGCA小鼠模型中的肌肉功能[5]
血清型:LICA1
启动子:CMV、hACTA1
实验动物:LGMDR3小鼠(肌营养不良模型),4周龄
注射方案:静脉注射,5.0×10^12 vg/kg,表达4周
实验结果:将低剂量编码全长人α-肌聚糖(hSGCA)的AAV9或LICA1病毒(AAV-hACTA1-hSGCA)注射到4周大的SGCA 敲除小鼠(LGMDR3小鼠)中,在治疗后4周进行了分析,结果显示在被测试的三种肌肉中,胫骨前肌(TA)、股四头肌(Qua)、膈肌(Dia),LICA1处理组的AAV基因拷贝数、mRNA水平和SGCA+肌纤维百分比均显著高于AAV9处理组。在受影响严重的肌肉中,LICA1比AAV9的转导效率更高,即使在低剂量治疗下,LICA1处理的小鼠也获得了更显著的功能和组织学恢复。
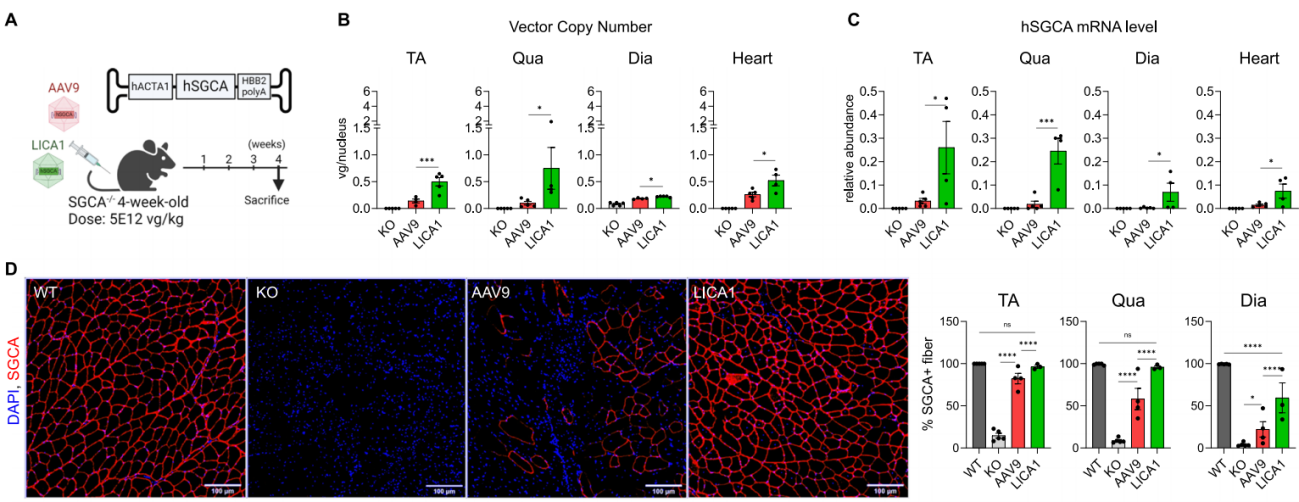
图5 低剂量LICA1在恢复肌营养不良表型和功能方面优于AAV9
实例5:利用分裂内含肽表达抗肌肉萎缩蛋白来治疗杜氏肌营养不良症[6]
血清型:MyoAAV4A
启动子:CMV、Spc5-12、Spc2-26
实验动物:mdx小鼠(肌营养不良模型),3-4周龄
注射方案:眶后静脉注射,8.0×10^13 vg/kg,表达5周
实验结果:杜氏肌营养不良(DMD)为肌纤维膜抗肌肉萎缩蛋白(dystrophin蛋白)完全缺失导致的一种进行性肌营养不良,表现为进行性肌肉损伤和肌无力。为了研究AAV-N1/M3/C6(全长FL-dystrophin基因片段)治疗是否改善了mdx小鼠的肌肉病理状态。给药后5周测量了血清肌酸激酶(CK)水平。与WT小鼠相比,mdx动物的血清CK显著升高,在AAV治疗组显著降低,这表明FL-dystrophin的表达减少了营养不良小鼠的肌肉损伤。使用体内肌肉测试系统测量了肌肉收缩性,与对照组相比,AAV-N1/M3/C6治疗后的mdx小鼠的肌张力有显著提高。
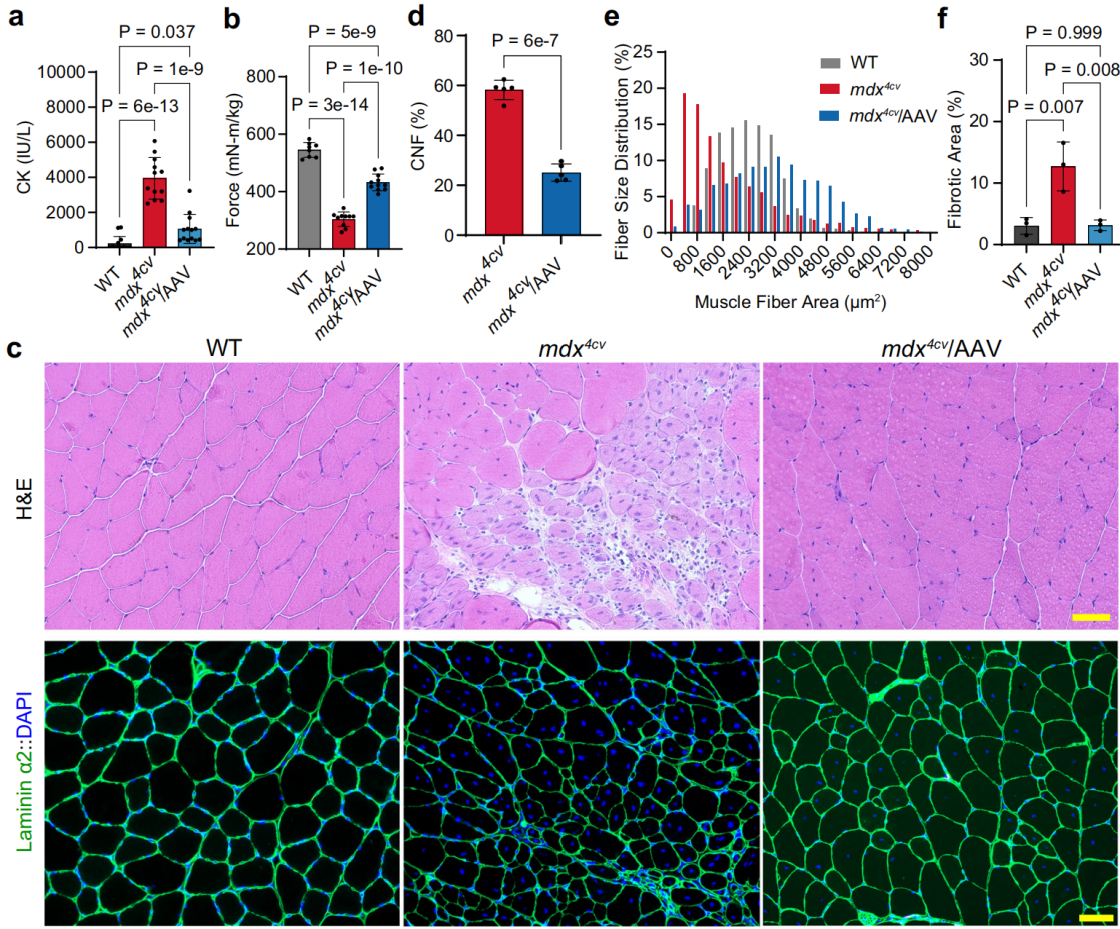
图6 全身注射MyoAAV4A-Dys-N1/M3/C6后mdx小鼠肌肉功能和组织病理学改善
布林凯斯可提供各类病毒包装定制化服务
请联系小布18971216876(微信同号)
或咨询当地销售经理获取更多信息
本文未经授权禁止转载
如有需要,可联系小编获取原文
参考文献
1、Zincarelli C, Soltys S, Rengo G, Rabinowitz JE. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Mol Ther. 2008;16(6):1073-1080.
2、Tabebordbar M, Zhu K, Cheng JKW, et al. In vivo gene editing in dystrophic mouse muscle and muscle stem cells. Science. 2016;351(6271):407-411.
3、Muraine L, Bensalah M, Dhiab J, et al. Transduction Efficiency of Adeno-Associated Virus Serotypes After Local Injection in Mouse and Human Skeletal Muscle. Hum Gene Ther. 2020;31(3-4):233-240.
4、Tabebordbar M, Lagerborg KA, Stanton A, et al. Directed evolution of a family of AAV capsid variants enabling potent muscle-directed gene delivery across species. Cell. 2021;184(19):4919-4938.e22.
5、Vu Hong A, Suel L, Petat E, et al. An engineered AAV targeting integrin alpha V beta 6 presents improved myotropism across species. Nat Commun. 2024;15(1):7965.
6、Zhou Y, Zhang C, Xiao W, Herzog RW, Han R. Systemic delivery of full-length dystrophin in Duchenne muscular dystrophy mice. Nat Commun. 2024;15(1):6141.