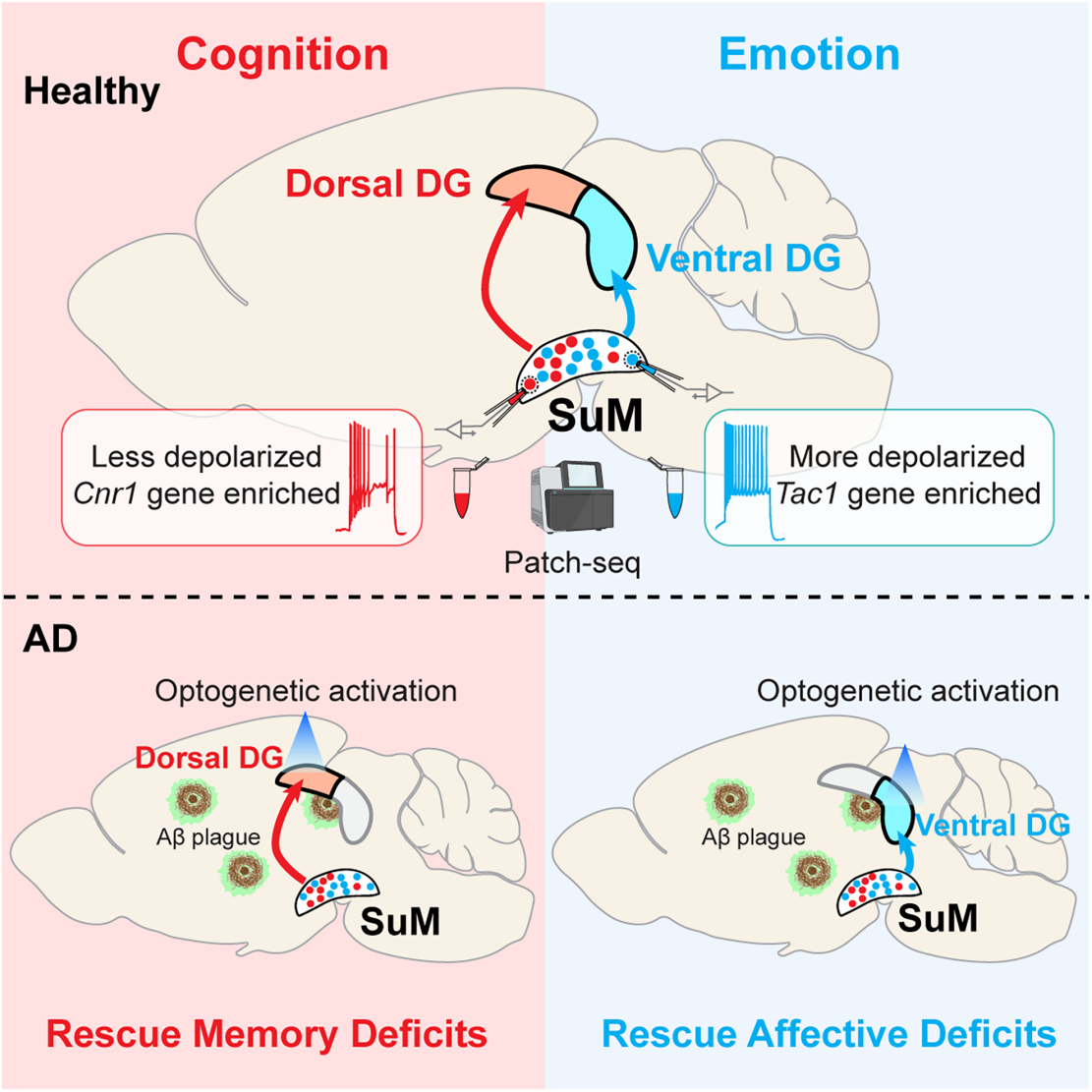
阿尔茨海默病(AD)以进行性认知衰退为核心特征,且多数患者还会出现焦虑、抑郁等突出神经精神症状,然而这些不同症状领域背后的环路水平机制尚未明确,能同时改善AD认知与非认知症状的治疗手段也十分有限;同时,已知海马齿状回(DG)是AD中早期受损且功能分区的脑区(背侧DG调控认知、腹侧DG调控情感),而下丘脑乳头体上核(SuM)虽向DG密集投射并参与多种行为调控,但其与DG形成的亚环路在AD中的作用还不清楚。

2025年10月3日,美国北卡罗来纳大学教堂山分校宋娟课题组组牵头联合多个课题组在Neuron上发表了题为“Segregated supramammillary-dentate gyrus circuits modulate cognitive and affective function in healthy and Alzheimer’s disease model mice”相关文章,该研究发现下丘脑乳头体上核(SuM)向海马齿状回(DG)的背侧(dDG)和腹侧(vDG)投射的神经元构成分子、功能和解剖学上截然不同的亚群,分别调控认知功能(如空间记忆)和情感功能(如焦虑、抑郁);揭示了AD症状背后的环路机制,并为AD治疗提供了潜在靶点。
本研究由北卡罗来纳大学教堂山分校(UNC)宋娟课题组牵头,联合松江研究院李亚东研究员(原宋娟课题组博后),中国科学技术大学薛天教授、上海交通大学基础医学院徐楠杰教授,以及徐天乐教授团队共同完成。本文共同第一作者为:上海交通大学附属第九人民医院罗艳佳研究员(原宋娟课题组博后)、中国科学技术大学博士生李龙飞、UNC博士后陈泽卡博士和董平博士。本项目获得美国国立卫生研究院(NIH)、中国国家重点研发计划与国家自然科学基金等资助。
已知SuM主要向DG发出投射,但投射至dDG与vDG的SuM神经元是否为具有独特生理、分子特征的亚群尚不明确。为此,作者采用双色荧光狂犬病病毒(RV)跨单突触逆行示踪技术,以Calb1-Cre小鼠DG颗粒细胞(GC)为起始细胞,向dDG、vDG分别注射RV-eGFP与RV-mCherry标记单突触输入(图1A-1C)。结果显示,SuM-dDG与SuM-vDG神经元高度不重叠,仅2.78%标记细胞共表达两种荧光蛋白(图1D-1G)。为了验证该解剖学连接差异,用结合不同荧光团的霍乱毒素B亚基(CTB)分别注射dDG、vDG进行逆行示踪。结果与RV示踪一致,CTB标记的SuM-dDG(红色)与SuM-vDG(绿色)神经元在SuM内混杂但重叠极少,证实二者为解剖学上的不同亚群。
随后,向dDG、vDG分别递送AAV2-retro-tdTomato或AAV2-retro-eGFP标记目标神经元,通过离体脑片记录评估其电生理特性(图1H-I)。发现SuM-dDG与SuM-vDG神经元电生理特性存在差异,相较于SuM-dDG,SuM-vDG神经元内在兴奋性显著更高(图1J-K),静息膜电位(RMP)更去极化(图1L),提示二者电生理特性不同。
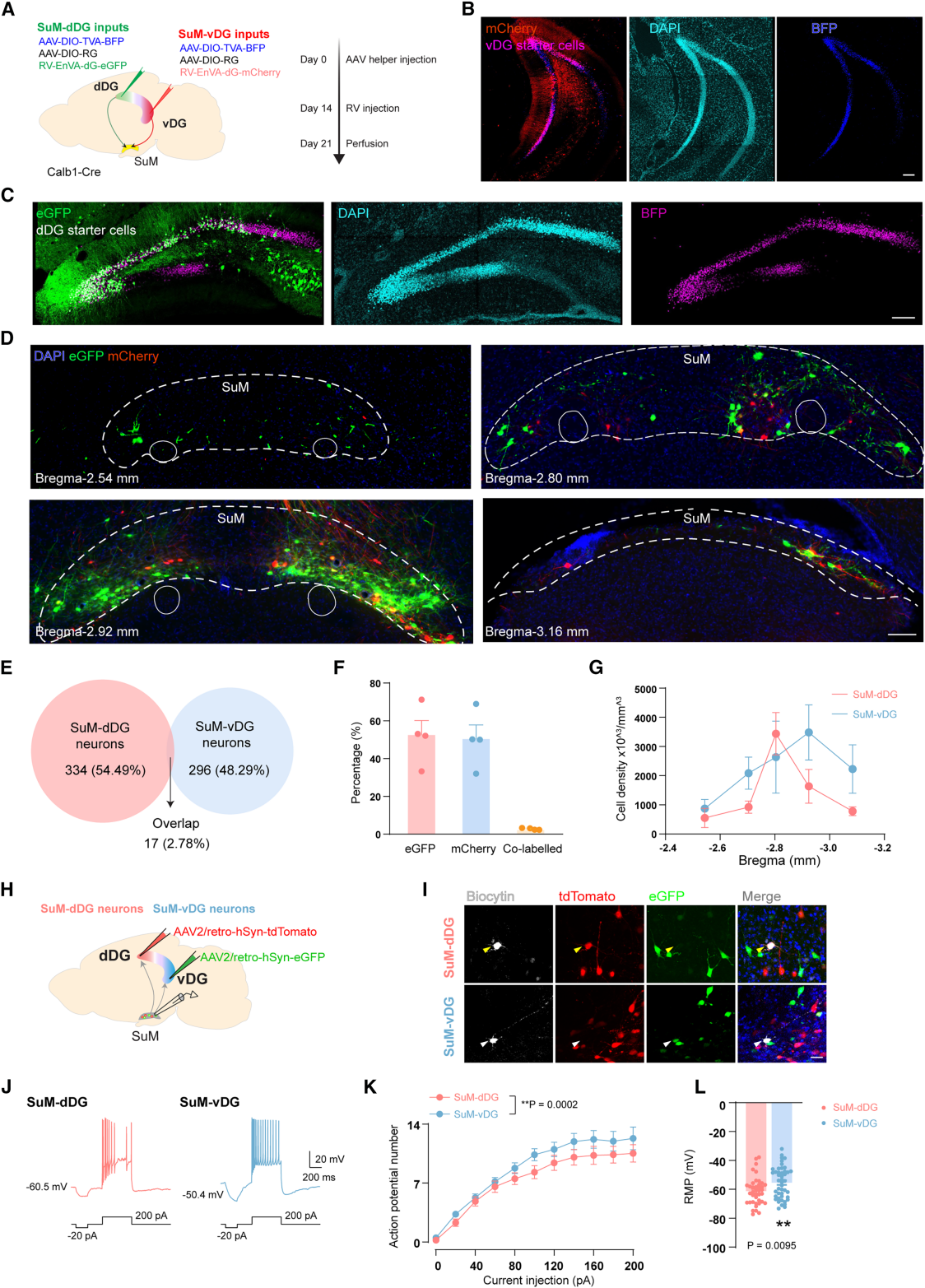
图1 SuM-dDG和SuM-vDG神经元在解剖学上是分离的并表现出不同的电生理特性
为了探究SuM-dDG与SuM-vDG神经元的分子差异,作者开展单核RNA测序(snRNA-seq)与膜片钳测序(Patch-seq),向小鼠dDG/vDG注射AAV2-retro-eGFP后,解剖SuM并通过10×Genomics平台进行snRNA-seq(图2A),捕获19106个细胞核转录组,经无监督聚类鉴定出7类主要细胞。聚焦神经元,按转录谱将其分为12个亚群(图2B-C),部分亚群表达SuM富集标记基因。因SuM体积小且邻近其他核团,将神经元聚类映射到高分辨率下丘脑图谱以区分核心群体,SuM-vDG小鼠的4个eGFP标记细胞均映射至SuM核心聚类C1(图2D)。通过Seurat工具(应用于scRNA-seq/snRNA-seq数据分析)映射到10×参考数据集,85.7% SuM-dDG神经元归为C4,83.3% SuM-vDG神经元归为C1(图2E-F)。差异表达分析鉴定出326个显著富集基因(图2I)。基因集富集显示SuM-vDG神经元富集内在兴奋性及膜电位调控相关通路(图2G):SuM-dDG高表达抑制兴奋性的基因Cnr1,SuM-vDG高表达促去极化的Scn2a等(图2H),与电生理观察(SuM-vDG兴奋性高、RMP更去极化,图1J-1L)一致。GO分析证实两群体功能差异(图2J):SuM-dDG表达学习记忆相关基因(如Trim67、Cnr1),SuM-vDG表达焦虑抑郁相关基因(如Tac1,图2K)。综上,SuM-dDG与SuM-vDG神经元具有独特分子特征。
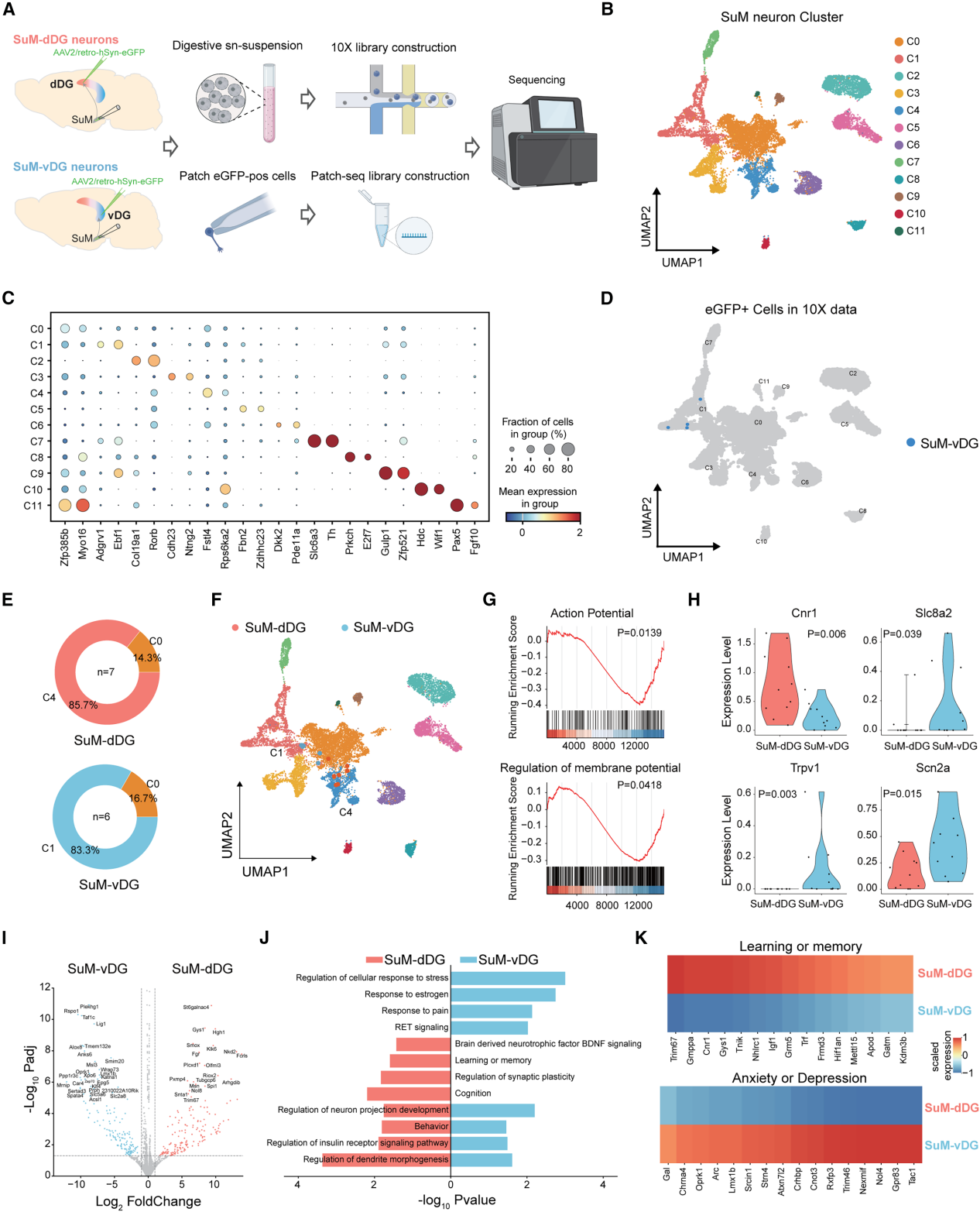
图2 SuM-dDG和SuM-vDG神经元表现出不同的分子特征
接下来,作者研究了两个SuM亚群的输入与输出连接。绘制单突触输入图谱时,将AAV2-retro-Cre注射到dDG或vDG,同时向SuM注射编码TVA和狂犬病病毒糖蛋白的Cre依赖型辅助病毒,再注射EnvA假型RV(图3A)。结果显示,SuM-dDG接收外侧下丘脑(LH)输入更多,SuM-vDG优先接受后下丘脑(PH)支配(图3B、3C)。绘制输出连接图谱时,向dDG或vDG递送AAV2-retro-Cre,向SuM注射表达膜靶向GFP和突触定位mRuby的Cre依赖型AAV-FLEX-mGFP-T2A-Synaptophysin-mRuby(图3D)。该系统中,绿色标轴突、红色标突触前末梢,仅定量重叠(黄色)信号以减少假阳性。定量全脑分支模式发现,两亚群主要靶向对应DG区域(图3E-F),SuM-dDG与dDG突触连接远多于vDG,SuM-vDG优先靶向vDG;二者均投射至海马CA1/2/3,但突触数少;向海马外区域(如MS、HDB)投射无显著差异,提示存在投射偏好性。综上,通过单核RNA测序、膜片钳测序、狂犬病病毒示踪及投射图谱绘制等方法,证实SuM-dDG与SuM-vDG是分子和功能上截然不同的亚群,在电生理特性、基因表达及输入/输出连接模式上均有差异。

图3 SuM-dDG和SuM-vDG神经元表现出不同的输入和输出连接
为了探究SuM-dDG与SuM-vDG神经元是否分别参与认知、情感功能,作者用光纤钙成像技术,在海马依赖行为(空间记忆的新颖位置识别实验NPR实验、抑郁评估的悬尾实验TST实验)中,记录表达GCaMP6f的两SuM亚群群体钙活动(图4A)。NPR实验中,SuM-dDG神经元在记忆提取阶段活动较编码阶段显著增强(图4B-4I、4M);TST实验中,从静止转活动时,SuM-vDG神经元活动显著增强(图4J-4L、4N)。结果表明,SuM-dDG与SuM-vDG神经元分别差异性参与认知、情感功能调控。
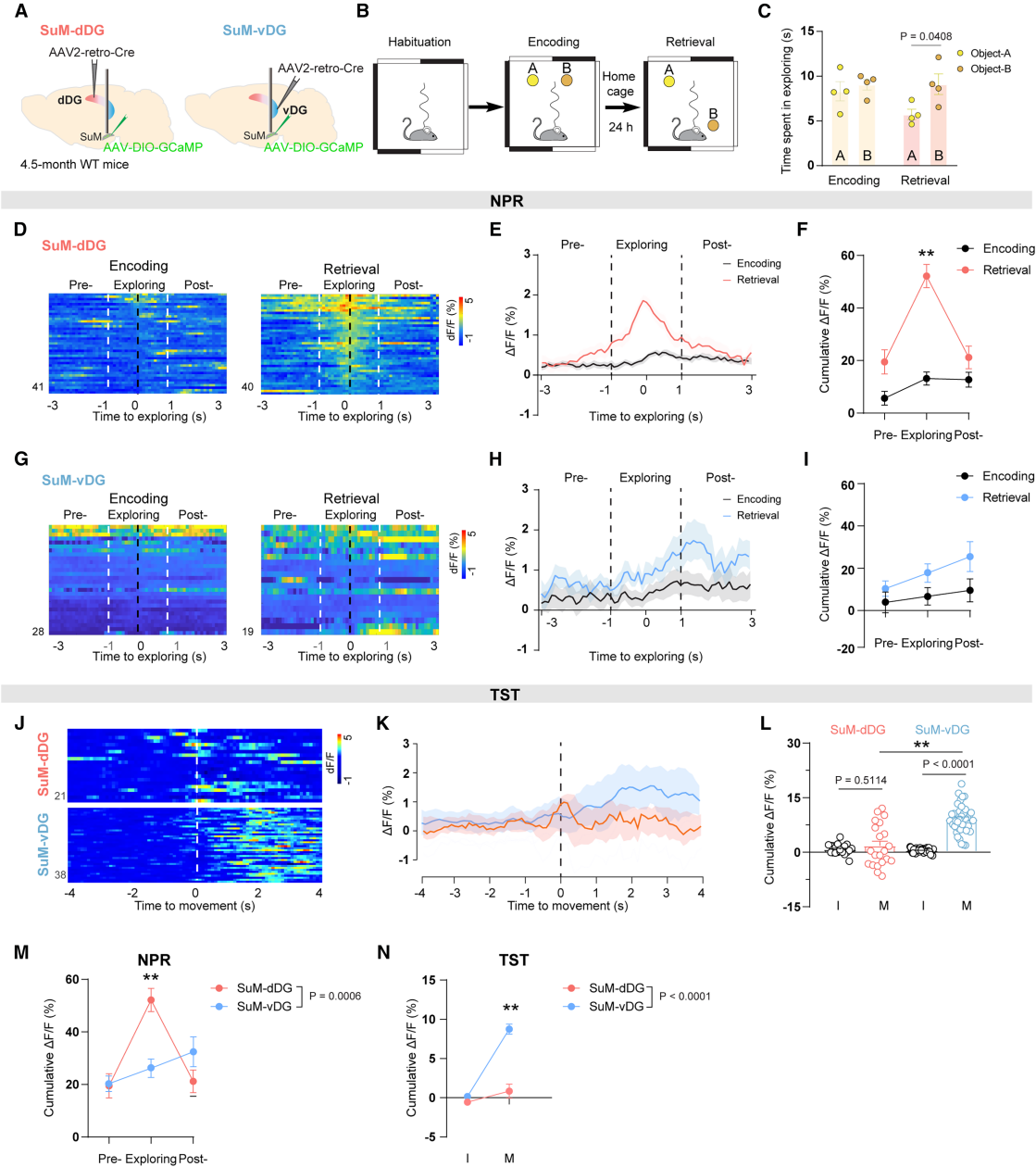
图4 SuM亚群在认知和情感功能中具有不同的差异
明确SuM亚群对认知、情感功能的独特作用后,作者通过化学遗传学方法选择性抑制SuM-dDG/SuM-vDG神经元(图5A、5D),并以c-Fos标记验证抑制效果(图5B、5C、5E、5F)。抑制SuM-dDG后,小鼠NPR实验辨别率降低(图5G、5H)、CFC实验情境A冻结时间缩短(图5I-J),且运动能力未受影响(图5L),提示记忆受损。抑制SuM-vDG后,小鼠旷场中央停留时间减少(图5K-5M)、高架零迷宫开放臂停留时间减少(图5N、5O)、TST不动时间增加(图5P),提示焦虑/抑郁样行为加剧。结果表明,SuM-dDG活动是认知功能必需,SuM-vDG活动是情感功能必需,二者具有选择性。

图5 不同的SuM亚群被选择性地用于认知和情感行为
为了探究两类SuM神经元活动是否足以调控认知与情感功能,作者通过光遗传学激活其投射通路,向SuM递送表达CaMKII-ChR2-YFP的AAV,在dDG/vDG上方植入光纤,激活通路后进行行为学测试(图6A-B)。认知行为测试中,记忆提取阶段激活SuM-dDG通路,小鼠NPR实验辨别率升高(图6C),CFC实验中24小时、7天情境A冻结时间延长(情境B无变化,图6D-6F)。情感行为测试中,激活SuM-vDG通路,小鼠高架零迷宫开放臂停留时间增加(图6I),TST、FST不动时间减少(图6J-K),SPT蔗糖偏好百分比升高(图6L),提示焦虑/抑郁样行为及快感缺乏缓解。此外,激活两通路均未改变小鼠运动能力及旷场中央停留时间(图6G-H)。综上,SuM-dDG与SuM-vDG通路分别选择性调控认知与情感功能。
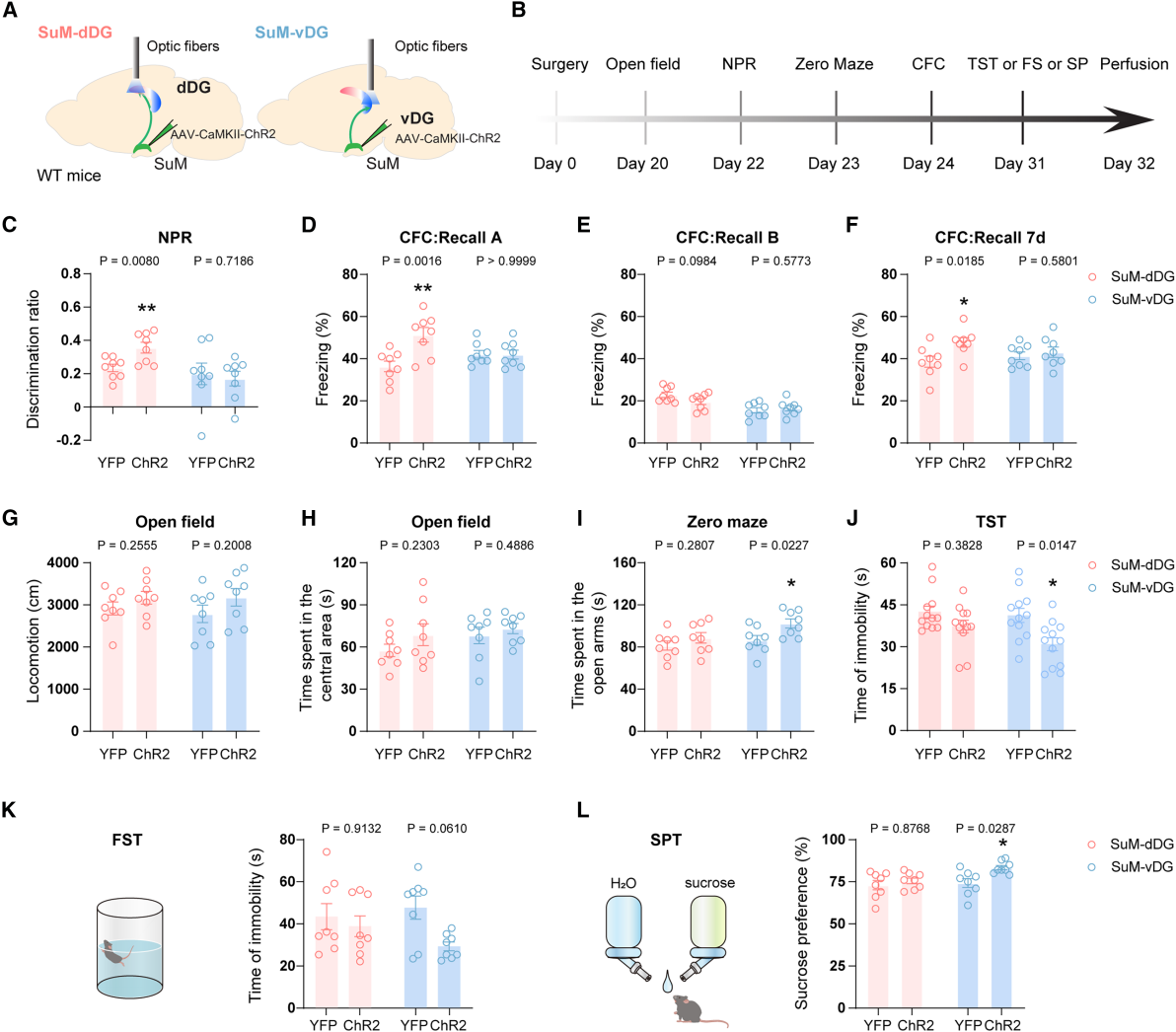
图6 SuM-dDG或SuM-vDG投射的光遗传学激活选择性地调节记忆和情感行为
为了评估在体活动,作者用光纤钙成像记录SuM-dDG与SuM-vDG神经元的钙动力学。基线条件下(饲养笼内),5×FAD(AD模型)小鼠两类神经元钙活动均显著低于WT小鼠(图7A-7J)。进一步探究AD小鼠认知/情感任务中神经元的行为特异性异常,在NPR(图7A)与TST(图7B)中监测钙活动:NPR提取阶段,AD小鼠SuM-dDG活动显著低于WT(图7K-7M),SuM-vDG无变化(图7N-7P);TST中,AD小鼠SuM-vDG在“静止→活动”转换时活动增强减弱(与抑郁样行为相关,图7Q-7S),SuM-dDG无异常(图7T-7V)。综上,AD模型小鼠中SuM-dDG与SuM-vDG存在内在特性异常及基线活动降低,且行为相关活动表现出独特异常模式。
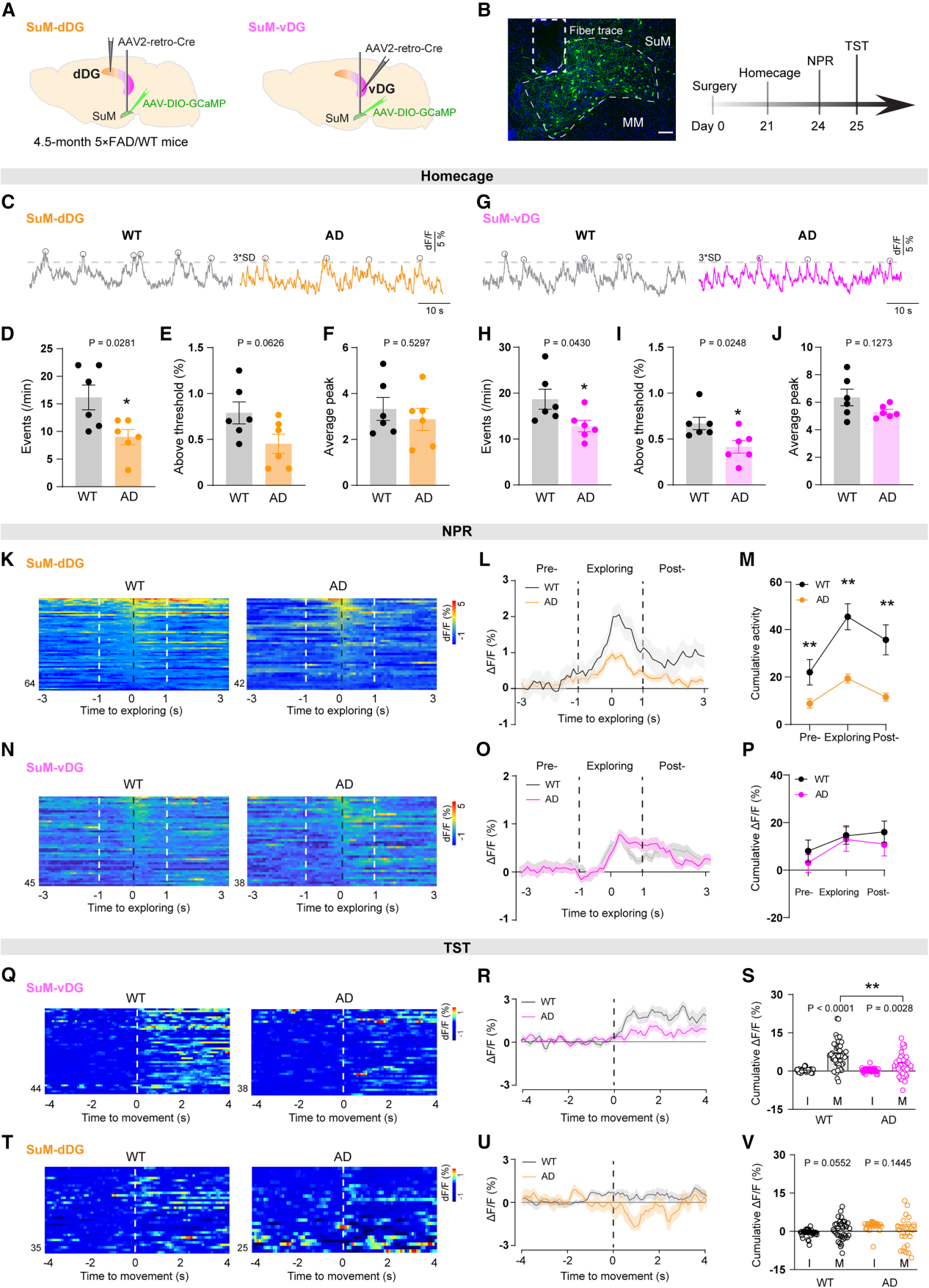
图7 AD小鼠中DG投射SuM神经元表现出异常活性
因AD模型小鼠SuM-DG神经元基线及行为诱导性活动低,作者采用与WT小鼠相似的光遗传学策略,在其行为学测试时激活SuM-dDG/SuM-vDG通路(图8A-B),探索缺陷改善作用。激活SuM-dDG通路(记忆提取阶段),AD小鼠NPR实验辨别率升高(图8C),CFC实验情境A(非情境B)冻结时间恢复至WT水平(图8D-8F),记忆改善;且不影响旷场、高架零迷宫、TST、FST及SPT表现(图8G-8L),提示其选择性改善记忆缺陷。激活SuM-vDG通路,AD小鼠高架零迷宫开放臂停留时间增加(图8I),TST/FST不动时间减少,SPT蔗糖偏好度恢复至WT水平(图8J-8L),焦虑/抑郁样行为缓解;且不影响记忆表现(图8C-8F)及旷场运动与中央停留时间(图8G-H),提示其选择性改善情感缺陷。综上,激活SuM-dDG与SuM-vDG通路可分别选择性改善AD模型小鼠的认知与情感缺陷。
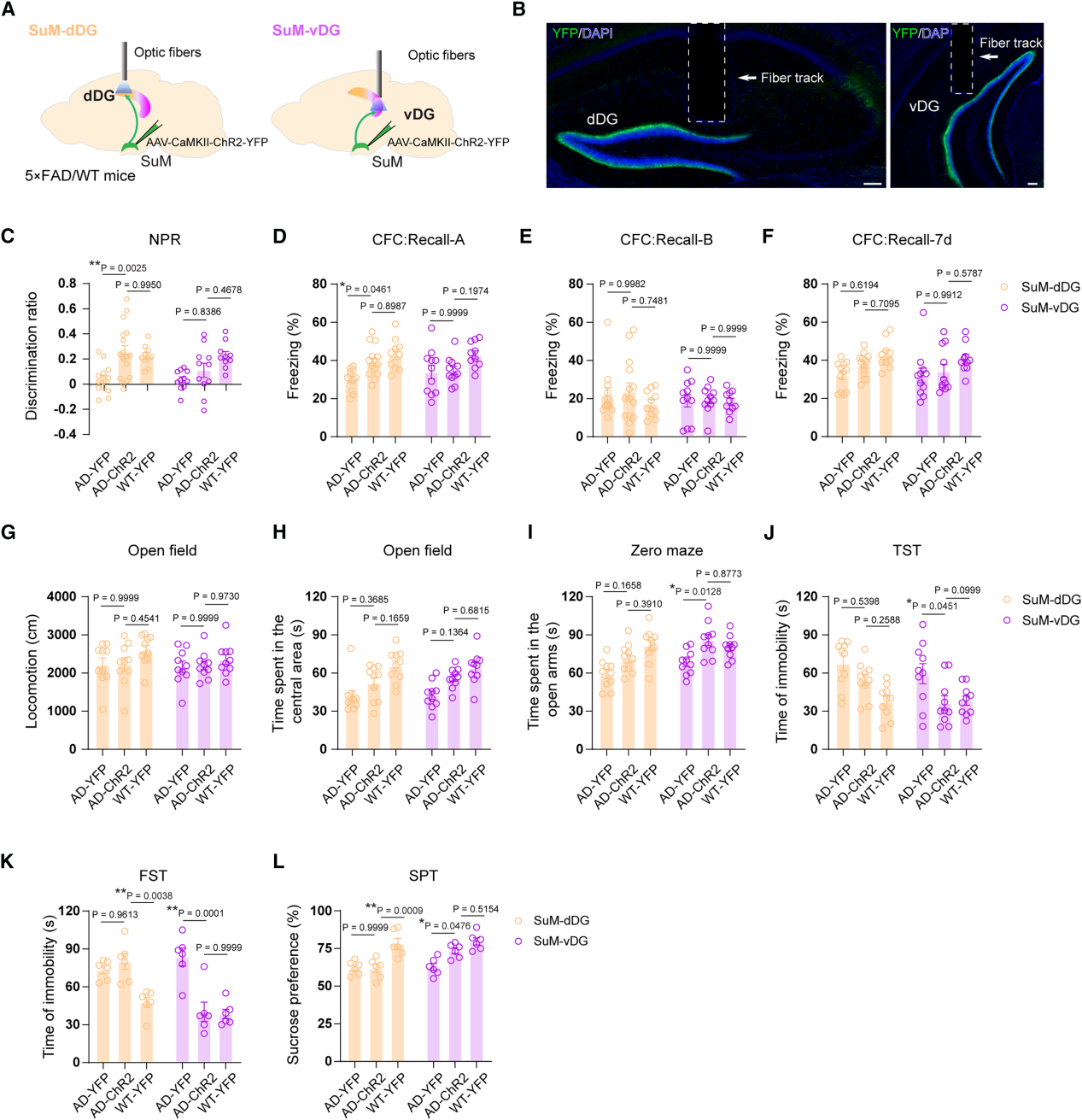
图8 光遗传学激活SuM-dDG/vDG通路选择性地挽救AD小鼠的认知和情感缺陷
总 结
本文首次证明SuM-DG亚环路平行调控认知与情感,揭示AD多症状的环路机制,打破“单一通路调控多症状” 的传统认知。SuM因无AD病理沉积,成为理想治疗靶点,可通过靶向激活SuM-dDG/SuM-vDG,分别改善AD患者的认知或情感缺陷。
本文使用的工具病毒由布林凯斯提供如下:
同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。