动物从非母性向母性状态的转变是重要生物学变化,会出现哺育、保护等保障后代存活的行为。以往研究多聚焦无威胁环境下的母性照料,对威胁中母性防御行为的关注不足,即母体冒自身风险保护后代的核心母性行为。母性防御可能依赖威胁下激活某一独特脑回路,实现 “自我保存→后代保护” 的回路转换,但其核心神经元群体、脑区间通讯模式及行为选择机制尚未阐明。
2025年8月18日,南方医科大学梁妃学团队在Nature Communications上发表了题为“Experience-dependent maternal defense behavior mediated by profrontal cortical projections to the medial preoptic area in mice”的研究性论文。该研究采用独特的“威胁下幼崽取回(PRUT)”行为范式,系统探究调控母性防御行为的神经通路,揭示了内侧前额叶皮层(mPFC)第六层(L6)中表达D1多巴胺受体的神经元及其向内侧视前区(MPOA)的神经投射,是介导“母性防御优先于自我保护”决策的核心环节。

研究建立了“威胁下幼崽取回(PRUT)”的行为范式以测试母鼠在威胁下对幼崽的反应。将母鼠置于矩形区域中,适应后在N端筑巢;幼崽/玩具幼崽放于远离巢穴T端。母鼠越过场中线时会受到听觉威胁刺激(宽带噪音,持续5秒,声压级70分贝)。有幼崽时,93.9%母鼠冲去带幼崽回巢,仅6%独自回巢;无幼崽时,93.6%母鼠直接回巢(图1a-b)。二者逃跑峰值速度相近但有幼崽时母鼠朝向幼崽且回巢前移动距离更远(图1c-i),而无母性经验的处女鼠即便有幼崽,96.8%仍独自逃跑,与无幼崽时行为一致。这表明母性防御行为是母鼠特有的、依赖母性状态的决策模式。
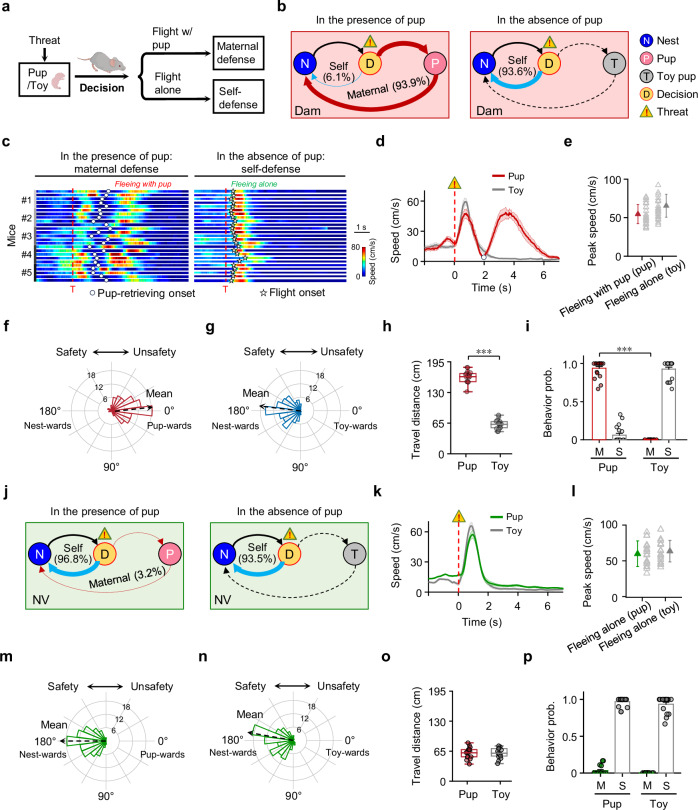
图1 母鼠与无母性经验的处女鼠在威胁条件下的母性防御行为
已知mPFC参与风险决策,通过c-Fos染色发现经历“威胁下幼崽取回(PRUT)”的母鼠,其mPFC(前边缘区PrL、下边缘区IL)神经元激活率显著高于无幼崽情境的母鼠(图2a-b)。用迷你显微镜记录母鼠mPFC钙信号,将事件相关神经元分为两类,趋近相关细胞占35.6%,母鼠接近幼崽时活性升高,威胁呈现后持续升高,开始取回幼崽后下降,无幼崽时,威胁后活性不升反降;取回相关细胞占21.2%,仅在幼崽取回开始时活性升高,无幼崽时无活性变化(图2c-m)。无母性经验的处女鼠mPFC神经元多数未表现出事件相关激活,仅少数细胞在小鼠走出巢穴后出现活性升高(图2n-r)。这些数据表明,趋近相关细胞可能在“母性防御优先于自我保护”的决策中发挥作用。
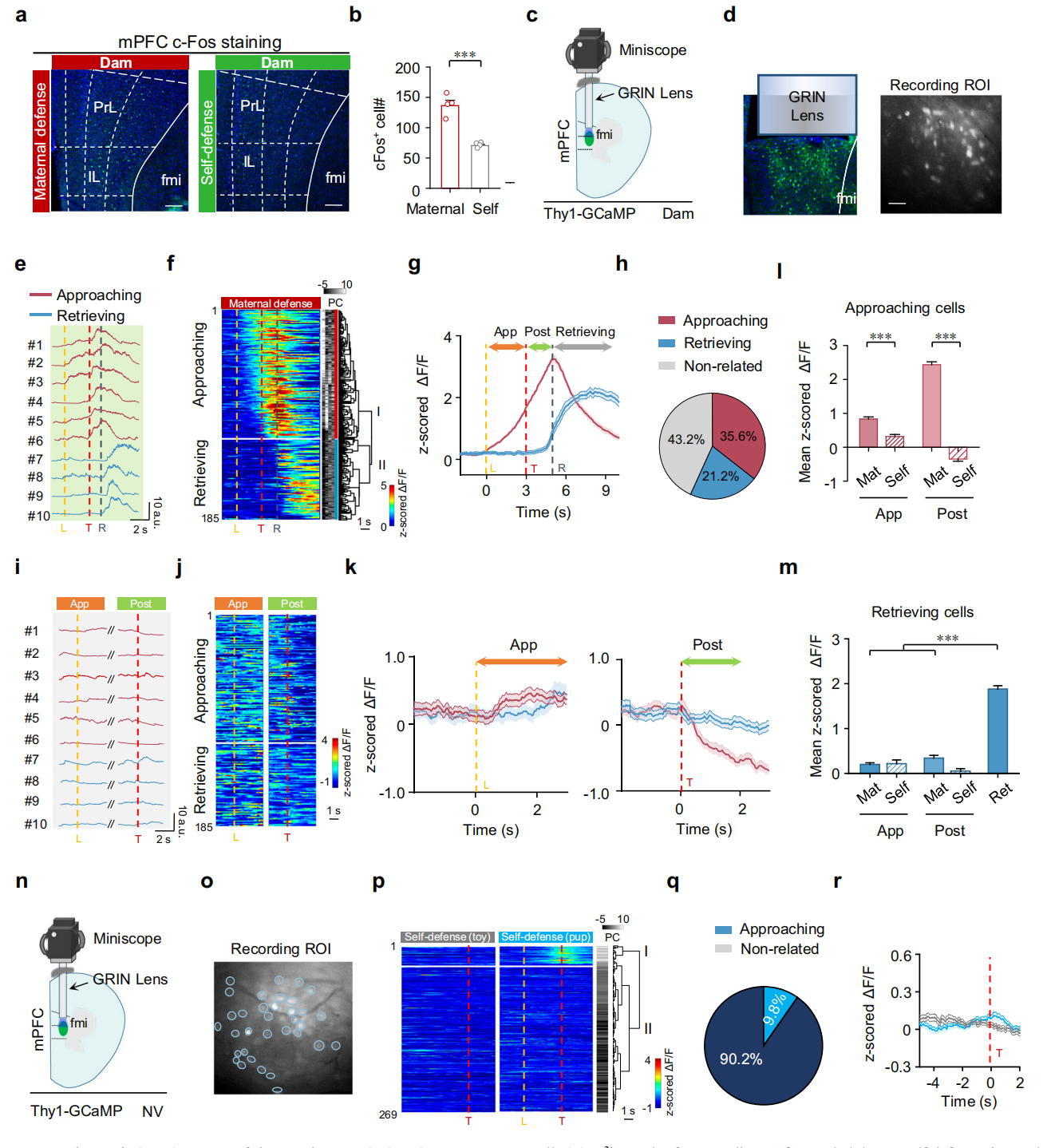
图2 母鼠和无母性经验处女鼠mPFC的神经元群
通过与母鼠及幼崽共居增强处女鼠(EV)的母性经验,发现其取回幼崽概率显著高于无经验处女鼠(NV);无幼崽时,EV与NV、母鼠(Dam)均以独自逃跑为主(图3a-c)。用“母性-自我选择指数(MSSI)”衡量:母鼠MSSI近1(倾向母性防御)、NV近-1(倾向自我保护),EV则介于两者间,表明共居经验推动其行为向母性防御转变,但未完全成熟(图3d)。这一结果支持“母性防御选择随母性经验的积累而产生”的观点。用迷你显微镜记录mPFC钙信号发现,母性防御测试中,趋近相关细胞活性高于自我保护测试,尤其威胁呈现后;基于该细胞群体活性构建支持向量机(SVM)二元解码器,对“母性防御vs自我保护”的预测准确率显著高于对照解码器,用均方根误差(RMSE)验证也显示模型有效(图3k-m)。威胁呈现后,母性防御试次中该细胞活性进一步升高,自我保护试次中则下降(可通过群体平均波形斜率体现);且通过威胁前后的斜率,能准确预测行为选择(图3n-p)。这些结果表明mPFC中趋近相关细胞对“母性防御vs自我保护”的决策起重要作用。
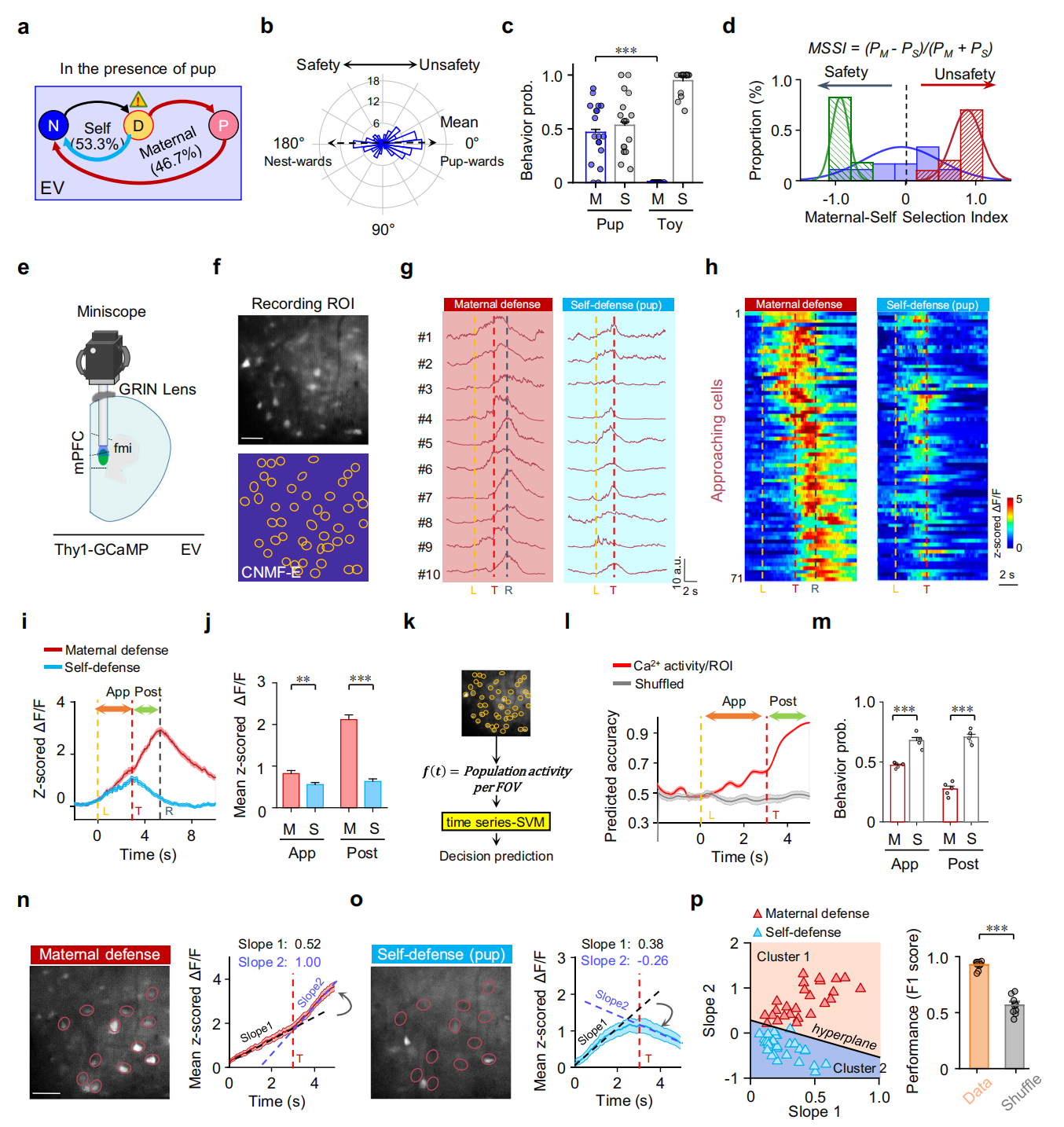
图3 有母性经验处女在行为决策过程中mPFC神经元的活动动力学
已知下丘脑内侧视前区(MPOA)是介导母性行为的关键脑区,为探究mPFC是否通过向MPOA投射驱动母性防御行为。研究向mPFC注射AAV-CaMKIIα-EYFP病毒,在MPOA观察到大量mPFC兴奋性轴突,证实该投射通路存在(图4a-b)。在mPFC兴奋性神经元表达ChR2,对MPOA中与母性行为相关的Esr1⁺神经元做脑片膜片钳记录(图4c),加入TTX和4AP后,观察到Esr1⁺神经元出现光诱发的兴奋性突触后电流,证实其可直接接收mPFC兴奋性突触输入(图4d-e)。
对有母性经验的处女鼠(EV)、母鼠(Dam)和无经验处女鼠(NV)的MPOA进行光纤光度记录(图4f-g),发现mPFC→MPOA轴突群体钙活性与行为选择相关。EV在威胁呈现后,母性防御测试中该活性持续升高、自我保护测试中下降(图4h-j);母鼠有类似差异,且其自我保护测试在威胁前活性也未升高(图4k-o);NV无论有无幼崽,该投射激活都微乎其微(图4p-t),与行为一致。
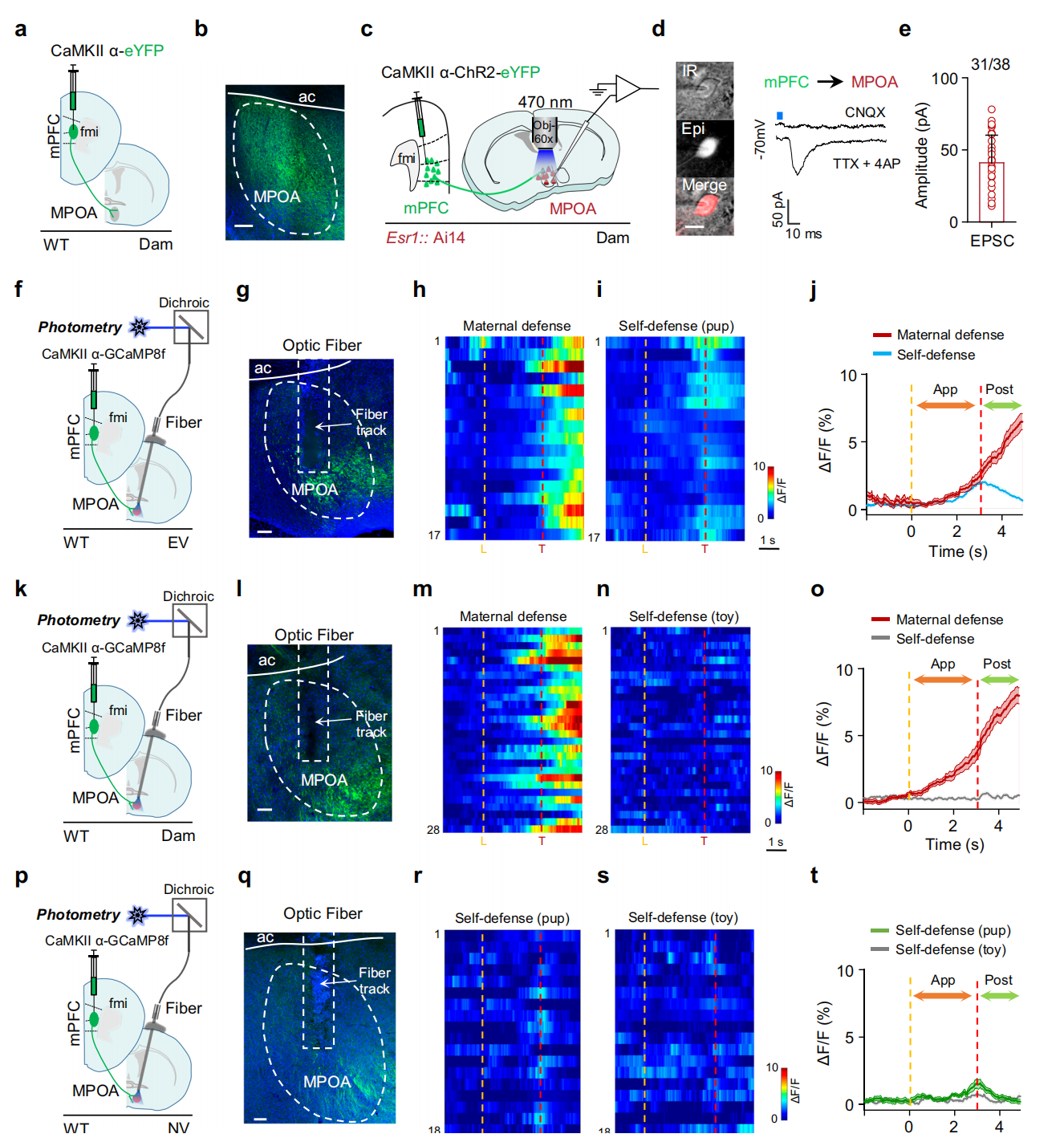
图4 mPFC-MPOA投射与行为选择相关
研究进一步在mPFC表达hM4Di或hM3Dq,向MPOA注射CNO调控mPFC→MPOA投射活性(图5a-b)。脑片全细胞记录证实CNO能有效抑制hM4Di阳性mPFC神经元放电(图5c-d)。对比对照组,抑制母鼠该投射会显著降低其母性防御行为概率及MSSI(图5e-h);而激活有经验处女鼠(EV)(图5i-l)和无经验处女鼠(NV)(图5m-p)的该投射,均能显著提高二者母性防御行为概率及MSSI。这些数据表明mPFC→MPOA的直接兴奋性通路可促进母性防御决策。

图5 mPFC到MPOA的投射激发了行为选择
通过CTB逆行示踪发现投射至MPOA的mPFC神经元主要分布在第五层(L5)和第六层(L6)(图6a-b);再向MPOA共注射AAV11-EYFP和AAVretro-mCherry病毒,发现AAVretro和AAV11病毒可分别特异性标记皮层L5和L6的投射神经元(图6c-f)。随后结合钙病毒与迷你显微镜记录母鼠L5、L6投射神经元钙反应(图6g-h)均观察到类似趋近相关细胞和取回相关细胞的反应(图6i),但比例不同(L6趋近细胞占主导,比例4.58;L5取回细胞占主导,比例3.90)。对ΔF/F信号的群体平均分析显示投射至MPOA的L6和L5神经元群体的活性动态,分别与定义的趋近相关细胞和取回相关细胞一致,L6群体在幼崽取回前持续升高,L5群体仅在取回后强烈反应(图6k)。
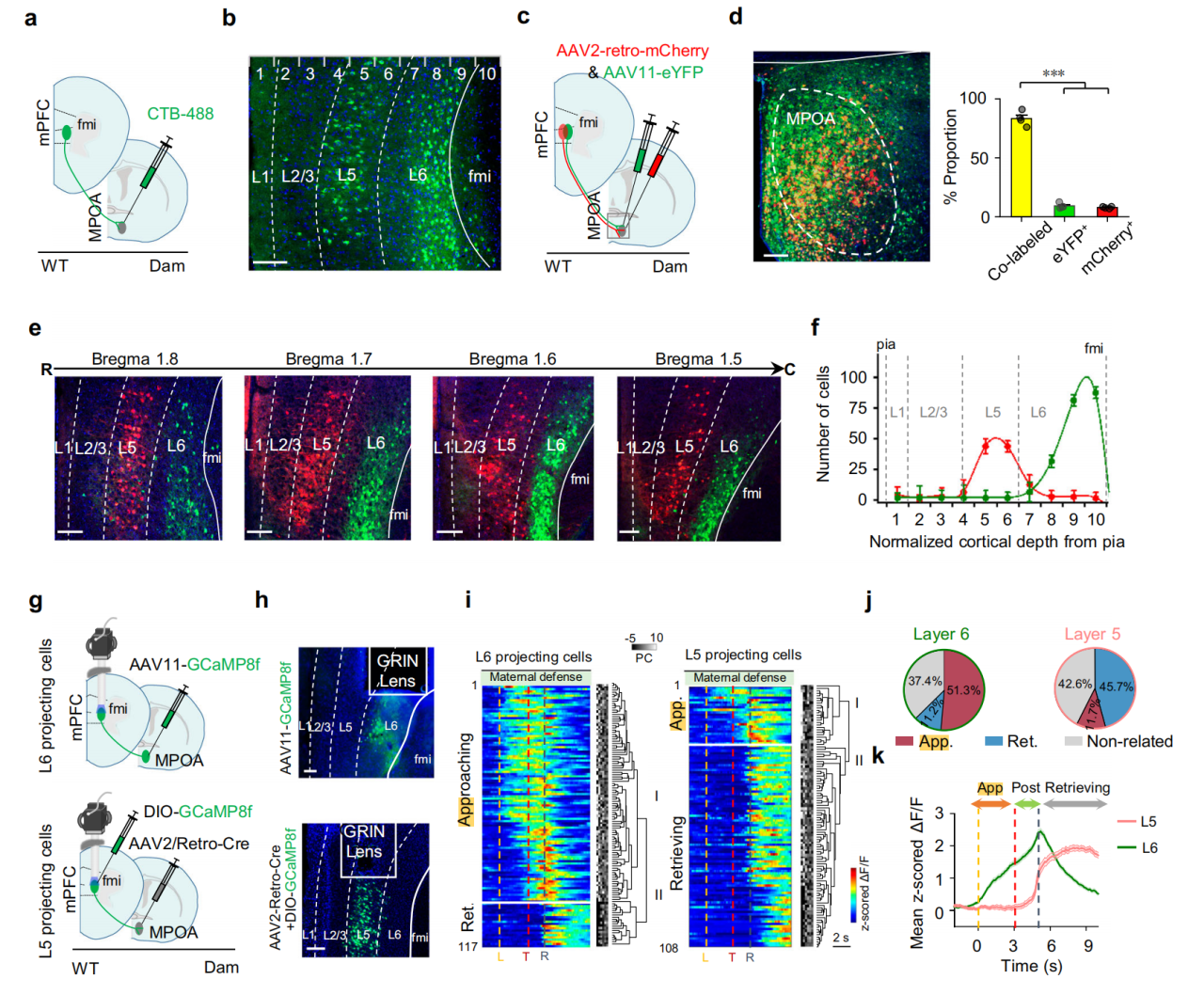
图6 mPFC投射至MPOA的神经元具有层特异性功能
为探究投射至MPOA的mPFC L6和L5神经元在不同行为时期的调控作用,采用病毒策略在二者中分别特异性表达抑制性视蛋白GtACR(图7a-b),且经脑片全细胞记录证实,蓝光可有效抑制表达GtACR的mPFC神经元放电活性(图7c-d)。母鼠的实验显示,威胁后接近幼崽时,抑制投射至MPOA的mPFC L6神经元,会显著降低母性防御行为概率及MSSI;抑制L5神经元则无此效应(图7e-i)。携带幼崽后,抑制L6无影响,抑制L5会导致母鼠途中掉落幼崽(图7j-n)。此外,威胁后激活EV小鼠MPOA中L6神经元轴突末梢,其母性防御概率和幼崽取回率均升高(图7o-s)。综上,威胁存在时,投射至MPOA的mPFC L6神经元激活,对母鼠选择母性防御行为既是必要的也是充分的,而L5可能参与有效抓握幼崽。
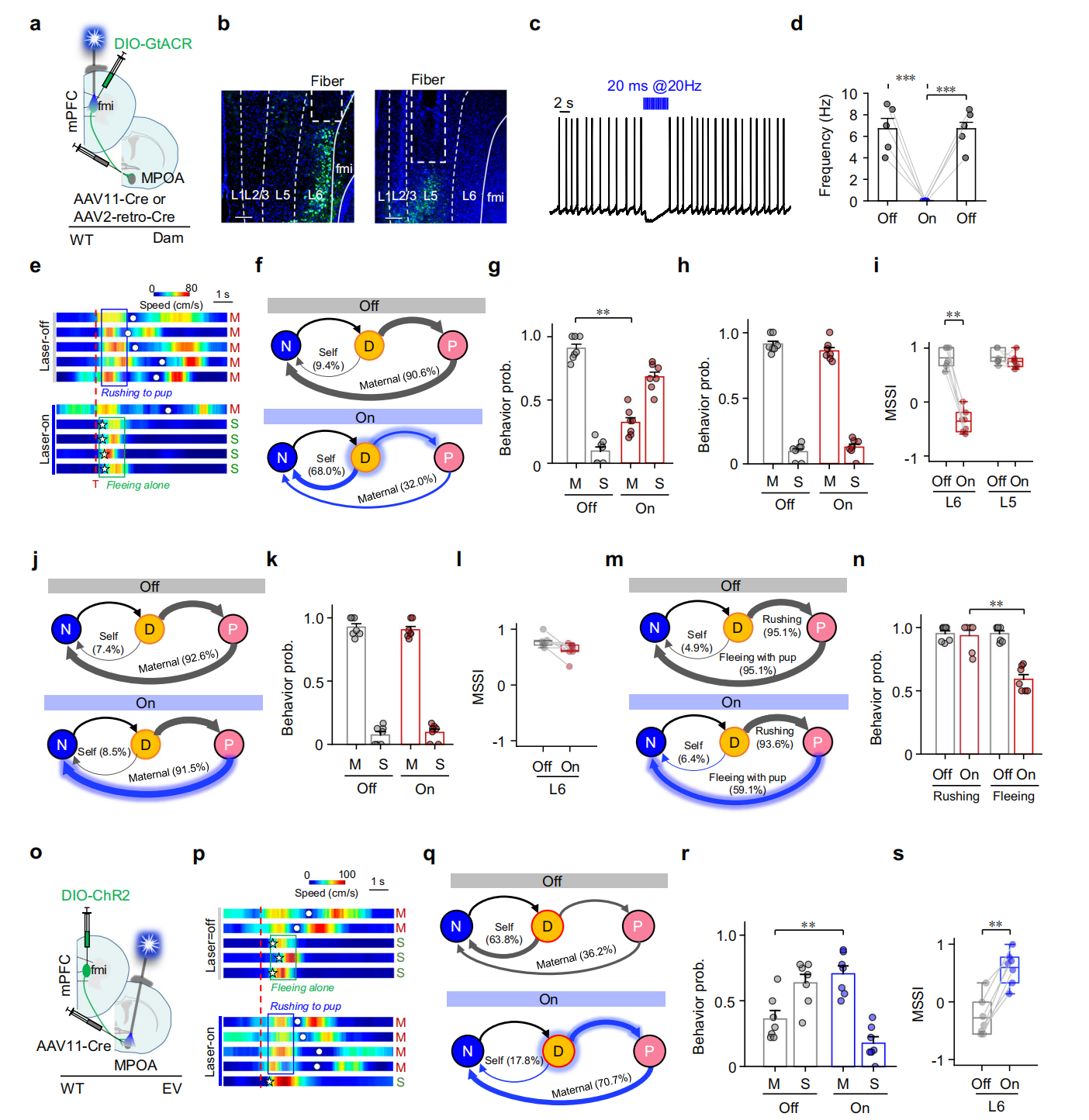
图7 投射到MPOA的mPFC L6神经元调节母体的行为选择
已知多巴胺(DA)通路影响动机行为及母鼠对后代的反应,为探究投射至MPOA的mPFC L6神经元是否受DA调控,研究向Drd1-Cre::Ai14小鼠MPOA注射逆行示踪剂CTB-488(图8a),发现投射至MPOA的mPFC L6神经元约90%与D1受体共标(图8b-d),L5中这类共标神经元极少(图8c),且多数表达D1的神经元也会投射至MPOA(图8d)。综上,介导母性防御决策的mPFC神经元可能主要是D1神经元,建立了DA通路与母性防御行为的关联。
为验证“雌性小鼠从非母性(NV)→有母性经验(EV)→母鼠状态转变中,母性防御行为增强可能源于投射至MPOA的mPFC L6神经元活性升高”的推测,研究追踪同一小鼠三种状态下该神经元钙活性(图8e),结果显示随状态递进,小鼠母性防御行为概率逐渐升高(独自逃跑反应稳定)(图8f-g),且该神经元数量稳定(图8h-j),但趋近相关细胞的数量和活性显著递增(图8k-m)。通过观察相似年龄跨度内维持NV/EV状态的小鼠,发现趋近相关细胞的数量和活性水平均无显著变化(图8n-q)。这些结果证实投射至MPOA的mPFC L6神经元的母性状态依赖性激活,在调控母性防御行为中起关键作用。

图8投射至MPOA的mPFC L6 D1神经元母体状态依赖性激活
为探究mPFC→MPOA投射是否普遍促进母性行为,研究在母鼠或EV小鼠的投射至MPOA的L6神经元中分别特异性表达GtACR或ChR2,无威胁情况下,测试其幼崽取回行为(小鼠越过中线“M”时施加激光刺激),结果显示母鼠中抑制该神经元会降低幼崽取回概率(图9a-c),EV小鼠中激活该神经元会提高取回概率(图9d-f),表明该投射普遍促进母性行为且不依赖威胁。通过向D1-Cre小鼠MPOA注射AAV11-DIO-GCaMP8s探究PRUT测试中D1神经元活性动态(图9g),发现母鼠中48.9%的D1神经元为趋近相关细胞、13.0%为取回相关细胞,趋近相关细胞在威胁与无威胁条件下接近幼崽时均会活性升高(图9i-j),且威胁会通过改变钙波形斜率进一步增强其活性(图9k)。这表明威胁可增强趋近相关细胞激活以促进母性防御动机。
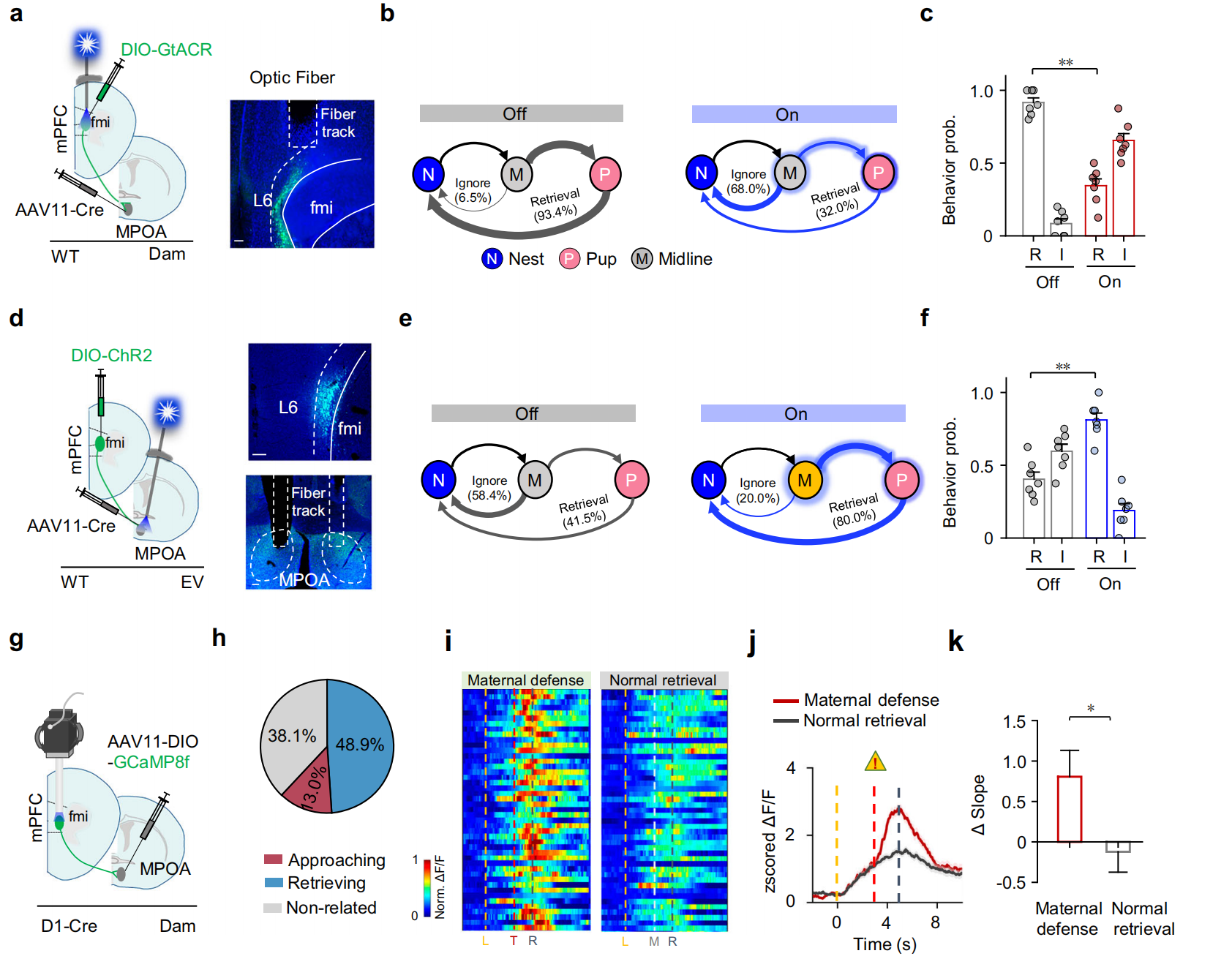
图9 投射至MPOA的mPFC L6神经元在母性抚育行为中的功能作用和威胁相关激活
mPFC L6中表达D1多巴胺受体的神经元及其向MPOA的投射是“母性防御优先于自我保护”决策的关键通路,可双向调控母性防御行为。此通路不仅调控威胁下的母性防御,还促进无威胁时的基础母性照料,是母性行为的核心调控单元,本文首次明确母性防御的“层-受体特异性”机制,填补此前研究空白,为解析孕期/产后母性行为异常提供关键靶点。
本文使用的工具病毒布林凯斯均可提供:
同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。