阿片类药物是临床治疗中重度疼痛的常用镇痛药,但μ-阿片受体(MOR)因在神经系统中广泛表达,会导致呼吸抑制、成瘾、便秘等副作用,瘙痒是另一常见副作用,硬膜外或鞘内给药时发生率为30-100%。MOR拮抗剂(如纳洛酮、纳曲酮等)可缓解皮炎、胆汁淤积性肝病等相关慢性瘙痒,但MOR信号在瘙痒传递中的具体机制尚未完全明确。神经肽Y(NPY)阳性抑制性中间神经元不仅调节机械性瘙痒,也调节化学性瘙痒。
2025年8月1日,南方科技大学王子龙团队在Nature Communications上发表题为“Neuropeptide Y neurons mediate opioid-induced itch by disinhibiting GRP-GRPR microcircuits in the spinal cord”相关文章,该研究揭示了脊髓背角中表达神经肽Y(NPY)的抑制性中间神经元上的μ-阿片受体(MOR)在介导阿片类药物诱导的瘙痒中起关键作用。

研究表明抑制性神经元上的MOR通过去抑制作用介导吗啡诱导的瘙痒。经RNAscope原位杂交检测,脊髓背角(SDH)中38.27%的Oprm1⁺(MOR基因名)中间神经元表达Npy,29.96%的NPY⁺中间神经元表达Oprm1(图1A-B),说明抑制性中间神经元的Oprm1在SDH的NPY⁺中间神经元中显著表达。化学遗传学激活脊髓NPY⁺中间神经元(鞘内注射CNO)后,NpyCre;hM3Dq小鼠的鞘内注射吗啡诱导瘙痒反应及啃咬舔舐行为均消失(图1C),表明NPY⁺中间神经元参与该过程。构建Oprm1条件性敲除小鼠(NpyCre;Oprm1fl/fl),该小鼠接受不同剂量吗啡后,搔抓及啃咬舔舐行为完全消失(图1D)。用内吗啡肽-1(EM-1,一种MOR选择性内源性配体))来评估NPY⁺中间神经元上的MOR是否介导内源性阿片诱导的瘙痒,野生型小鼠中EM-1引发剂量依赖性短期搔抓(图1E),而NPY⁺中间神经元Oprm1敲除小鼠的EM-1诱导瘙痒消失(图1F,),说明NPY⁺中间神经元上的MOR介导内、外源性MOR激动剂诱发的瘙痒。
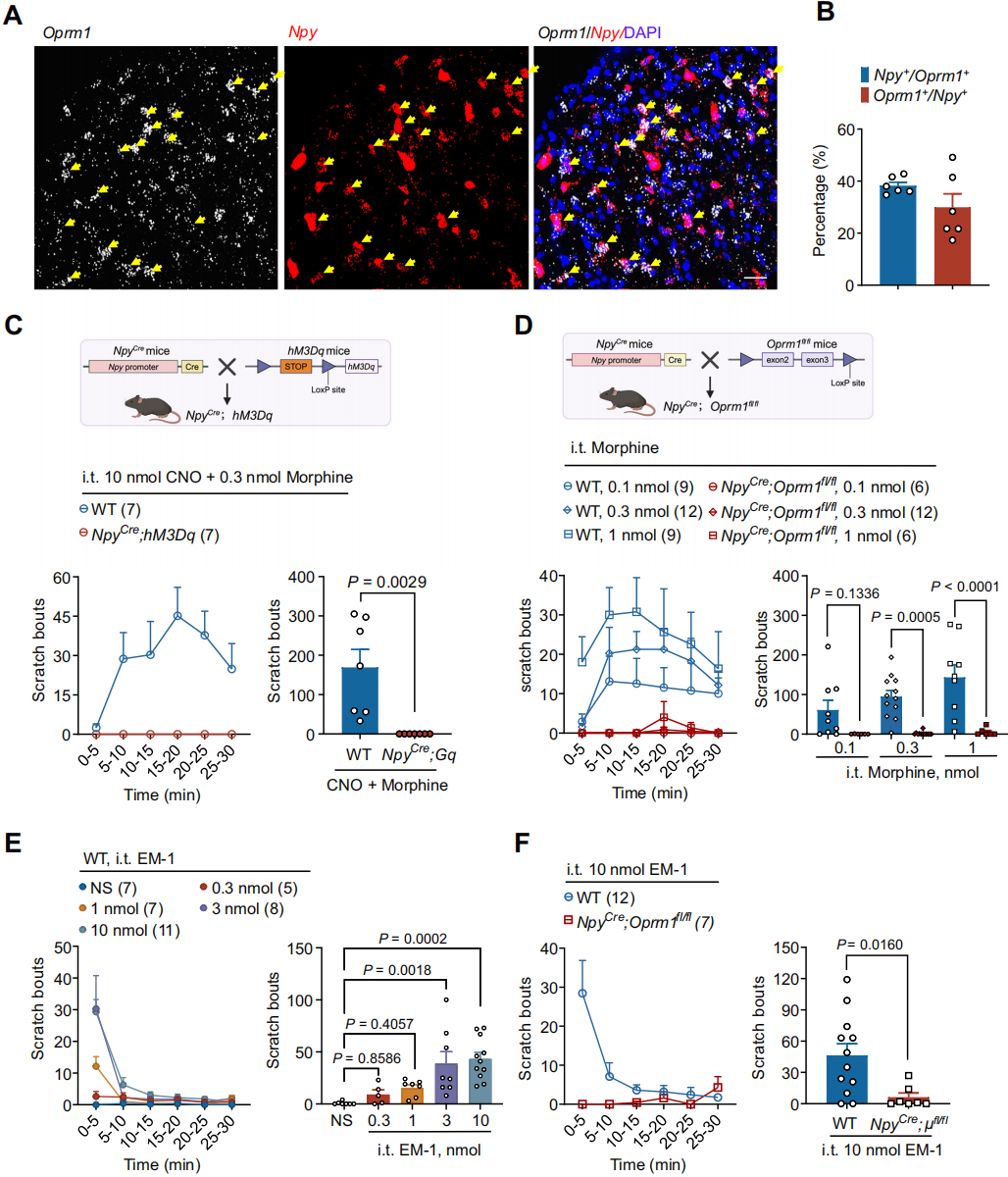
图1 阿片类药物诱导的瘙痒是由NPY⁺中间神经元上的MOR介导的
用NpyCre;Ai9 tdTomato报告小鼠来标记NPY⁺中间神经元,离体电生理记录显示,10μM吗啡在17/34个SDH Ⅰ-Ⅱ层NPY⁺中间神经元中诱发外向电流(指正电荷从细胞内流向细胞外的离子流动,其核心意义在于降低神经元的兴奋性)(图2A-B),抑制9/22个SDH Ⅱ层NPY⁺中间神经元的动作电位,增加其基强度(诱发动作电位所需的最小电流)(图2C-F)。相比之下,溶媒灌流无影响(图2G-I)。这些结果表明吗啡通过MOR降低NPY⁺中间神经元兴奋性,可能进一步对瘙痒环路产生去抑制作用并引发瘙痒反应。
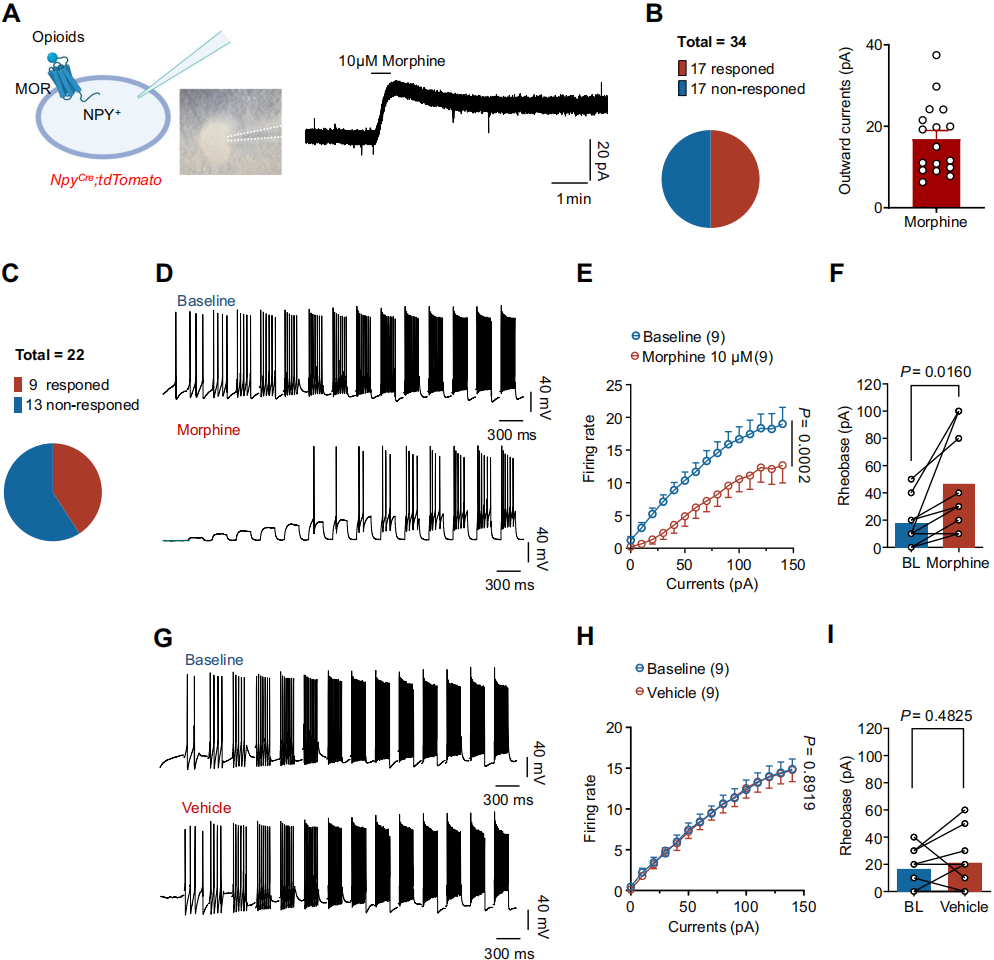
图2 吗啡抑制SDH中NPY⁺抑制性中间神经元的兴奋性
基于NPY和NPY1受体(NPY/NPY1R)系统在瘙痒传递中的已知作用,研究测试了NPY对鞘内注射吗啡诱导瘙痒的直接调控作用。联合注射NPY以剂量依赖方式显著减弱吗啡诱导的搔抓或啃咬行为(图3A)。不同剂量的NPY1R特异性激动剂LP-NPY也能抑制这些行为(图3B)。NPY1R选择性拮抗剂BIBO3304可完全阻断LP-NPY对吗啡诱导瘙痒的影响(图3C),且在Npy1r敲除(Npy1r⁻/⁻)小鼠中,NPY无法减轻吗啡诱导的瘙痒(图3D),证实了作用的特异性。这些数据表明NPY⁺神经元可能通过释放NPY对瘙痒环路发挥抑制作用,但Npy1r⁻/⁻小鼠无明显自发性瘙痒,可能因存在代偿机制。此外,鞘内注射NPY和LP-NPY均显著抑制内源性阿片EM-1诱导的瘙痒(图3E-F),表明NPY通过NPY1R直接调控阿片诱导的瘙痒反应。
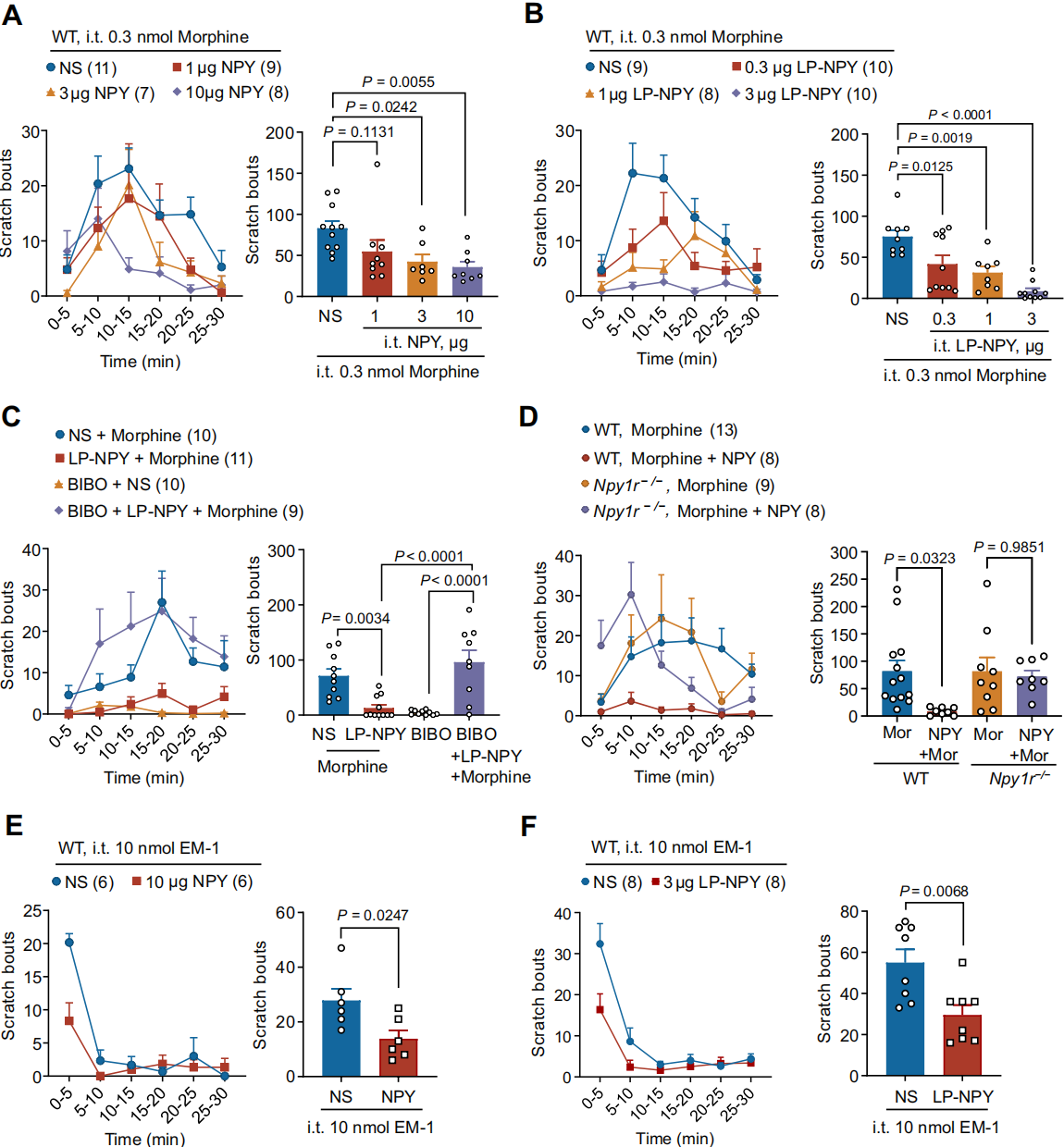
图3 NPY-NPY1R参与鞘内阿片类药物诱导的瘙痒
研究表达MOR的NPY⁺中间神经元去抑制后激活的下游瘙痒相关神经元类型发现,鞘内注射吗啡可显著激活胃泌素释放肽Grp⁺和胃泌素释放肽受体Grpr⁺神经元(图4A、D)。具体而言,吗啡使SDH中Grp⁺神经元的c-Fos阳性神经元数量显著增加(图4B),而同时注射NPY则使其显著减少(图4B)。生理盐水组SDH Ⅱ层Grp标记细胞中c-Fos阳性占比4.35%,吗啡处理组增至18.59%(图4C),同时注射NPY后降至5.28%(图4C)。SDH Ⅰ-Ⅱ层Grpr⁺神经元的c-Fos阳性神经元数量在吗啡处理后显著增加(图4E),吗啡加NPY处理后显著减少(图4E)。吗啡处理后,SDH中Grpr标记细胞的c-Fos阳性比例从6.73%增至16.46%(图4F)。为确定NPY⁺中间神经元的直接下游神经元类型,向NpyCre小鼠SDH(T13-L1水平)注射Cre依赖的mWGA顺行示踪病毒,显示mWGA-mCherry信号在NPY⁺和GRP⁺中间神经元中表达,GRPR⁺中少量表达,表明NPY⁺向GRP⁺提供突触输入(图4G-J)。因mWGA可跨多突触传递,GRPR⁺中的mWGA可能是跨两突触或少数直接连接所致。用HSV顺行示踪和RV逆行示踪进一步证实突触连接,在NpyCre小鼠腰脊髓表达AAV辅助病毒(rAAV-hSyn-DIO-EGFP-T2A-Her2CT9和rAAVUL26.5-DIO-gD)后注射HSV-mCherry,RNAscope显示Grp⁺中间神经元中有mCherry阳性神经元(图4K-L);向GrpCre小鼠SDH注射AAV辅助病毒(rAAV-EF1α-DIO-EGFPT2A-TVA和rAAV-EF1α-DIO-N2cG)14天后注射RV示踪病毒,双标证实病毒特异性感染,结合Npy RNAscope,证实NPY⁺和GRP⁺中间神经元存在解剖学连接(图4M-N)。这些数据表明,GRP⁺中间神经元是NPY⁺中间神经元的直接下游,二者有单突触连接。
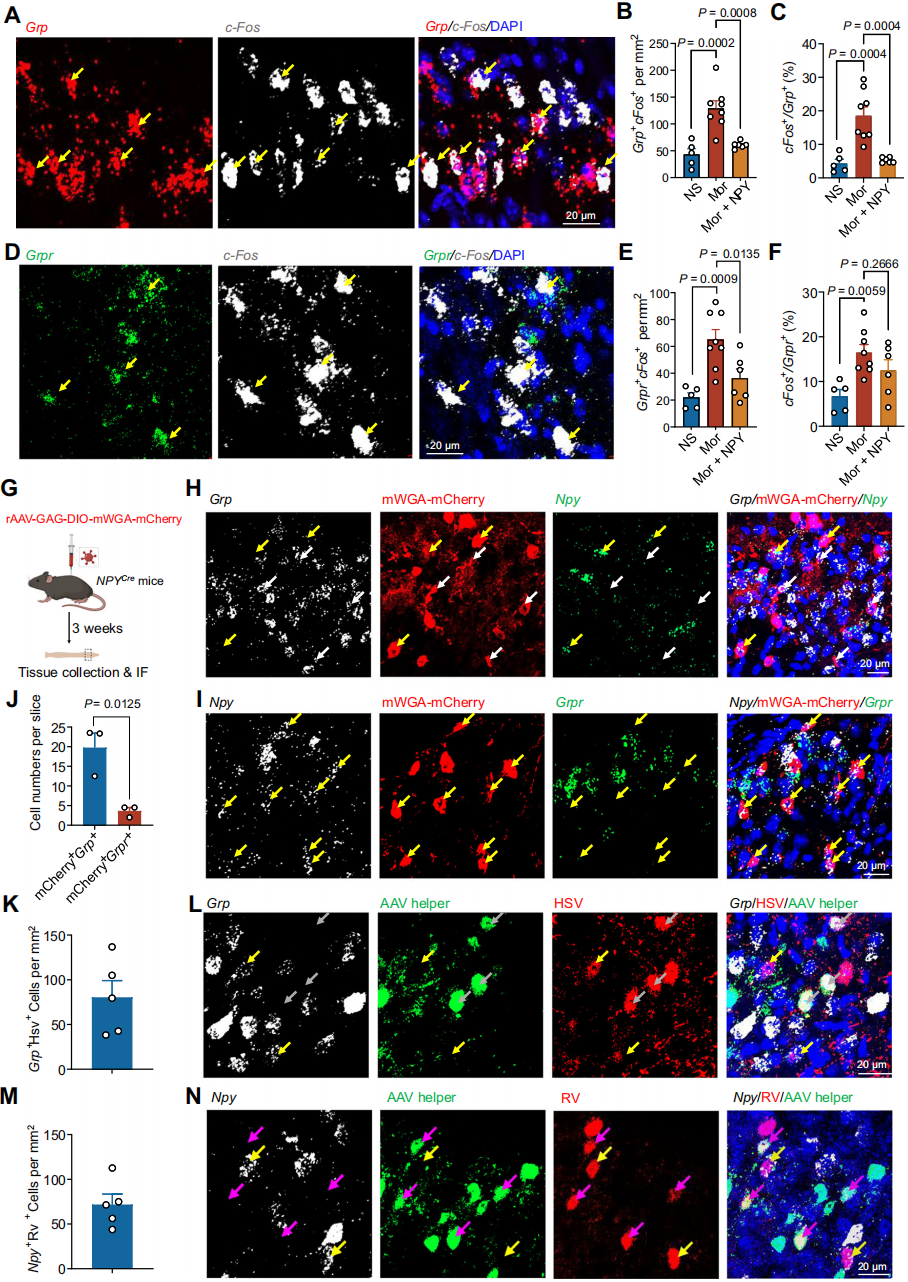
图4 GRP+中间神经元是NPY+中间神经元的直接下游靶点
脊髓背角(SDH)Ⅱ层的RNAscope实验显示,Npy1r与Grp的mRNA共定位率极高,66.93%的Npy1r⁺中间神经元表达Grp,66.44%的Grp⁺中间神经元表达Npy1r(图5A-B)。为明确GRP⁺中间神经元在吗啡诱导瘙痒中的作用,对GrpCre;iDTR小鼠腹腔注射白喉毒素(DTX)消融GRP⁺中间神经元,RNAscope证实其数量显著减少,行为学显示吗啡诱导瘙痒显著减轻(图5C)。用GrpCre;hM4Di小鼠化学遗传抑制GRP⁺中间神经元,经CNO处理后,吗啡诱导的瘙痒及啃咬舔舐行为均显著受抑(图5D),表明GRP⁺中间神经元是必需的。构建GRP条件性敲除小鼠(Vglut2Cre;Grpfl/fl),发现兴奋性中间神经元中敲除Grp后,吗啡诱导瘙痒显著减少(图5E)。鞘内注射GRPR拮抗剂PD176252(10μg)显著抑制吗啡诱导瘙痒(图5F),提示GRPR是GRP⁺中间神经元的下游信号。综上,吗啡诱导的瘙痒需要GRP⁺中间神经元及GRP参与。
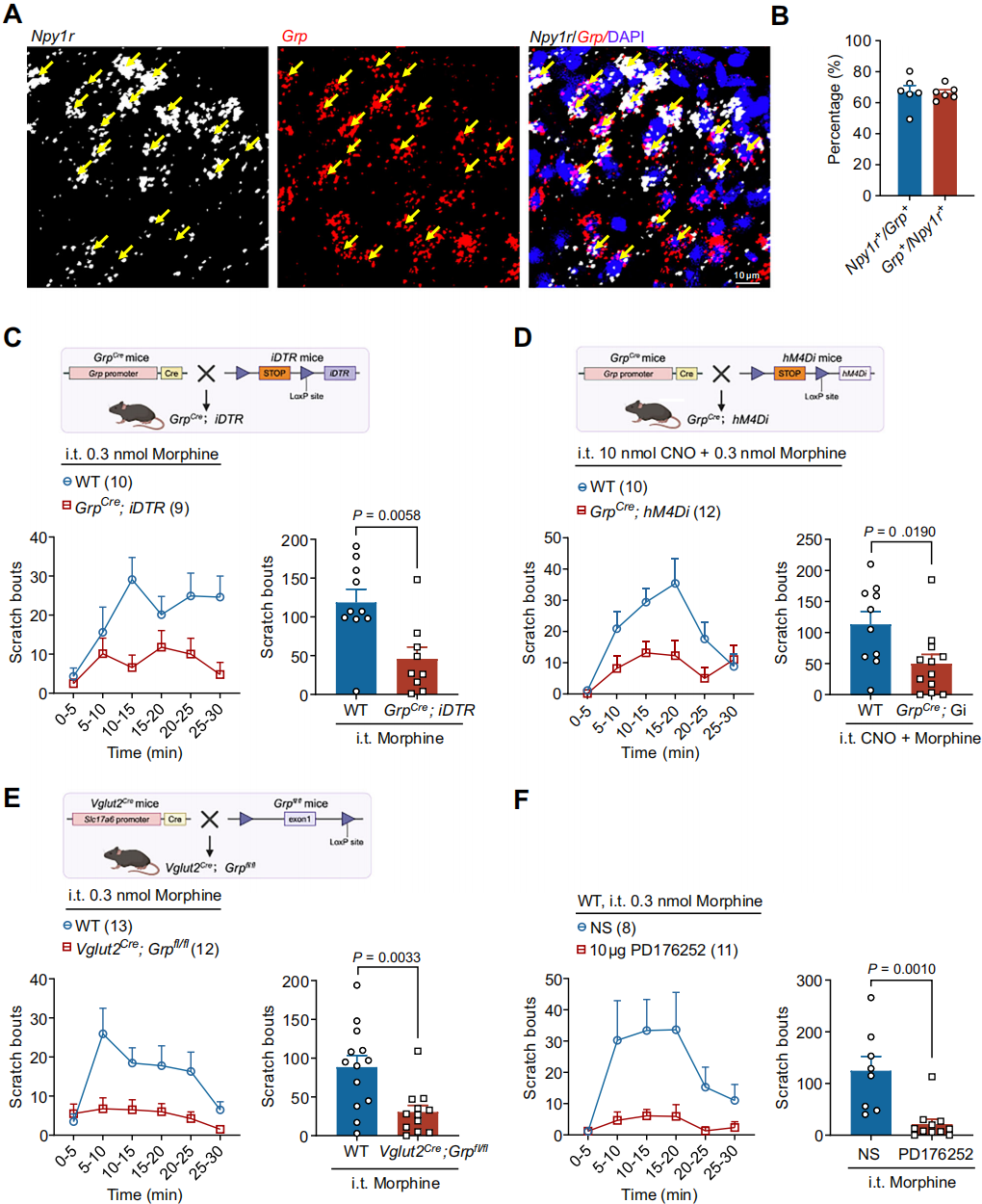
图5 GRP+内神经元和GRP是吗啡诱导瘙痒所必需的
为探究GRP⁺中间神经元是否接收来自表达MOR的NPY⁺中间神经元的抑制性输入,利用 GrpCre;Ai9 小鼠,对吗啡对Ⅰ-Ⅱ层GRP⁺中间神经元自发性抑制性突触后电流(sIPSCs)的影响开展了电生理学分析。记录数据显示,灌流10μM吗啡可显著降低sIPSCs的频率和振幅(图6A-D),这与吗啡作用于NPY⁺神经元输入端的突触前MOR的预期结果一致。BIBO3304未改变吗啡对sIPSCs的抑制作用,吗啡的抑制机制独立于 NPY1R信号通路。此外,在存在 0.5μM 河豚毒素(TTX)的情况下,10μM吗啡也显著降低了微型IPSCs的频率和振幅(图 6G-I)。吗啡对 GRP⁺神经元记录到的自发性兴奋性突触后电流(sEPSC)无显著影响。但吗啡在26%的GRP⁺神经元中诱发了外向电流。这些结果表明,吗啡特异性抑制GRP⁺神经元记录到的sIPSCs,这提示GABA/甘氨酸参与了该抑制性环路。通过GrpCre;GCamp6f小鼠的在体光纤光度记录(图6J-K)发现,吗啡注射后GRP⁺中间神经元显著激活,且与搔抓反应相关(图6K)。同时注射MOR拮抗剂纳洛酮或NPY可阻断吗啡对GRP⁺中间神经元的激活(图6K)。
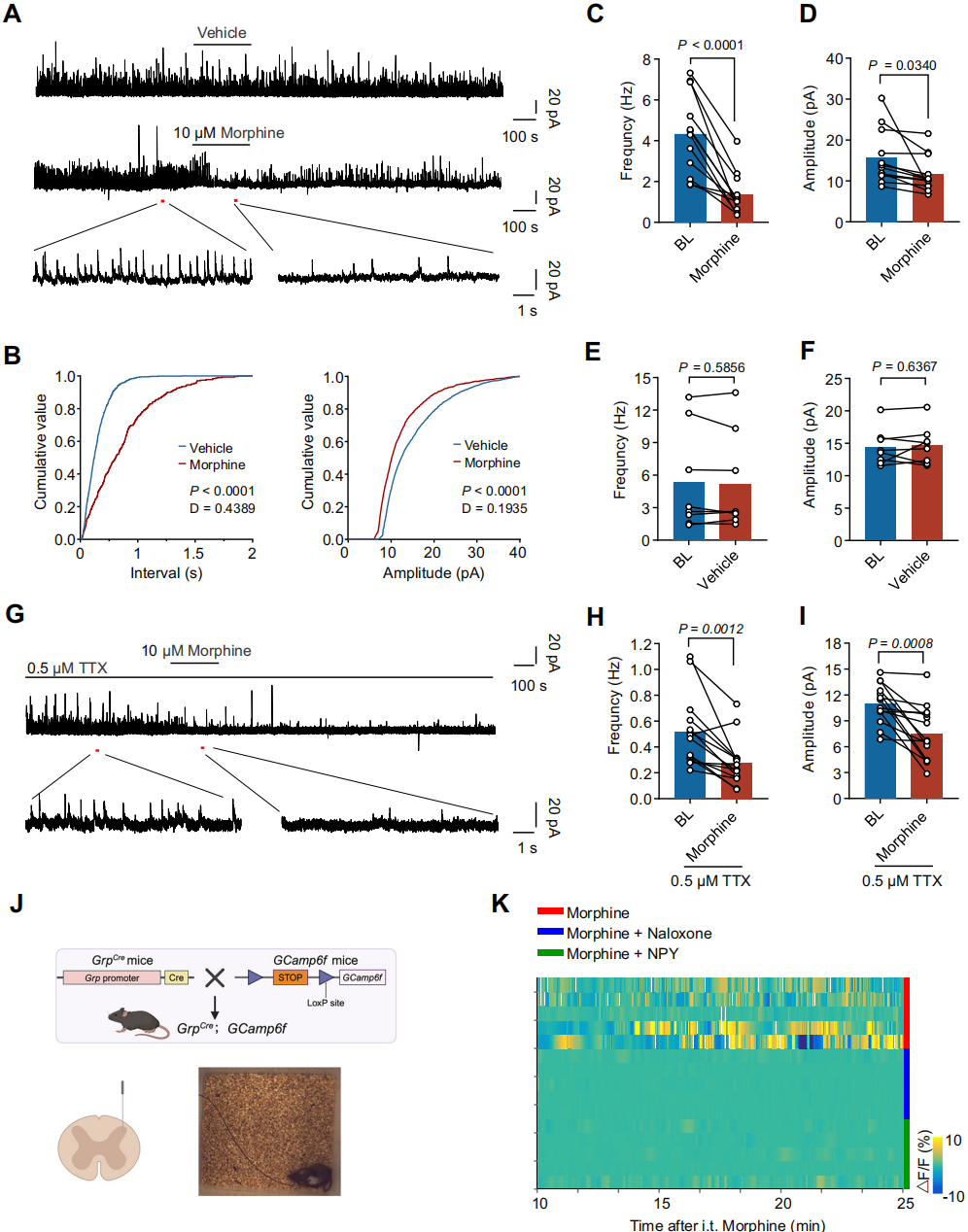
图6 吗啡阻碍SDH中GRP⁺中间神经元的抑制性突触传递
此外研究NPY对GRP⁺中间神经元兴奋性的直接影响发现,10μM NPY使脊髓背角Ⅱ层GRP⁺中间神经元的基强度显著增加,电流注射诱发的动作电位数量减少(图7A-C),而溶媒灌流无影响(图7D-F)。此外,10μM NPY在脊髓背角Ⅱ层GRP⁺中间神经元中诱发平均振幅18.785pA的外向电流,且该电流可被2μM NPY1R选择性拮抗剂BIBO3304阻断(图7G)。测试NPY对GRP⁺中间神经元激活诱导的搔抓行为的影响显示,用10nmol CNO化学遗传学激活GrpCre;hM3Dq小鼠的GRP⁺中间神经元会引发强烈瘙痒,而鞘内注射10μg NPY可完全消除该瘙痒(图7H)。这些结果表明,NPY可直接抑制GRP⁺中间神经元的兴奋性,进而抑制其介导的瘙痒。
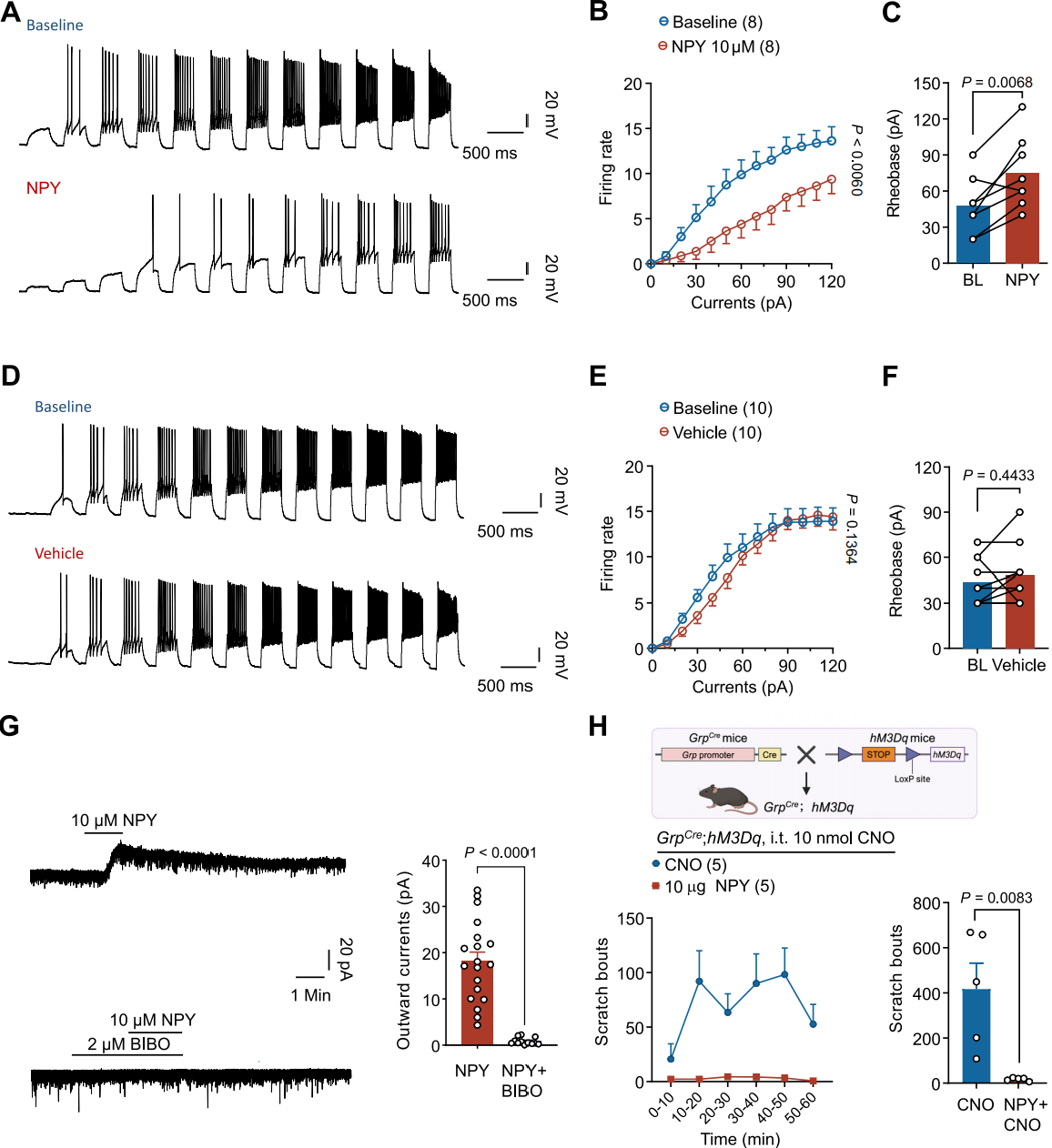
图7 NPY调节GRP⁺中间神经元且GRP⁺中间神经元介导瘙痒反应
总 结
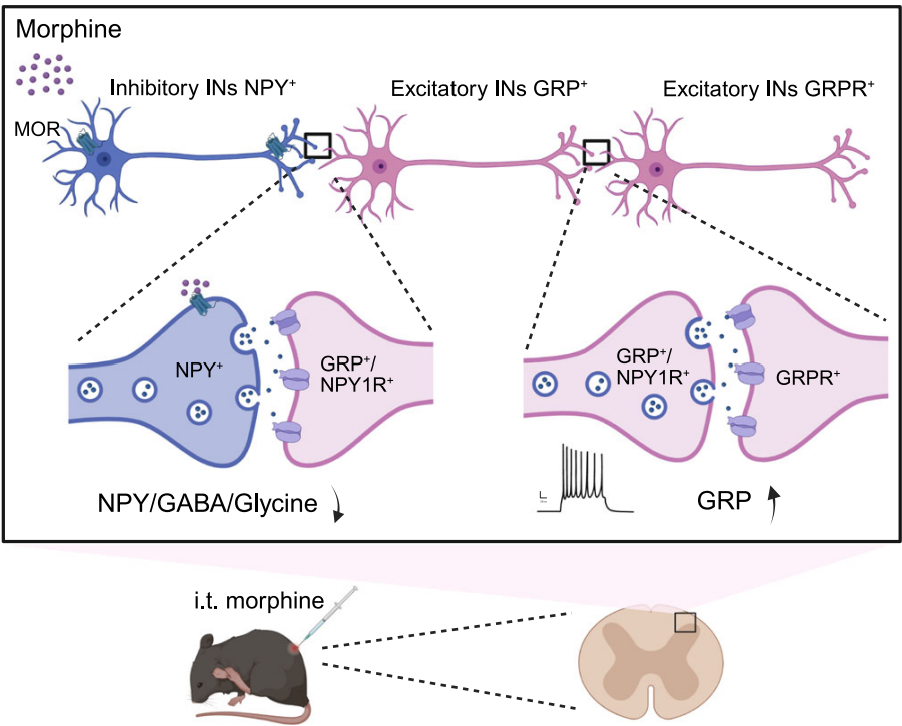
阿片类药物(如吗啡)通过作用于脊髓背角NPY⁺抑制性中间神经元上的MOR,抑制其兴奋性,减少对GRP⁺神经元的抑制性输入,导致GRP⁺神经元去抑制,进而激活GRPR⁺神经元,触发瘙痒反应。NPY-NPY1R系统在调节GRP⁺神经元活动中起关键作用,GRP-GRPR微环路的去抑制是阿片诱导瘙痒的核心机制。
本文使用的工具病毒布林凯斯均可提供:

同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。