铅作为常见环境污染物,对人体(尤其儿童)危害大,与神经发育、行为缺陷相关,血铅浓度与认知发育负相关,还会损伤海马引发情绪问题,但铅导致记忆缺陷易感性的机制尚未明确。
海马负责学习和记忆的处理与存储,分为空间记忆和非空间记忆;海马 CA1 区锥体细胞在信息处理、记忆编码中起关键作用,参与联想记忆,其活性降低与记忆缺陷相关。表观遗传重编程机制使机体细胞整合外界环境信号,但环境风险因素引发记忆缺陷的具体表观遗传通路尚未明确。已有研究证实,铅暴露会降低猴和小鼠大脑的组蛋白乙酰化水平(H3K9ac),且与组蛋白乙酰转移酶和组蛋白去乙酰化酶(HDACs)相关;前期研究进一步发现,HDAC1和HDAC2是铅暴露导致H3K9ac减少的直接原因,同时HDAC2可调控神经元记忆相关蛋白并参与空间记忆的重编程。
2025年6月2日,合肥工业大学汪惠丽教授研究团队在Journal of Hazardous Materials期刊发表了题为Epigenetic reprogramming of HDAC2 in CA1 excitatory neurons determines Pb-induced non-spatial memory deficits的研究论文。该研究首次揭示铅暴露通过损伤CA1兴奋性神经元增加非空间记忆缺陷易感性,而HDAC2表观遗传重编程是这一易感性的重要触发因素。

为探究环境风险因素对非空间记忆的影响,研究以PND21的C57小鼠为对象,让其饮用含铅水建立记忆缺陷模型(排除跨代效应)。PND80时,铅暴露小鼠血铅、脑铅水平分别为 94.618±9.833μg/L、0.182±0.031μg/g。通过新物体识别实验(NOR)、嗅觉奖励记忆实验(ORM)和食物偏好社会传递任务(STFP)评估发现铅暴露小鼠(Pb组)对新物体的时间及进入次数偏好指数显著降低,对苯乙酮的时间偏好指数和食物偏好指数均显著降低(总食物消耗量不变)。综上,铅会加剧小鼠出现非空间记忆缺陷表型的易感性。
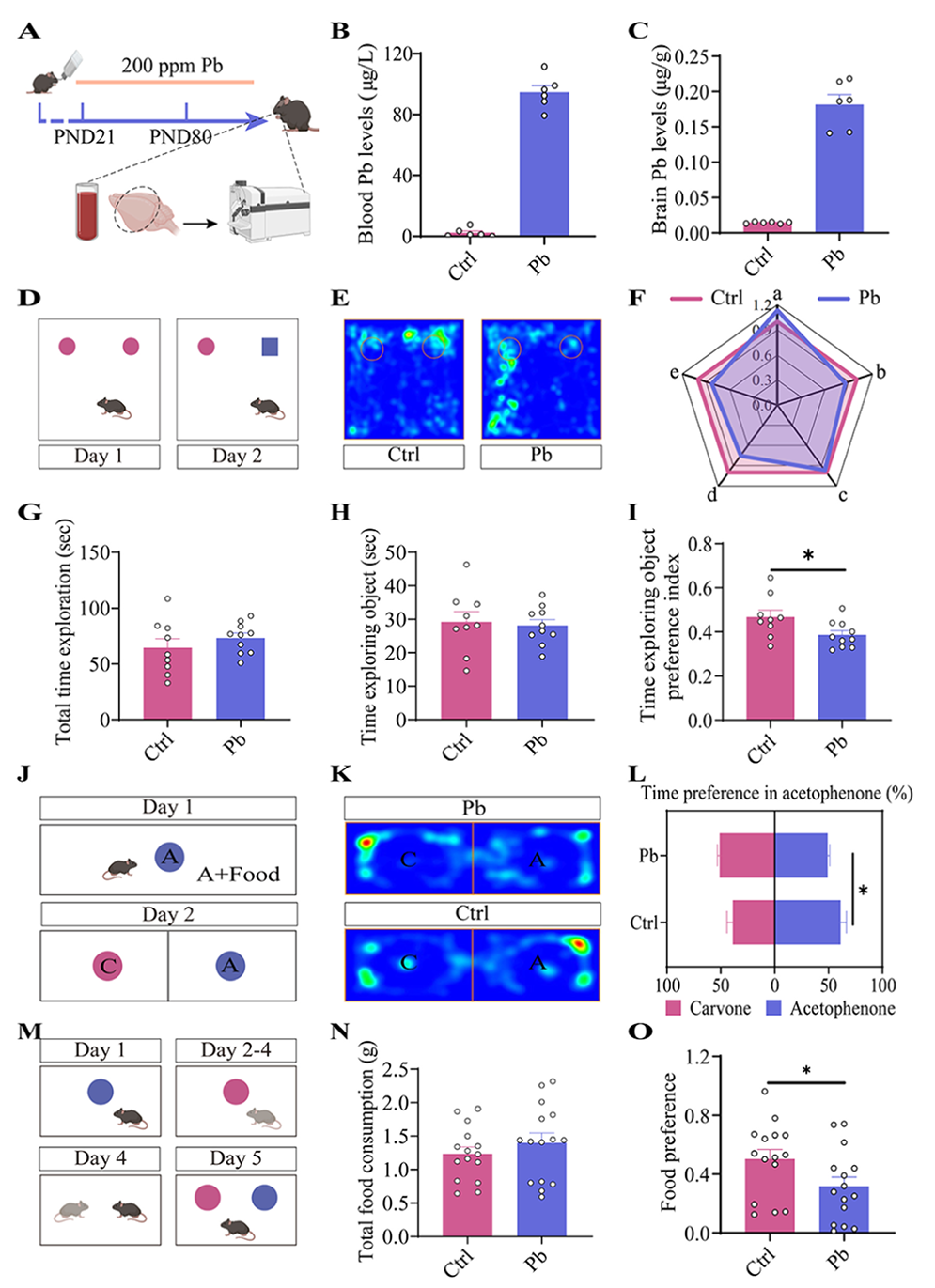
图1 铅会增加非空间记忆缺陷的易感性。
海马CA1区锥体细胞参与联想记忆的信息处理和编码。研究通过向该区域注射 rAAV-CaMKIIɑ-GCaMP6s病毒并结合光纤光度计记录,发现与Ctrl组相比,Pb组小鼠CA1区兴奋性神经元的钙离子信号、峰值振幅及曲线下面积(AUC)均显著降低。通过化学遗传学方法激活Pb组小鼠海马CA1区兴奋性神经元(注射 rAAV-CaMKIIɑ-hM3D(Gq)-mCherry病毒),结合NOR和ORM实验结果发现,与Pb+Saline组相比,Pb+ CNO组小鼠在对两个物体的总探索时间、对新物体的探索时间和时间偏好指数以及对苯乙酮的时间偏好指数上均显著增加。这表明激活CA1区兴奋性神经元后,铅暴露小鼠的非空间记忆水平有所提升。与Ctrl+Saline组相比,Pb+ CNO组小鼠对两个物体的总探索时间和对新物体的探索时间显著增加,表明CA1区兴奋性神经元在环境风险因素(如铅暴露)诱导的非空间记忆缺陷易感性中起到决定性作用。
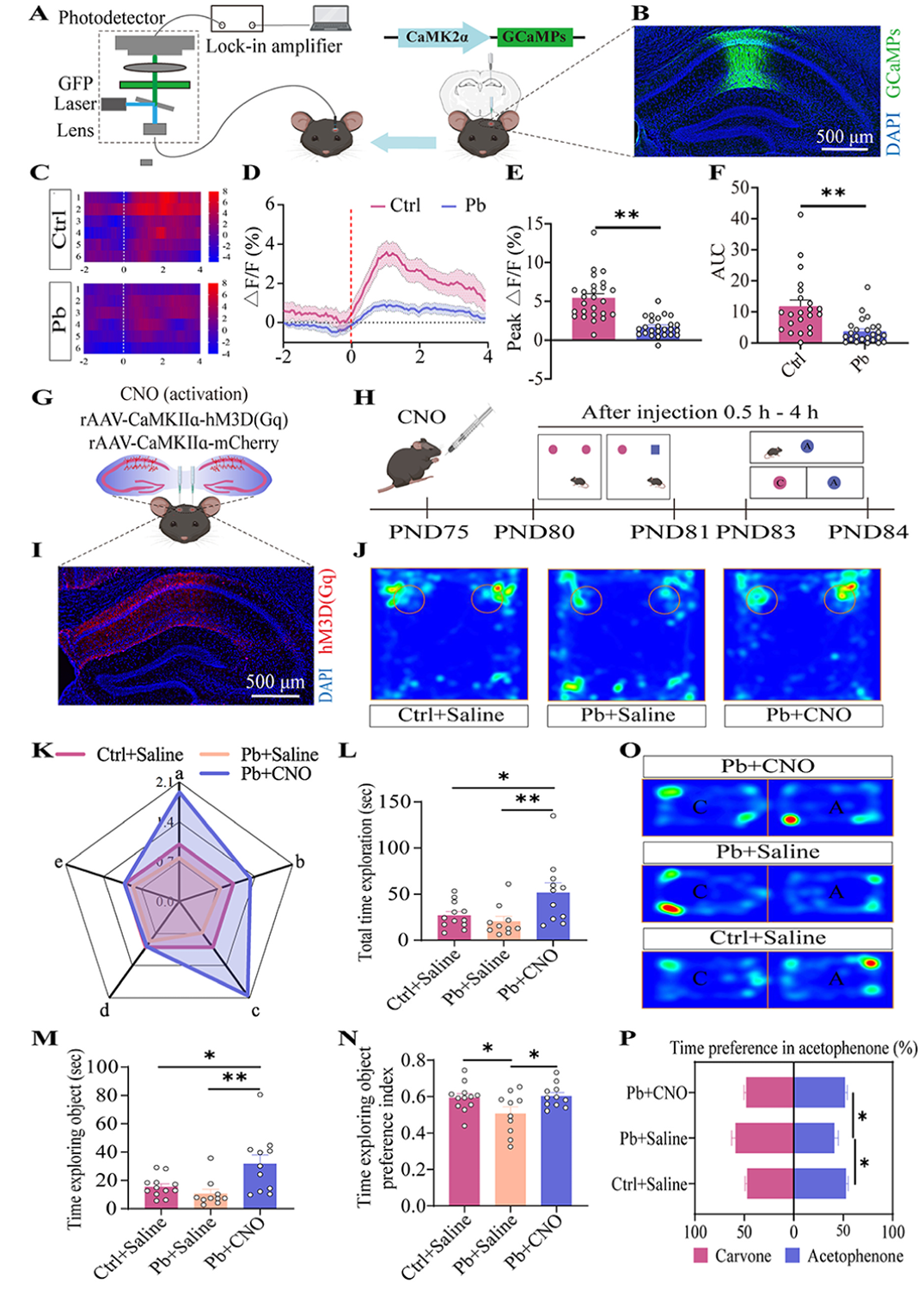
图2 铅通过CA1兴奋性神经元增加非空间记忆缺陷的易感性。
因经典钙通道及其受体决定神经元兴奋性,研究检测了海马中AMPAR2、NMDAR1、NMDAR2B、PSD95的蛋白表达,发现Pb组小鼠这四种蛋白水平较Ctrl组显著降低。HDAC1和HDAC2的表观遗传重编程是导致H3K9ac及上述蛋白水平变化的关键因素。检测显示,Pb组小鼠海马中HDAC1和HDAC2 水平显著升高,HDAC3则无变化。免疫组织化学检测发现,Pb组小鼠海马CA1区兴奋性神经元中HDAC2水平升高,且HDAC2在此区域分布广泛,而HDAC1表达不高。这表明铅会异常激活CA1区兴奋性神经元中HDAC2的表观遗传重编程,这可能与非空间记忆缺陷易感性的改变相关。
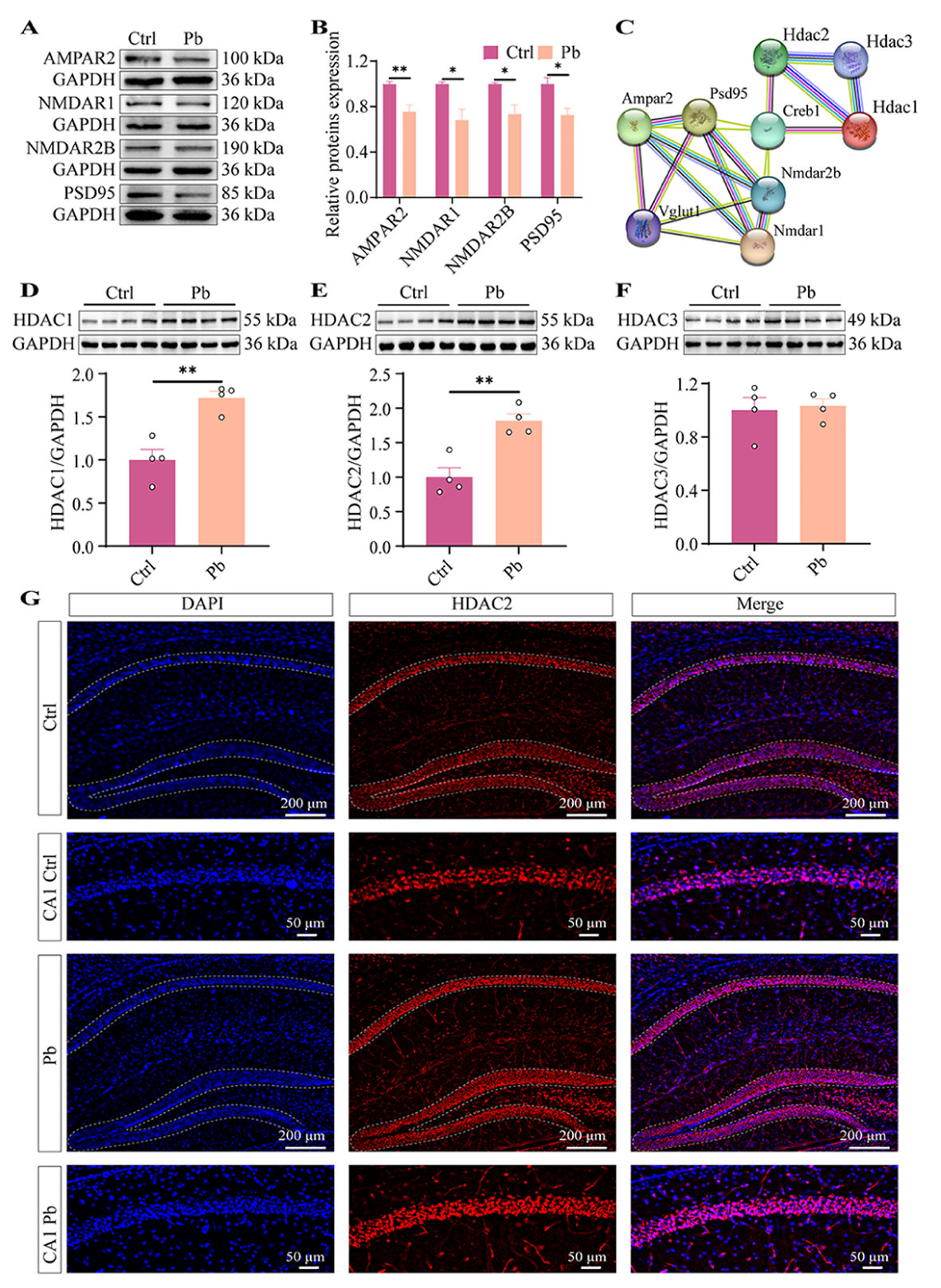
图3 铅促进海马兴奋性神经元中HDAC2表达上调。
研究将培育的Hdac2flox/flox小鼠与CaMKIIa-Cre转基因小鼠杂交构建Hdac2条件性敲除(Hdac2-cKO)小鼠,进一步通过qRT-PCR、Western Blot和免疫组织化学验证并确认小鼠海马CA1区神经元中HDAC2的成功敲除,同时发现Hdac2-cKO可提高Pb-Hdac2-cKO小鼠和Hdac2-cKO小鼠的H3K9ac蛋白水平。采用NOR和ORM检测非空间记忆,结果显示,两组物体总探索时间无变化,与Pb组小鼠相比,Pb-Hdac2-cKO和Hdac2-cKO小鼠对新物体及苯乙酮的时间偏好指数均显著升高;Pb-Hdac2-cKO小鼠对新物体的探索时间较Pb组小鼠显著增加,而Hdac2-cKO小鼠无此变化。这表明Hdac2条件性敲除决定了铅暴露诱导的非空间记忆缺陷易感性的反应。
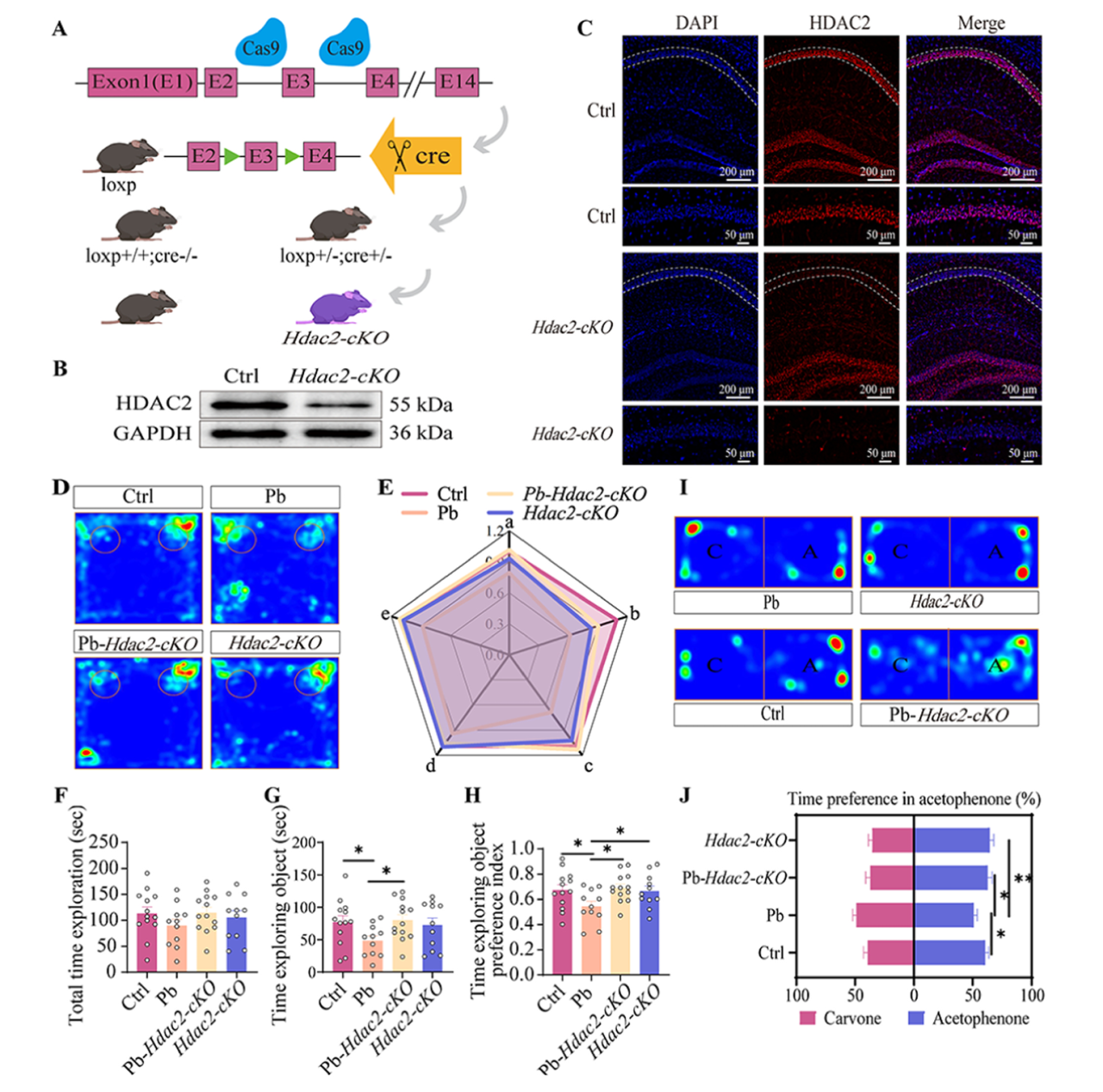
图4 Hdac2-cKO可恢复铅诱导的非空间记忆缺陷。
采用全细胞膜片钳记录技术,发现Ctrl组相比,Pb组小鼠CA1区兴奋性神经元的mEPSC频率显著降低;与Pb组小鼠相比,Pb-Hdac2-cKO组小鼠和Hdac2-cKO组小鼠的CA1区兴奋性神经元mEPSC频率显著增加。这表明Hdac2条件性敲除可减轻铅暴露后CA1区兴奋性神经元的突触传递缺陷。
进一步通过小鼠海马 CA1区注射Cre依赖的GCaMP6s病毒记录钙信号,发现,与Ctrl组相比,Pb组小鼠海马CA1区兴奋性神经元的钙信号、峰值振幅及曲线下面积显著降低;而与Pb组小鼠相比,Pb-Hdac2-cKO小鼠和Hdac2-cKO小鼠的上述指标均显著增加。这表明铅通过升高HDAC2的表观遗传重编程导致CA1 区兴奋性神经元活动降低,而敲除HDAC2可恢复这种降低的活动。
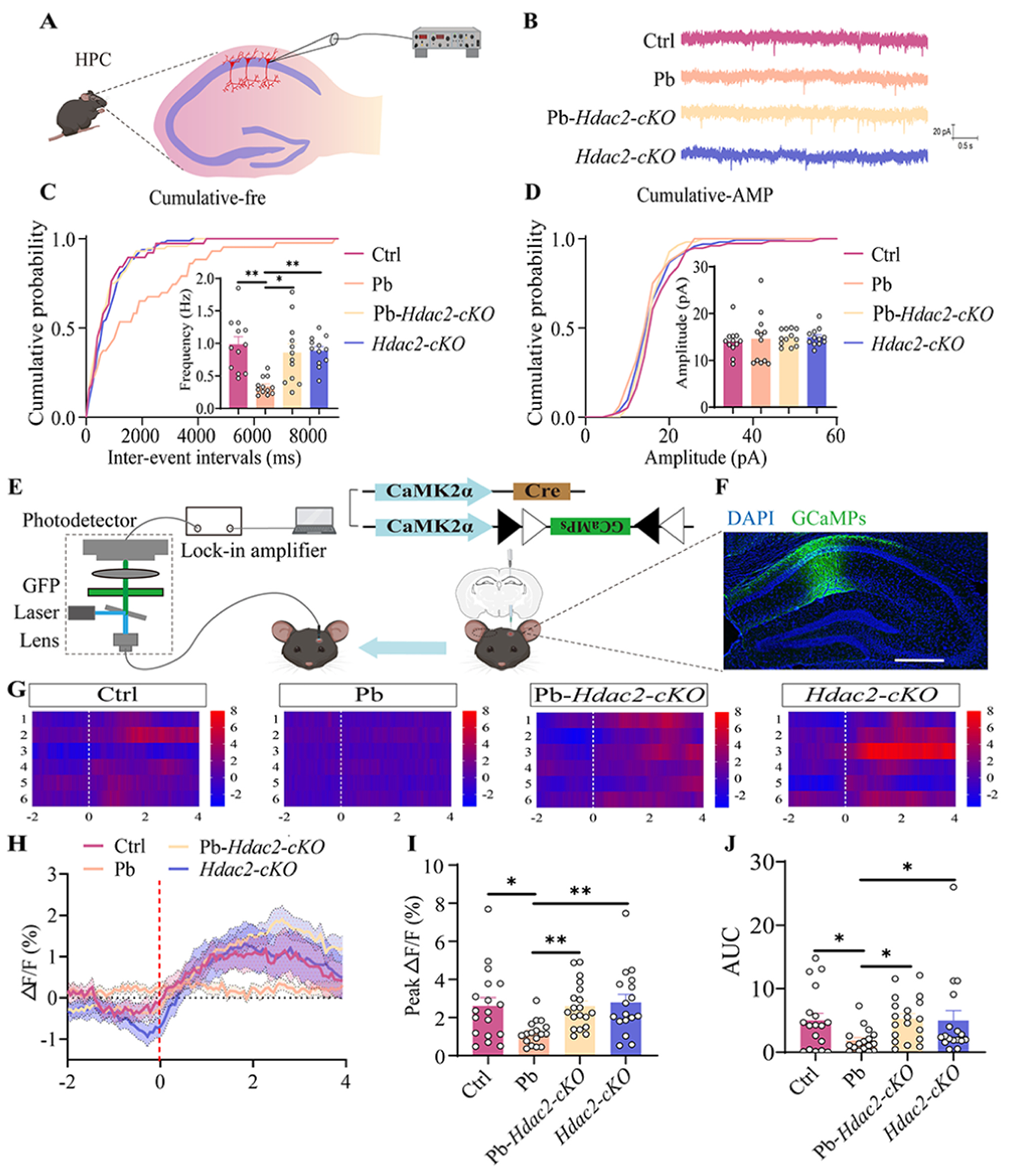
图5 Hdac2-cKO可恢复铅诱导的海马兴奋性神经元钙信号降低。
研究通过注射Cre依赖性稀疏标记病毒CSSP-YFP-2E4,对CA1区兴奋性神经元进行细胞类型特异性稀疏标记,Sholl分析显示,与Ctrl组相比,Pb组小鼠 CA1 区兴奋性神经元的交点数量减少,这表明铅会降低该区域神经元复杂的树突形态。相反,Pb-Hdac2-cKO小鼠和 Hdac2-cKO小鼠的CA1区兴奋性神经元表现出更复杂的树突分支。树突棘主要有四种类型,包括短粗型、蘑菇型、细长型和分支型。结果显示,铅暴露会降低CA1区兴奋性神经元的总树突棘密度、成熟的短粗型树突棘密度和成熟的蘑菇型树突棘密度,但对未成熟的细长型树突棘密度无影响。与Pb组小鼠相比,Pb-Hdac2-cKO小鼠和Hdac2-cKO小鼠的上述三种树突棘密度均显著增加;另外与Ctrl组小鼠相比,Hdac2-cKO小鼠CA1 区兴奋性神经元的树突棘密度显著增加。这些结果表明,铅诱导的HDAC2表观遗传重编程升高会导致CA1区兴奋性神经元的结构和树突棘损伤。
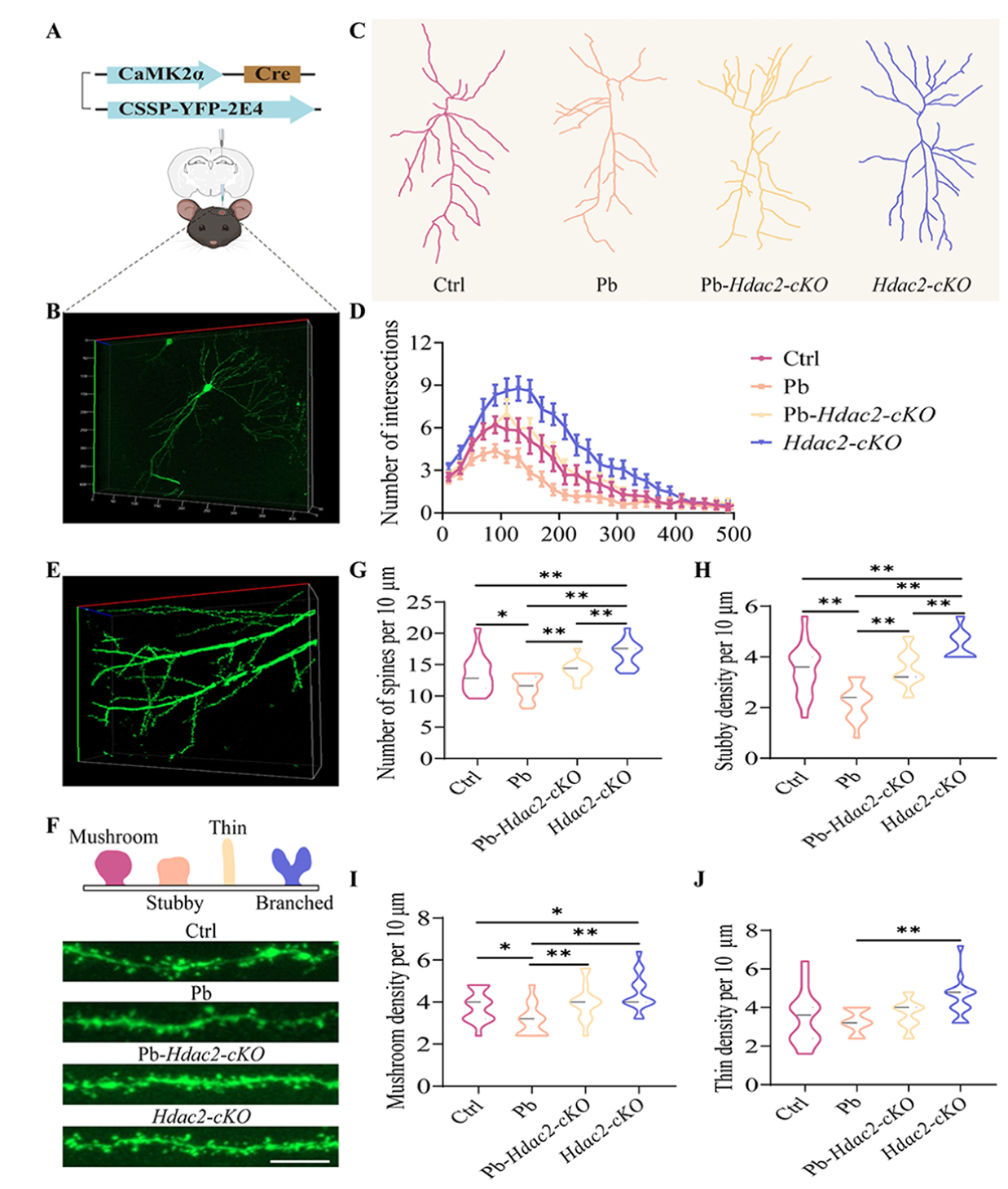
图6 Hdac2-cKO可恢复铅诱导的海马兴奋性神经元结构缺陷。
为探究HDAC2重编程调控铅诱导的CA1区兴奋性神经元损伤的分子机制。将Pb组与Ctrl组,Pb-Hdac2-cKO 组与Pb组小鼠的 CA1 区组织进行mRNA测序获得28个差异基因,基因本体(GO)富集分析显示这些基因参与钙离子跨膜运输、树突形态发生等与神经元结构和功能相关的通路,可能介导铅的损伤及 HDAC2敲除的修复作用。蛋白水平检测发现铅暴露使TRPC6、LRP2 等蛋白表达降低,而HDAC2敲除可逆转这一趋势,这验证了RNA测序结果的可靠性。STRING预测显示HDAC2与TRPC6、LRP2等靶基因存在相互作用。Hdac2条件性敲除能够逆转铅暴露引起的海马CA1区兴奋性神经元中VGLUT1、NMDAR1、NMDAR2B、AMPAR2和PSD95蛋白的减少。综上,这些结果表明铅通过升高HDAC2的表观遗传重编程,抑制与突触可塑性相关的靶基因的蛋白表达,进而损害神经元的结构和功能活性。
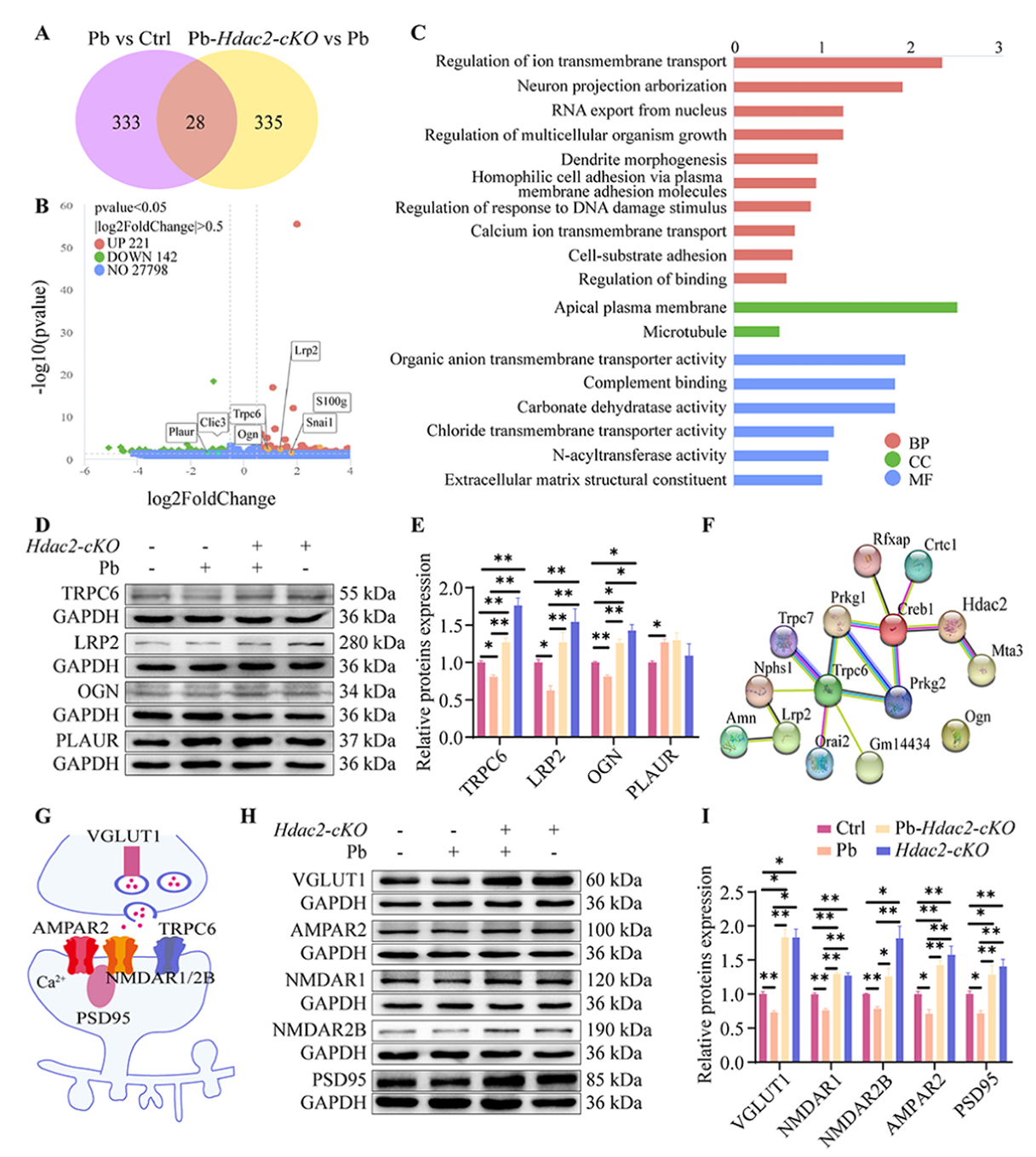
图7 Hdac2-cKO可恢复铅诱导的海马兴奋性神经元神经可塑性分子的减少。
铅暴露通过增加海马CA1区兴奋性神经元中HDAC2的表观遗传重编程,导致突触可塑性相关分子表达异常、神经元结构和功能受损,最终引发非空间记忆缺陷。这一发现不仅填补了环境因素与表观遗传修饰在非空间记忆障碍中的机制空白;另外靶向HDAC2逆转神经毒性,可能成为预防和治疗环境因素诱导记忆缺陷的新方向。
本文使用的工具病毒布林凯斯均可提供:

同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。