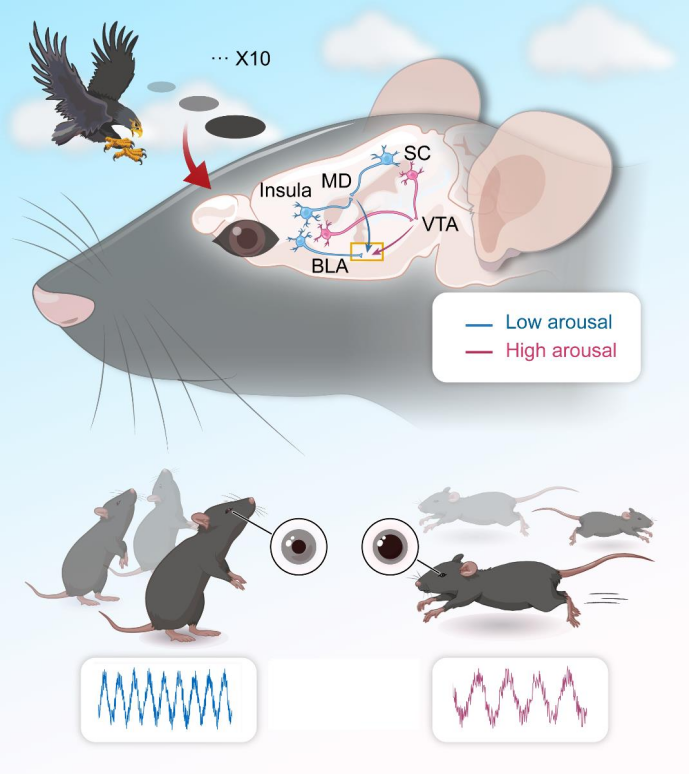
情绪反应,尤其是恐惧行为,对生物应对威胁至关重要。动物在面对重复的捕食者威胁时,会展现出习惯化和敏感化两种不同的应对策略,但背后的神经通路机制尚不清楚。视觉逼近刺激(LS)可引发动物的先天防御反应(T1)和习惯化行为(T2),然而,调节唤醒水平和习惯化的神经通路仍未被充分理解。
2025年5月9日,中国科学院深圳先进技术研究院脑认知与脑疾病研究所/深港脑科学创新研究院王立平研究员、刘雪梅副研究员团队在Neuron在线发表题为“Neural Circuit Underlying Individual differences in Visual Escape Habitua-tion” 的研究论文,确定了面对重复视觉威胁时的两种行为类型及相关神经通路,上丘-腹侧被盖区-基底外侧杏仁核(SC-VTA-BLA )通路介导T1行为,上丘-内侧背核-基底外侧杏仁核(SC-MD-BLA)和岛叶-MD-BLA通路介导T2行为。MD作为关键枢纽,整合SC和岛叶输入,调节唤醒和防御反应。

深圳先进院王立平研究员为本文最后通讯作者,深圳先进院刘雪梅副研究员为本文第一作者和共同通讯作者;深圳先进院助理研究员赖娟以及博士后韩传亮(现香港中文大学博士后)为论文共同第一作者,该研究得到了深圳先进院脑所/深港脑科学创新研究院徐富强研究员、谭力铭研究员以及蔚鹏飞研究员的大力支持和帮助。
已有研究证实,逼近刺激(LS)能够可靠地引发先天逃避行为。为了探究对重复逼近刺激的逃避习惯化现象(指动物在面对重复的威胁刺激时,逃避反应逐渐减弱的现象。),以52只野生型成年雄性小鼠为研究对象,让其接受10次LS试验,每次试验持续5.5秒,刺激间隔不少于2分钟(图1A)。根据平均反应潜伏期,将小鼠分为 “持续逃避”(T1)和 “快速习惯化”(T2)两种类型。T1组平均反应潜伏期短于5.5秒,T2组则超过5.5秒(图1B)。相比T1组,T2组平均逃避比例更低(图1C),平均反应潜伏期、返回时间更长,在巢穴中停留时间更短(图1F-G)。在试验过程中,T2组的潜伏期和返回巢穴时间在各阶段都有所增加。T2组的非选择性注意力(通过直立频率衡量)更高(图1D),在LS刺激后直立频率显著增加,而T1组则下降(图1E);在唤醒状态方面,T1组在LS刺激10秒后的瞳孔明显大于T2组,且在刺激前和刺激期间两组瞳孔大小无显著差异(图1I-K)。这表明T2组在面对重复LS刺激时,具有更高的习惯化程度,表现为刺激诱发的非选择性注意力增强和唤醒水平降低。
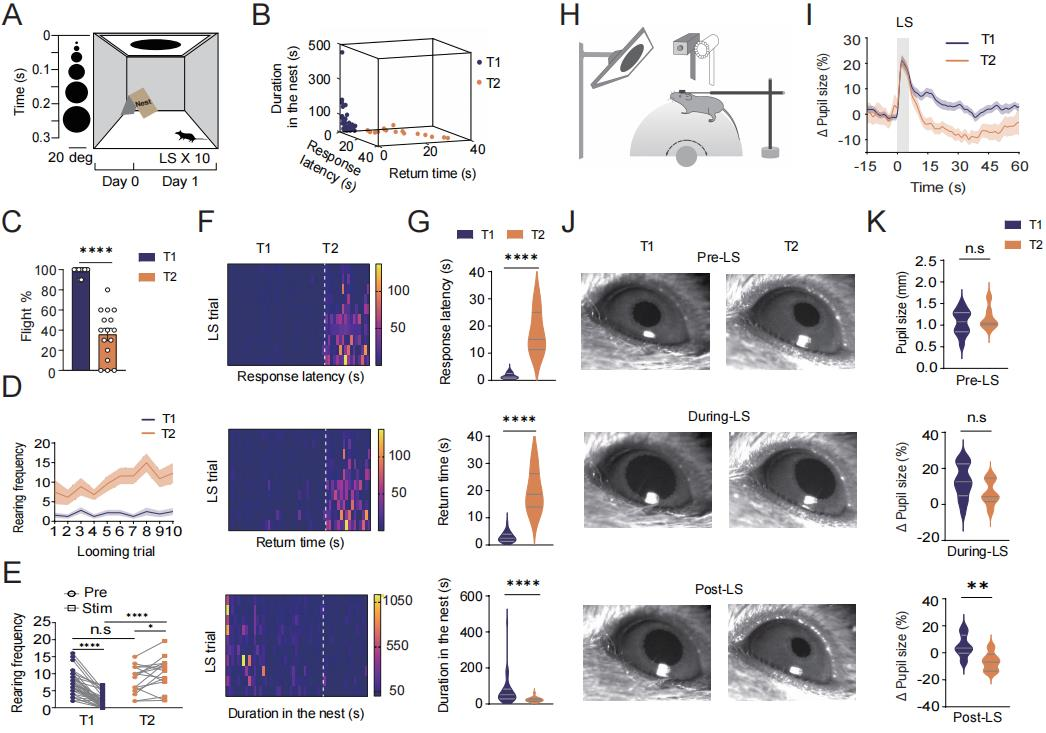
图1 对重复出现刺激逃避习惯化的个体差异
为了阐明在对LS习惯化过程中被激活的上丘(SC)神经元的作用,采用FosTRAP2技术,将AAV5-DIO-EGFP单侧注射到FosTRAP2小鼠上丘,第3天注射他莫昔芬,并使其暴露于重复的LS下,以激活被捕获的细胞。第24天,在灌注前再次暴露于LS(图2A)。结果发现T1组中SC脑区EGFP+神经元密度高于T2组,表明SC参与了LS习惯化过程,且对先天逃避行为有衰减作用(图 2B-C)。为了研究在对LS习惯化过程中,SC-VTA和SC-MD通路是否对唤醒有不同影响。将AAV5-CaMKIIα-ChR2-mcherry注射到上丘,并在MD和VTA 植入光纤(图2D-E),发现 LS暴露时激活SC-MD使瞳孔收缩,激活SC-VTA使瞳孔扩张(图2F-G),在光刺激期间和之后,SC-VTA组的平均瞳孔大小明显大于SC-MD 组(图2H-I),说明两条通路对唤醒水平影响不同。重复SC-VTA刺激能在有遮蔽物的开放场地中引发类似T1组的稳定逃避行为;SC-MD刺激会增加直立频率、反应潜伏期和返回时间,破坏逃避行为,而 SC-VTA刺激无此影响。由此可知,SC-MD激活降低唤醒水平、增加非选择性注意力,损害先天逃避行为;SC-VTA激活增加唤醒水平,但不影响非选择性注意力和逃避行为。
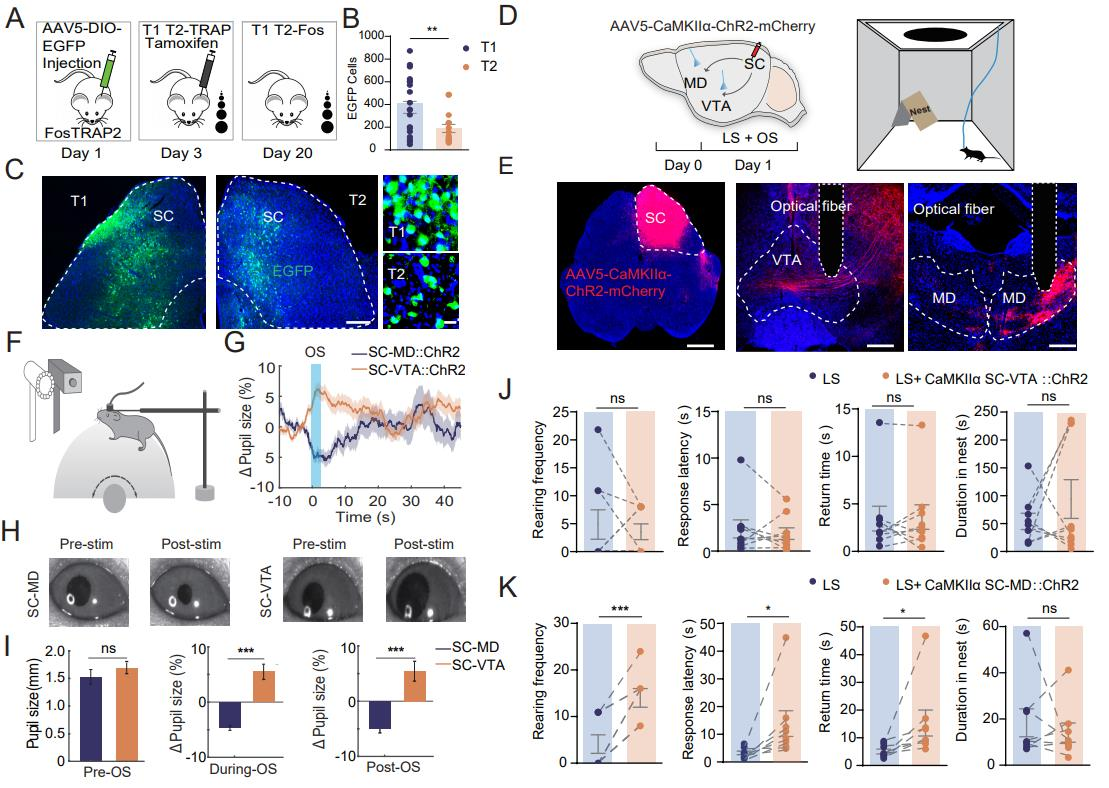
图2 不同的上丘路径调节觉醒和逃避行为
杏仁核对于条件性和先天性恐惧反应都至关重要,其中基底外侧杏仁核在编码与威胁相关的信息方面发挥着核心作用。作者研究了投射到VTA和MD的SC 神经元是否会在BLA汇聚。将AAV1-Cre注射在SC,AAV5-DIO-EYFP注射在MD,AAV5-DIO-mCherry注射在VTA(图3A)。结果显示在BLA中存在重叠的轴突投射,这表明投射到VTA和MD的SC神经元均支配BLA内的一个共同区域(图3B)。荧光密度分析显示,投射到VTA的SC神经元主要支配BLA的内侧部分,而投射到MD的神经元则靶向BLA的前部和后部(图3C)。
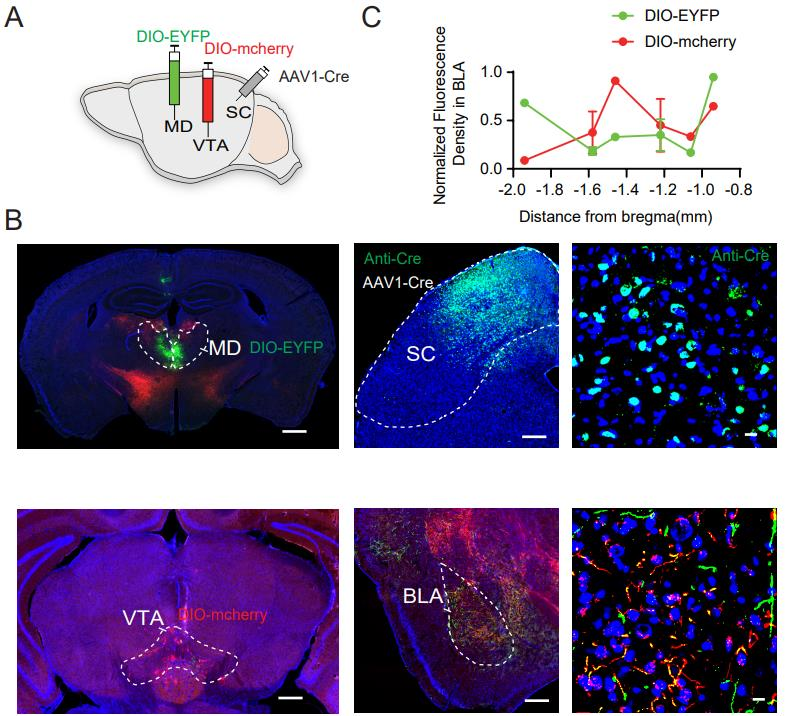
图3 VTA投射和MD投射SC神经元靶向BLA
为了进一步探究这种功能连接性,选择性光遗传激活SC-VTA和SC-MD通路,同时对BLA进行了体内多通道记录和瞳孔测量(图4A)。结果显示激活SC-VTA导致瞳孔扩大,而激活SC-MD导致瞳孔缩小(图4B)。在激活每条通路后,BLA内的神经元放电率发生了显著变化。对BLA局部场电位(LFP)功率谱的分析揭示了与每条通路相关的不同振荡模式(振荡是指神经元活动在时间上呈现的周期性波动现象,通过局部场电位(LFP)来衡量。它反映了神经元群体的协同活动状态,不同频率的振荡与特定的神经功能和行为密切相关)。SC-VTA激活导致低频带(θ和α)的功率增加,而SC-MD激活增强了高频带(β和低γ)的功率(图4D-F)。综上所述SC-MD和SC-VTA通路调节存在不同振荡特征,突出了它们在杏仁核通路和恐惧相关行为中的独特作用。
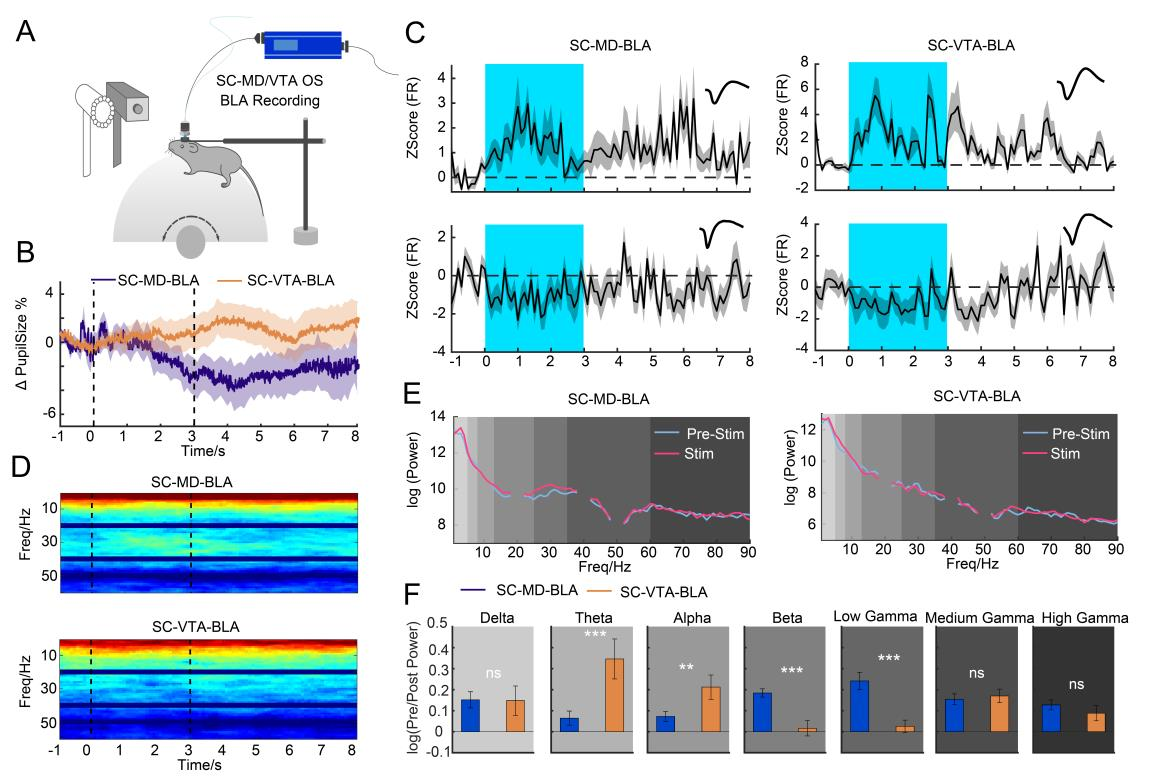
图4 SC通路调节BLA的连通性和振荡
已知岛叶皮层是感觉反馈和自主唤醒的关键整合中心,且投射到MD和 VTA。通过向岛叶皮层注射AAV5-CaMKIIα-ChR2-mCherry并在MD和VTA放置光纤(图5A、5D),利用光遗传学刺激结合瞳孔测量发现,刺激MD终末使瞳孔缩小,刺激VTA终末使瞳孔扩大,表明岛叶-MD和岛叶-VTA通路对唤醒水平的调节作用不同(图5E-F)。此外在岛叶皮层神经元中表达ChR2-mCherry 的小鼠,结果显示激活岛叶-MD通路会增加直立频率、反应潜伏期和返回时间,减少在巢穴中停留时间,降低唤醒水平,增加非选择性注意力,减弱由LS诱导的逃避反应;而激活岛叶-VTA通路对LS引发的行为无影响,但会提高唤醒水平(图5C-D、5G-H)。
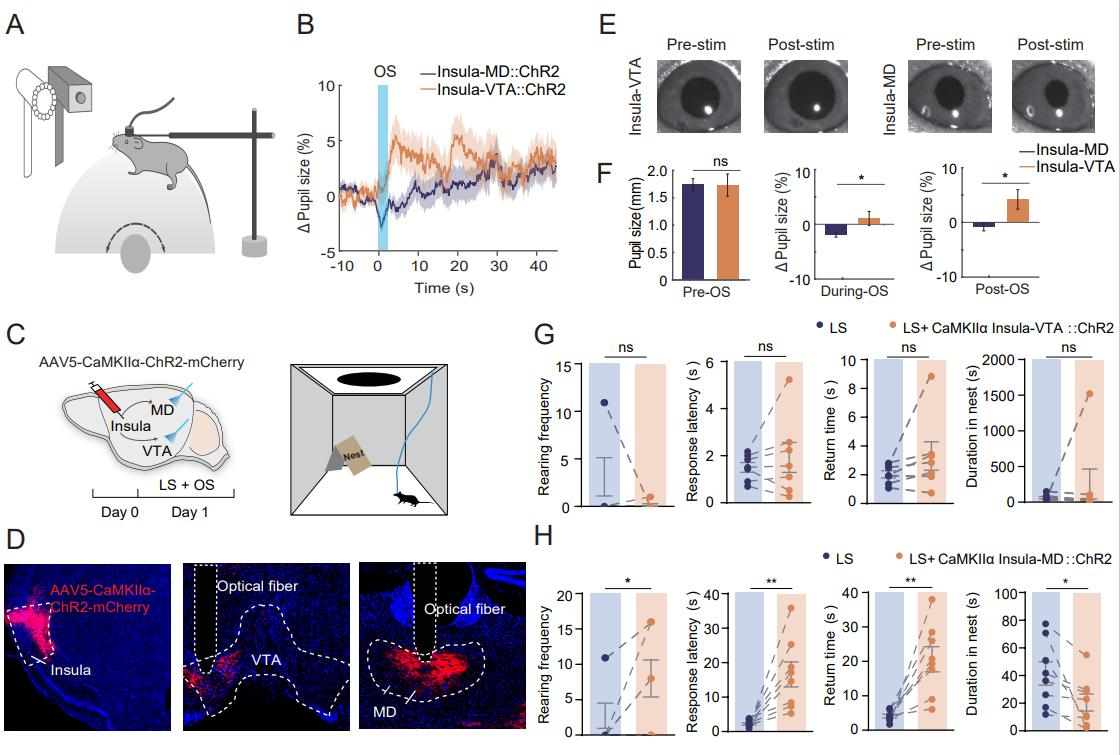
图5 不同的岛叶皮质通路调节觉醒和先天逃避行为
为了进一步研究功能连接性,在激活岛叶-MD通路期间,对BLA进行了体内多通道记录和瞳孔测量(图6A)。岛叶-MD刺激减小了瞳孔大小(图6B),并改变了BLA中的神经元放电率,有30%的神经元做出反应;但激活岛叶-MD通路并没有显著改变各频段的功率(图6D-F)。
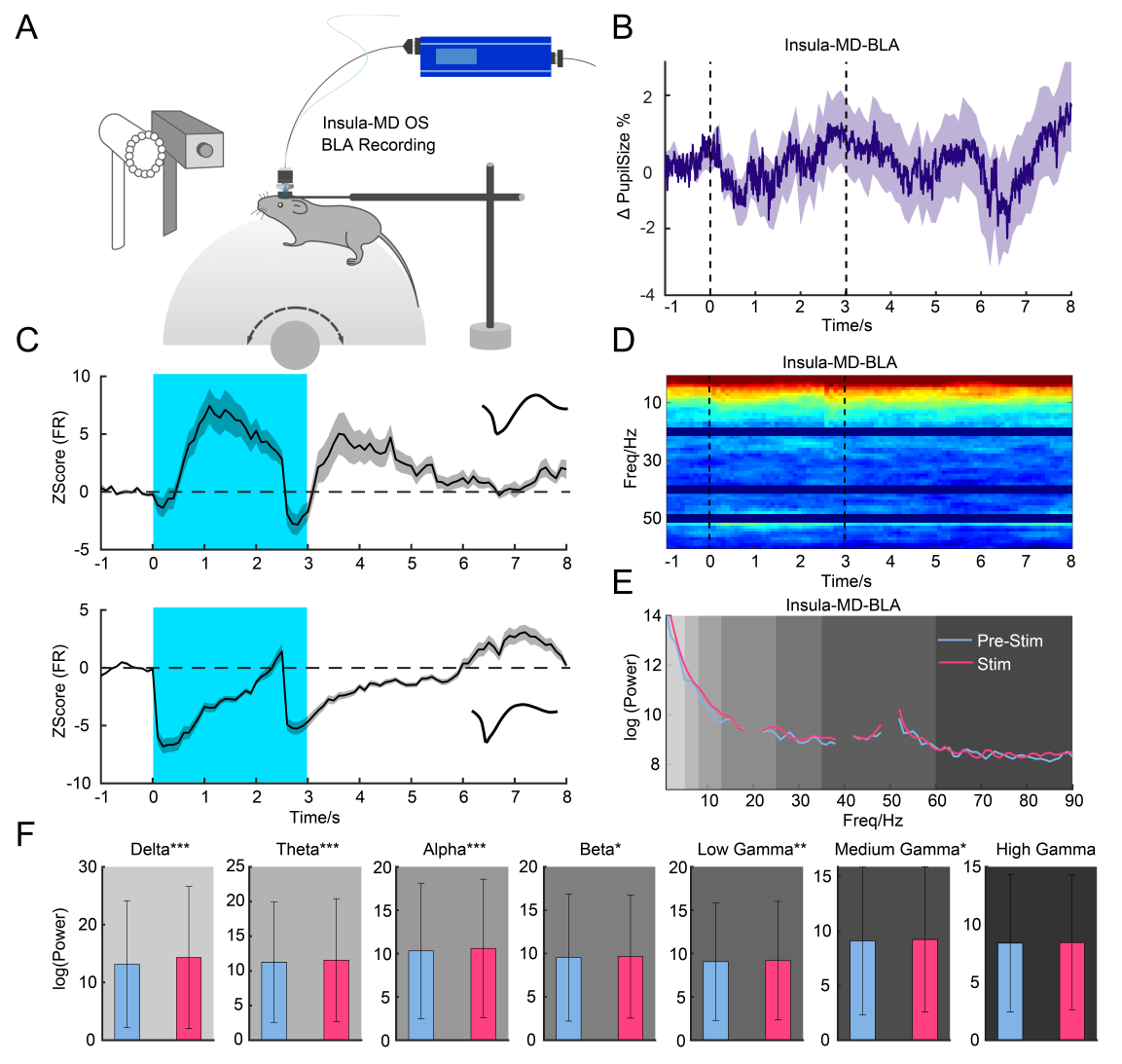
图6 岛叶-MD通路调节BLA的振荡
使用光遗传学操作和瞳孔测量来研究岛叶-BLA通路是否影响唤醒(图7)。将 ChR2-mCherry注射岛叶皮层并在BLA放置光纤后,光遗传学刺激减小了瞳孔大小(图7B-D)。激活岛叶-BLA通路增加了直立频率、反应潜伏期和返回时间,这表明由LS诱导的逃避行为减少。
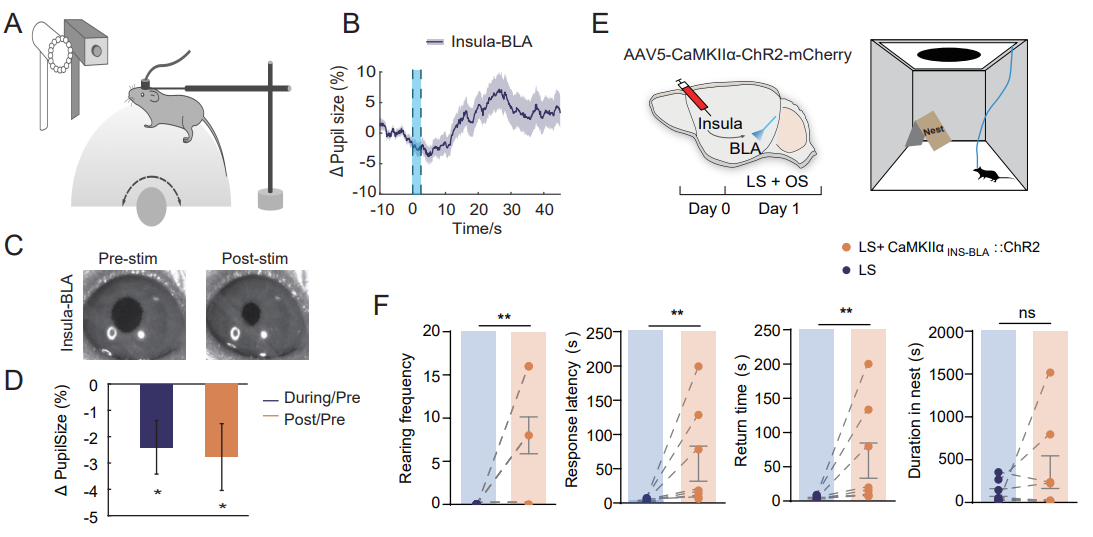
图7 岛叶-BLA通路对觉醒和逃避行为的影响
在进一步的记录中(图8A),激活岛叶-BLA通路影响了42%的BLA神经元,并减小了瞳孔大小(图8B-E);LFP功率分析显示没有显著变化,这与激活SC-MD通路形成对比,表明皮层下通路在调节逃避反应方面比皮层通路发挥着更显著的作用(图8D-F)。
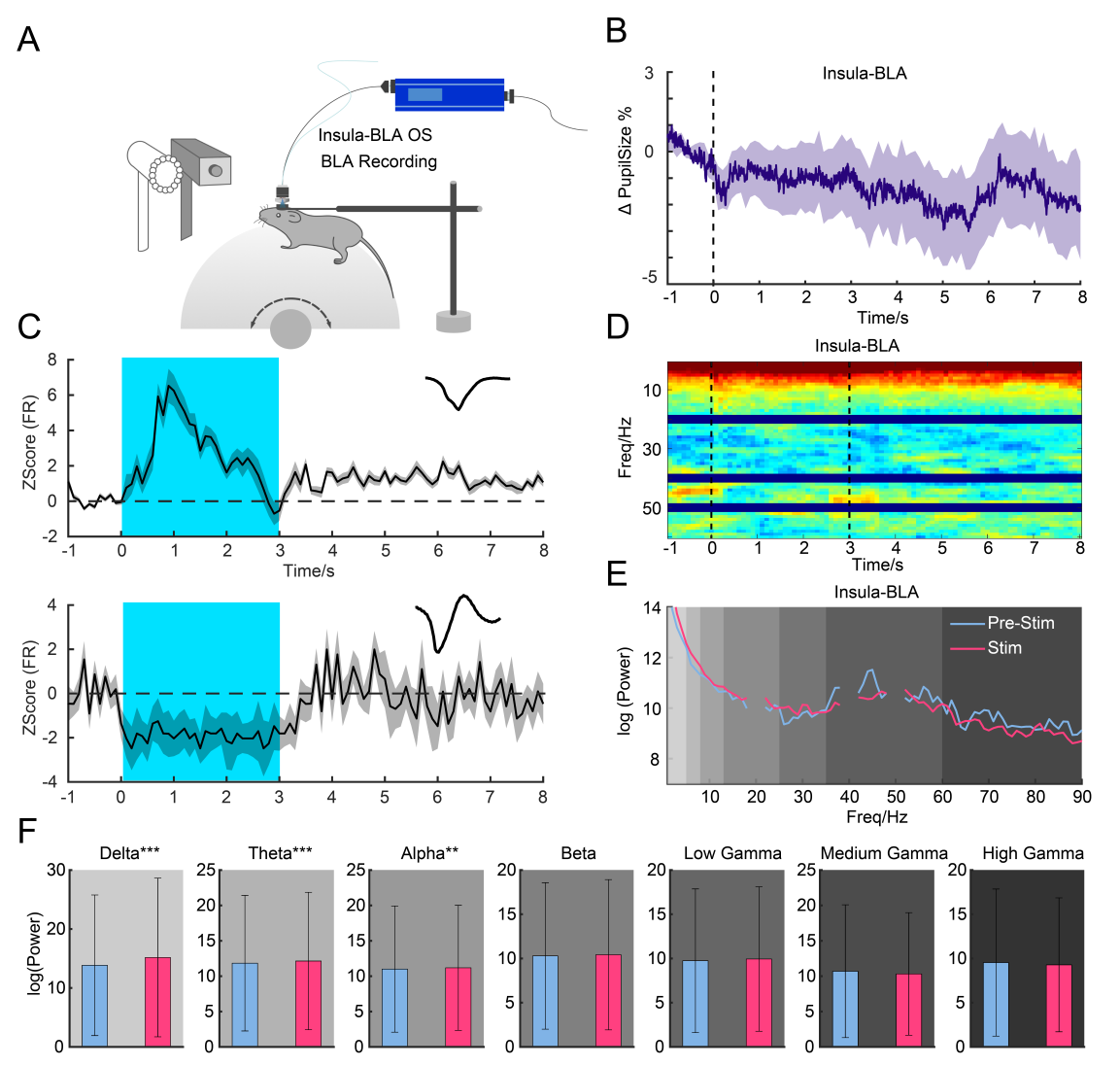
图8 岛叶-BLA通路调节BLA的振荡
研究发现啮齿动物面对重复视觉威胁刺激(LS)时有“持续逃跑(T1)” 和 “快速习惯化(T2)” 两种行为反应类型,T1组瞳孔大、逃跑比例高、反应潜伏期短,T2 组则相反且非选择性注意力增强。上丘(SC)、岛叶分别经不同通路投射到基底外侧杏仁核(BLA),SC-VTA-BLA 通路介导T1行为,SC-MD-BLA 和岛叶- MD-BLA 通路介导T2行为。内侧背核(MD)作为关键枢纽整合输入信号,调节唤醒和防御反应。该研究为理解情绪处理、行为适应性及相关神经精神疾病治疗提供了重要依据。
本文使用的工具病毒由布林凯斯提供:

同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。