睡眠需求的分子机制尚不明确,氧化应激被提出可能参与睡眠调控,但哺乳动物中证据有限。果蝇中氧化应激通过神经元线粒体通路诱导睡眠,但哺乳动物脑内活性氧(ROS)动态监测困难,缺乏直接证据。
2025年5月15日,中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)刘丹倩团队在Cell Metabolism在线发表题为“Hydrogen peroxide in midbrain sleep neurons regulates sleep homeostasis”的研究论文,该研究发现中脑黑质睡眠神经元的胞质过氧化氢(H₂O₂)水平与睡眠压力呈正相关,轻度H₂O₂通过激活TRPM2通道促进睡眠启动,而过量则导致睡眠碎片化和脑炎症。

该研究由中国科学院脑智卓越中心的博士研究生田玉静在刘丹倩研究员的指导下完成。脑智卓越中心康露伟、复旦大学脑科学转化研究院邓娟研究员及Ngoc T.Ha也为该研究作出了重要贡献。
早期使用脑匀浆或冷冻切片的研究未检测到睡眠剥夺后ROS积累,但蓝斑核(LC)的原位分析却显示存在氧化应激。传统方法缺乏对ROS的高时空精度在体测量,难以反映局部脑区的真实动态。为解决这一问题,作者首先对睡眠剥夺小鼠进行了全脑原位活性氧检测。在光照开始时间(ZT)0时腹腔注射二氢乙锭(DHE,一种超氧化物敏感染料,可穿透血脑屏障并在氧化时发出红色荧光)。随后,小鼠接受6小时睡眠剥夺(SD;ZT 0-6)或保持未干扰状态(图1A),之后进行灌注以进行DHE分析。量化脑区红色荧光强度结果发现,与以往研究一致,蓝斑核的DHE荧光强度增加(图1A-1C)。值得注意的是,两个促睡眠脑区—parafacial 区(PZ)和黑质网状部(SNr)—表现出显著的活性氧积累。
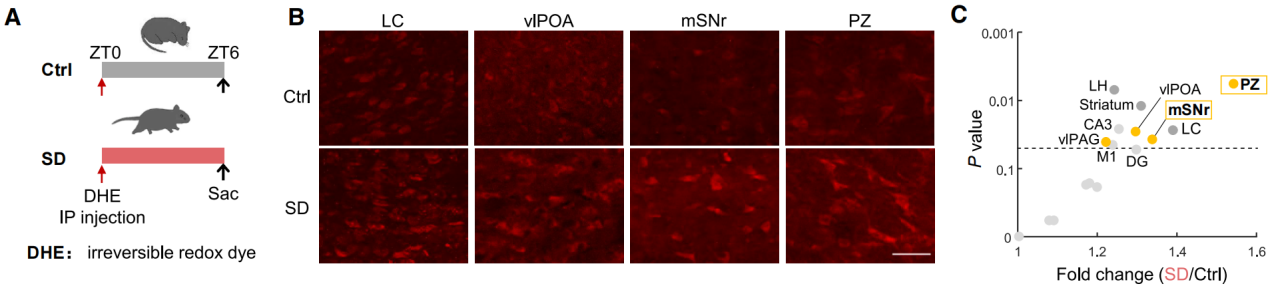
图1 睡眠缺失导致小鼠促睡眠脑区ROS积累
为了探究H₂O₂作为生理信号分子与睡眠的关系(图2D),将AAV-DIO-cyto-roGFP2-Orp1注射到vGat-Cre小鼠的PZ或Gad2-Cre小鼠的SNr中(图2E-2H),roGFP2-Orp1传感器可检测脑组织中生理性H₂O₂水平,PZ vGAT和SNr GAD2是睡眠相关神经元。利用光纤系统快速交替使用405nm和470nm两种激发波长,F405/F470比率可以反映H₂O₂的波动。结果显示睡眠剥夺(SD)期间,SNr神经元胞质H₂O₂迅速升高并在2.4%水平达到平台期,与睡眠压力的饱和指数增长一致(图2J)。睡眠恢复(SR)后,SNr的H₂O₂显著下降,而PZ无明显变化,表明SNr的H₂O₂积累与睡眠压力呈可逆关联(图2I-2K)。PZ的H₂O₂在SD后期缓慢升高,但恢复期间无变化,提示其ROS积累可能包含其他活性物质(如超氧化物),而非单纯H₂O₂(图2I)。正常对照小鼠中,SNr的H₂O₂在光照期(静息期)下降,黑暗期(活动期)升高,表明其受昼夜节律影响(图2J)。
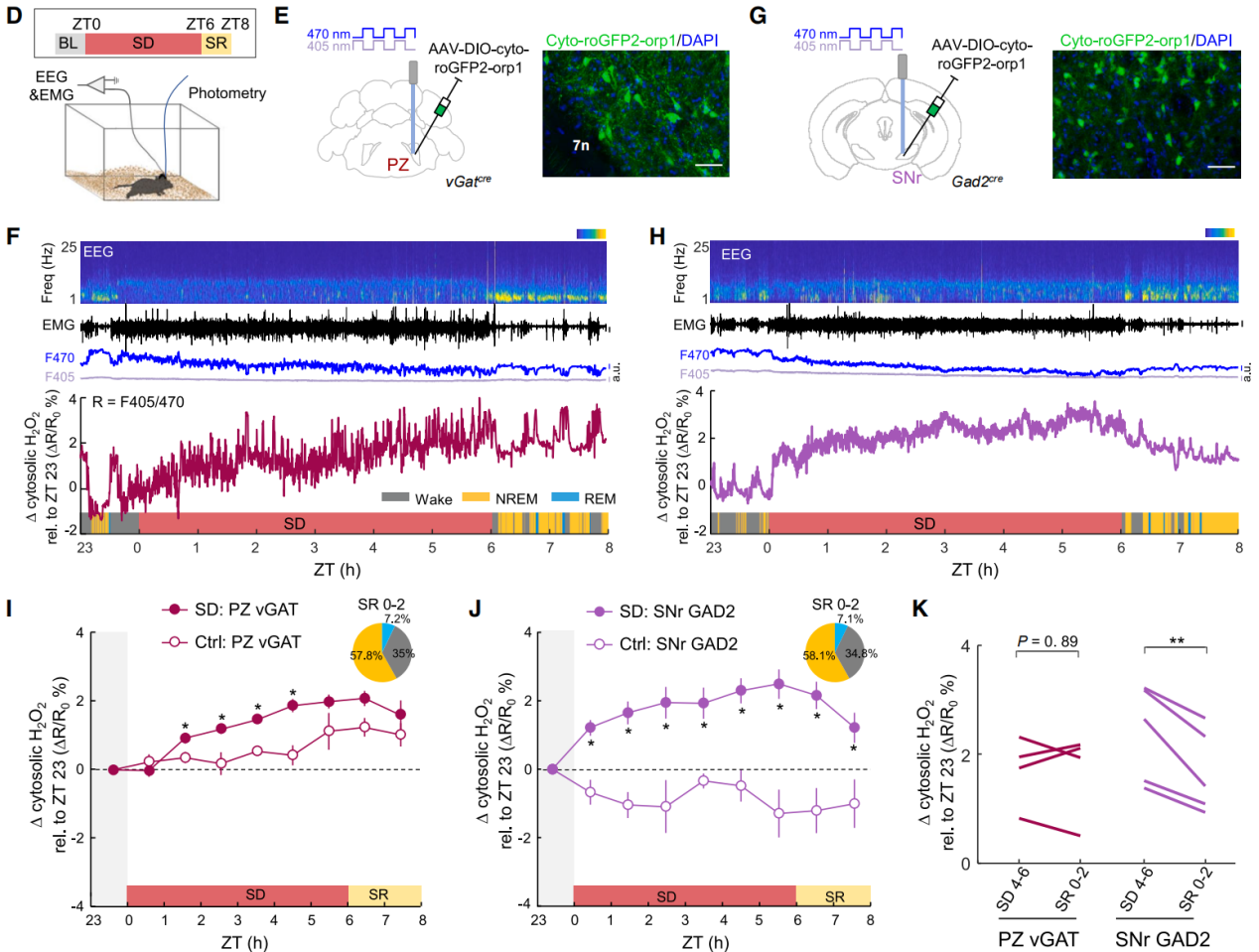
图2 SNr睡眠神经元胞质H₂O₂可作为长时间清醒期间睡眠压力的指标
线粒体靶向传感器(mito-roGFP2-Orp1)显示(图3A),SD期间线粒体H₂O₂无持续变化,排除了线粒体作为胞质H₂O₂来源的可能(图3B-3C)。抑制NADPH氧化酶(NOX)可阻断胞质H₂O₂积累,提示NOX是SNr神经元中H₂O₂的主要生成来源。综上所述,SNr睡眠神经元中胞质H₂O₂积累是长时间清醒期间睡眠压力的可靠标志物。
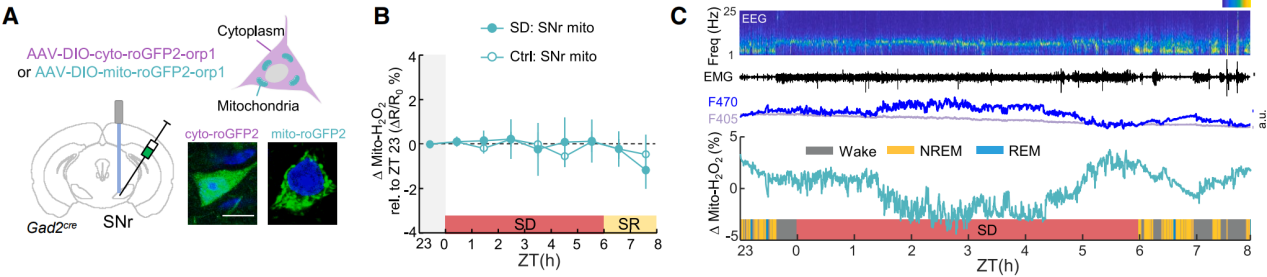
图3 在SD期间线粒体H₂O₂变化不参与胞质H₂O₂的积累
接下来研究了H₂O₂是否能追踪未受干扰状态下的自发睡眠-觉醒周期,区分胞质与线粒体H₂O₂的功能差异。测量了未受干扰的小鼠SNr GAD2神经元的胞质和线粒体H₂O₂动态,清醒期间,胞质和线粒体H₂O₂水平均高于非快速眼动(NREM)睡眠期,而在快速眼动(REM)睡眠期间两者波动较大(图4D-4G)。胞质H₂O₂在清醒与NREM睡眠间的差异显著更大(2H),表明其更敏感地反映觉醒-睡眠状态。睡眠开始后,线粒体和胞质H₂O₂均稳定下降,但只有睡眠起始时的胞质H₂O₂与睡眠δ功率相关(图4I-4J)。清醒开始后,线粒体H₂O₂几乎不升高,而胞质H₂O₂随清醒时间逐渐增加,与清醒时长呈正相关(图4I和4K)。在PZ睡眠神经元或其他SNr细胞群中未观察到这种相关性(图4H)。这些发现表明,SNr睡眠神经元的胞质H₂O₂也能反映自发睡眠压力动态,追踪清醒时长并影响睡眠强度。
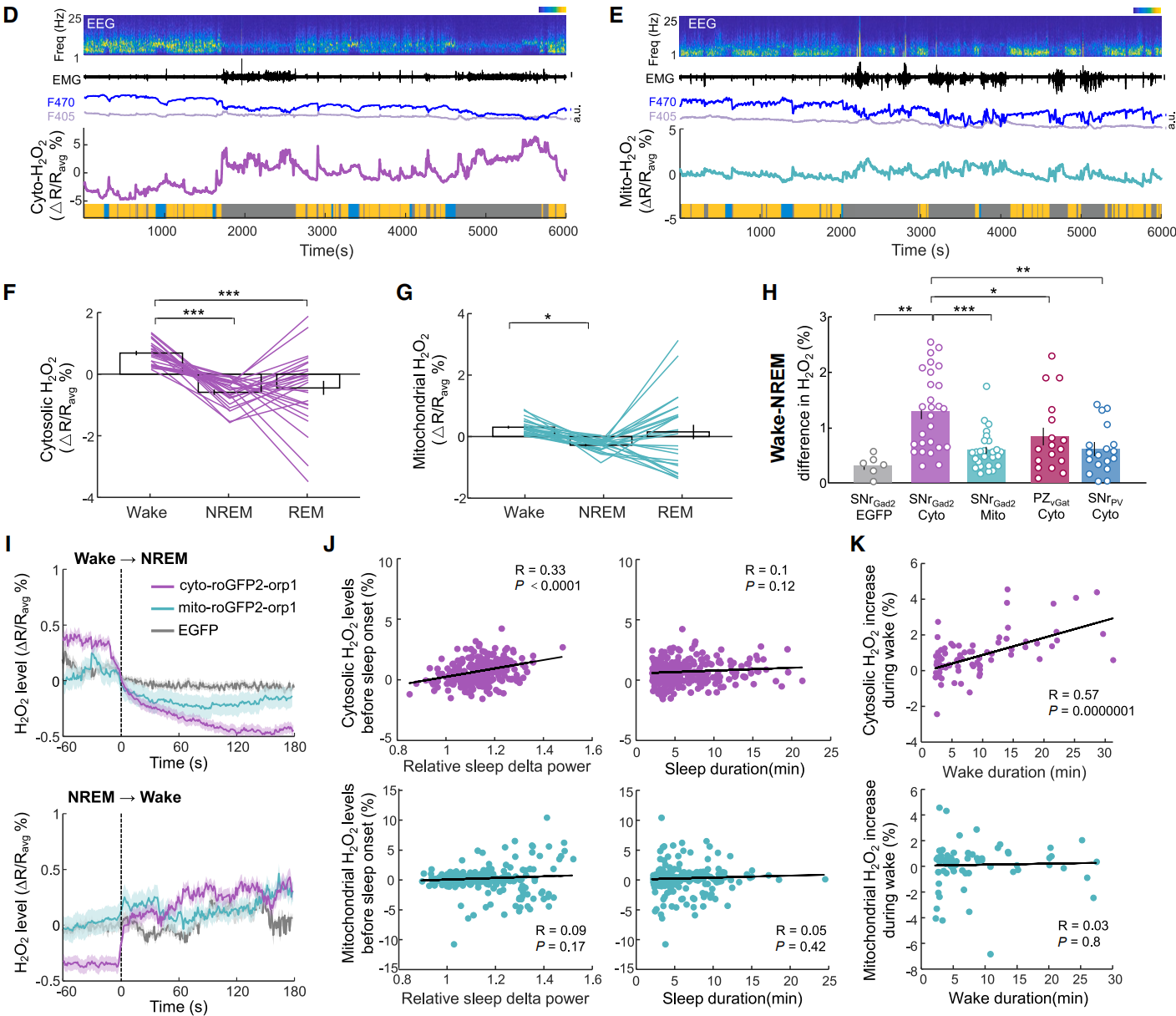
图4 SNr睡眠神经元胞质H₂O₂可追踪自发觉醒状态
为了确定H₂O₂是否主动调节睡眠,利用四环素诱导系统在SNr GAD2神经元中特异性过表达过氧化氢酶(一种降解细胞内H₂O₂的酶,图5A)。在睡眠记录前>12小时给予多西环素(dox)以确保过氧化氢酶充分表达。与对照条件相比,dox诱导的过氧化氢酶过表达显著减少了18小时睡眠恢复(SR)期间的代偿性睡眠,并降低了SD后即刻的睡眠δ功率(图5B-5C)。这些发现表明,SNr睡眠神经元中的胞质H₂O₂对调节睡眠量和强度至关重要,尤其是在反弹睡眠期间,突显了其在睡眠稳态中的关键作用。

图5 H₂O₂是睡眠调节的关键信号分子
为了确定胞质H₂O₂是否直接促进睡眠,将AAV-DIO-cyto-DAAO(DAAO,该酶可响应D-丙氨酸(D-ala)生成H₂O₂)和AAV-DIO-cyto-roGFP2-orp1共注射到Gad2-Cre小鼠的SNr中,以同时测量H₂O₂的生成(图6D)。实验发现在表达DAAO小鼠的脑室内(i.c.v.)输注D-ala可诱导剂量依赖性的H₂O₂升高:0.3-1mM D-ala引起轻度升高,而10mM D-ala则导致升高更显著(图6D-6E)。1小胶质细胞活化和炎症标志物(Iba1)免疫染色显示,10mM D-ala输注后信号增加,而1mM D-ala组则没有(图6F)。因此低剂量D-ala诱导轻度H₂O₂生成而无明显炎症,而高剂量D-ala则导致过量H₂O₂和炎症。
作者随后研究了H₂O₂升高对睡眠的影响,结果发现SNr睡眠神经元中H₂O₂轻度升高显著增加了NREM睡眠(图6G-6J),主要通过增强睡眠启动(图6K)。此外,给SNr表达mito-DAAO或PZ表达cyto-DAAO的小鼠输注1mM D-ala不影响睡眠(图6I),证明了SNr睡眠神经元中胞质H₂O₂的特异性作用。相比之下,SNr中高剂量H₂O₂升高(10mM D-ala)未改变总睡眠时间(图6G-6I),但导致睡眠碎片化,表现为NREM睡眠持续时间缩短和NREM到觉醒的转换增加(图6J-6K)。这种效应可能是与脑氧化应激和炎症相关的衰老和神经退行性疾病中睡眠障碍的基础。综上所述,黑质睡眠神经元中的胞质H₂O₂具有双重作用:轻度水平促进睡眠启动,而过量则诱导睡眠碎片化(图6L)。
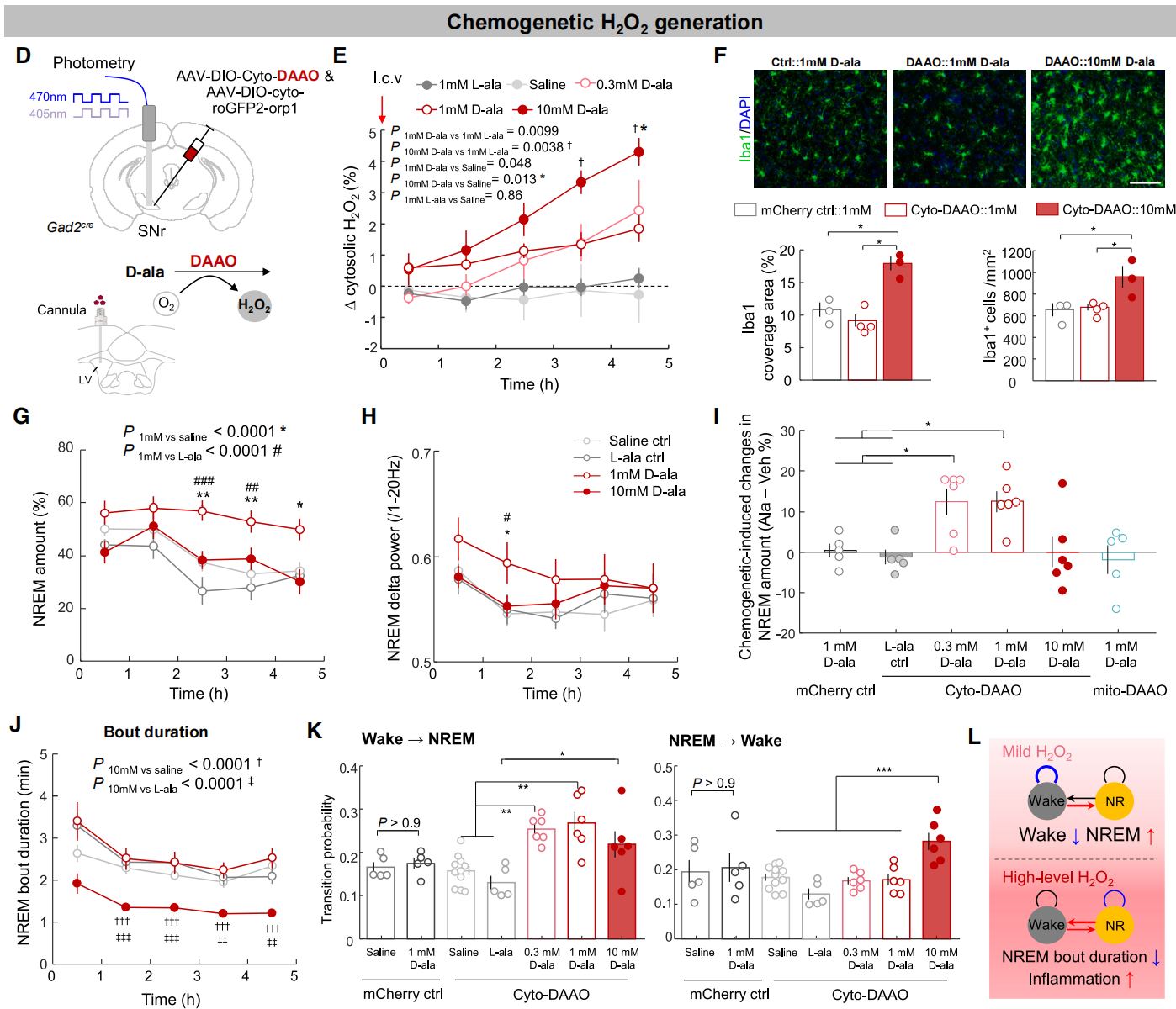
图6 校准黑质睡眠神经元H₂O₂生成可促进睡眠启动
接下来探讨了胞质H₂O₂如何调控睡眠启动。神经元激活标志物磷酸化S6(phospho-S6)免疫染色显示,1mM D-ala可显著增加表达DAAO神经元中phospho-S6阳性信号(图7A-7C),表明轻度H₂O₂可增强神经元活性。电生理记录也显示DAAO介导H₂O₂生成可引起神经元兴奋性可逆增加。先前研究表明,H₂O₂激活瞬时受体电位(TRP)通道会增强神经元兴奋性。随后检测了H₂O₂敏感的TRP通道的参与情况,结果发现TRP melastatin 2(TRPM2)在SNr中的mRNA 水平最高,且83.7%的GAD2神经元表达该通道。将AAV-DIO-cyto-DAAO和AAV-DIO-shTRPM2注射在SNr以进行基因敲降(图4D-4F)。结果发现scrambled对照小鼠中,1mM D-ala可促进NREM睡眠(图7G-7I),但在shTRPM2小鼠中,这种促睡眠效应及神经元兴奋性均被完全消除(图7F-7I )。TRPM2敲降还减少了睡眠恢复期间的睡眠量和δ功率(图7J-7K),并降低了光照期的基线NREM睡眠。综上所述,黑质睡眠神经元中的H₂O₂动态可追踪睡眠压力,并通过依赖TRPM2的方式调控睡眠稳态。

图7 轻度H₂O₂升高对神经元激活和睡眠促进的作用取决于TRPM2
该研究首次揭示了胞质H₂O₂作为 “氧化稳态信号” 的双重角色:生理性水平可将氧化应激转化为睡眠驱动力,病理性过量则破坏睡眠结构,为理解睡眠调控机制及氧化应激相关睡眠障碍(如衰老、神经退行性疾病)提供了新靶点。
本文使用的工具病毒布林凯斯均可提供:
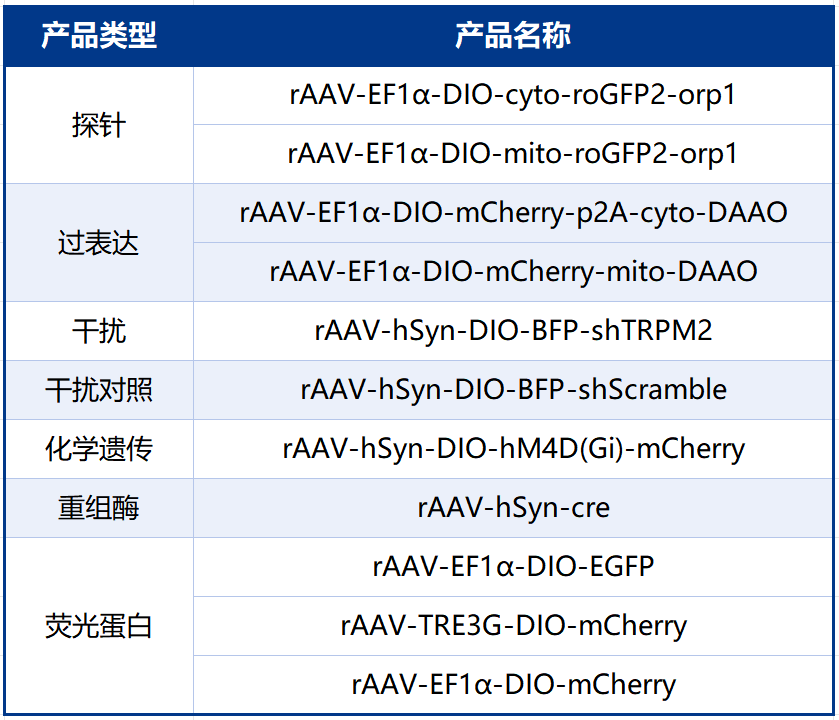
同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。