人类和啮齿类动物中,雄性和雌性对疼痛的反应存在差异,如雌性更易出现慢性疼痛,但雄性存在特异性疼痛超敏(如条件性疼痛超敏)。睾酮在雄性小鼠的伤害性感受系统中起关键作用,去势(手术切除生殖腺)可减轻疼痛超敏,而补充睾酮可恢复该表型,但具体神经机制不明。
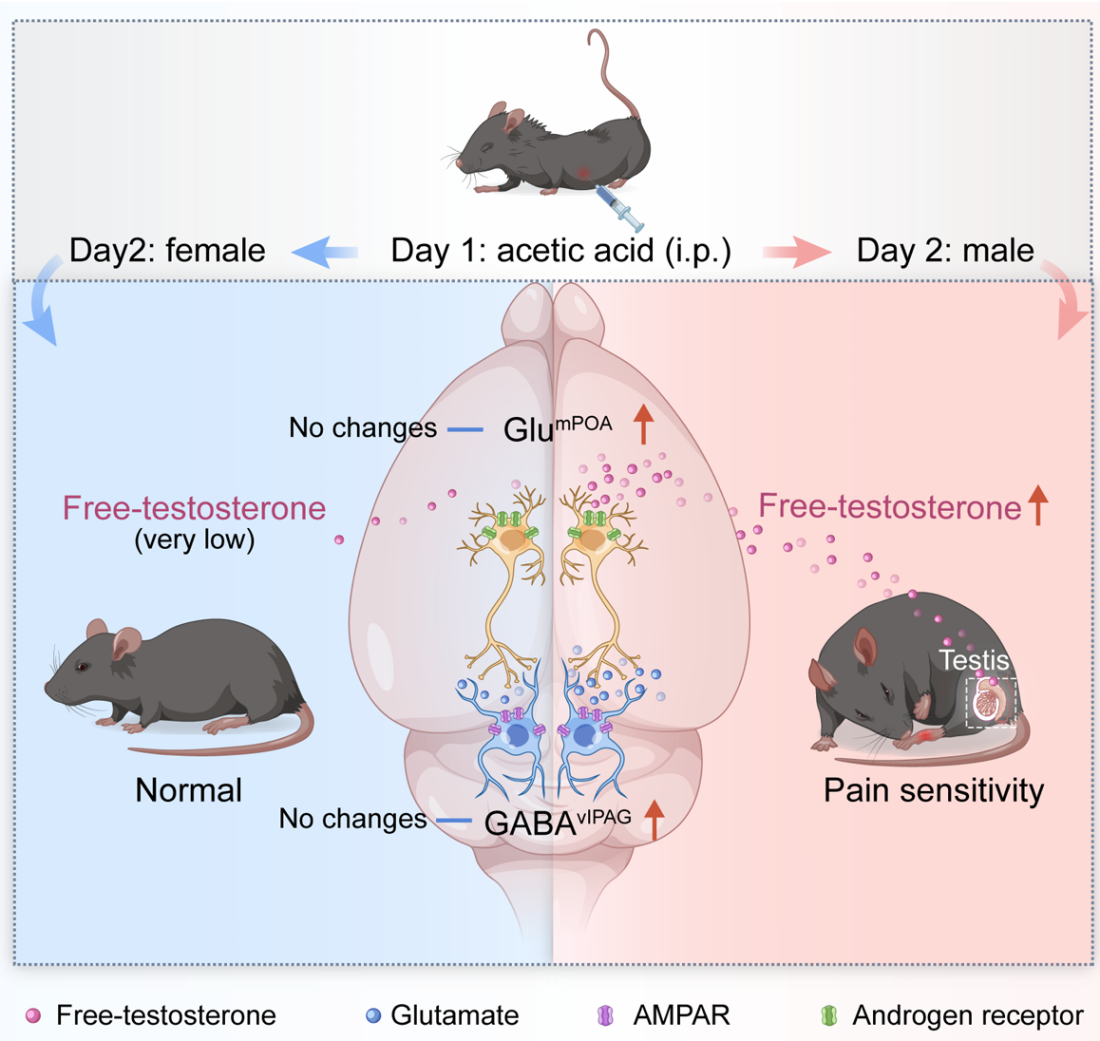
2025年4月17日,中国科学技术大学生命科学与医学部张智/曹鹏、中国科学技术大学第一附属医院李娟团队在Nature Communications期刊发表题为“A neural circuit for sex-dependent conditioned pain hypersensitivity in mice”相关文章,研究发现雄性小鼠中,游离睾酮通过激活内侧视前区(mPOA)的谷氨酸能神经元(Glu-mPOA)的雄激素受体信号,使其过度活跃,并通过兴奋性输入到腹外侧导水管周围灰质(vlPAG)的GABA能神经元(GABA-vlPAG),引发条件性疼痛超敏反应。

通过建立条件性情境疼痛超敏小鼠模型,研究性别特异性疼痛超敏(即疼痛敏化)的神经机制。在特定环境中通过腹腔注射乙酸(AA)诱导雄性和雌性小鼠腹部收缩,这在两性中均引起相同的扭体和收缩反应(图1a-c)。第二天监测小鼠暴露于与乙酸注射相同或不同环境时的机械痛阈值和热痛阈值(图1a)。观察到,雄性小鼠在暴露于相同环境(male-SC)时确实表现出疼痛超敏,而在不同环境(male-DC)中则没有;而雌性小鼠或生理盐水处理的对照组未观察到情境性疼痛超敏(图1d-e)。这种情境性疼痛超敏在雄性小鼠中持续至少5天(图1f-g)。此外在与疼痛相关的环境中,相同的听觉线索也可诱导雄性特异性情境性疼痛超敏(图1h-j)。
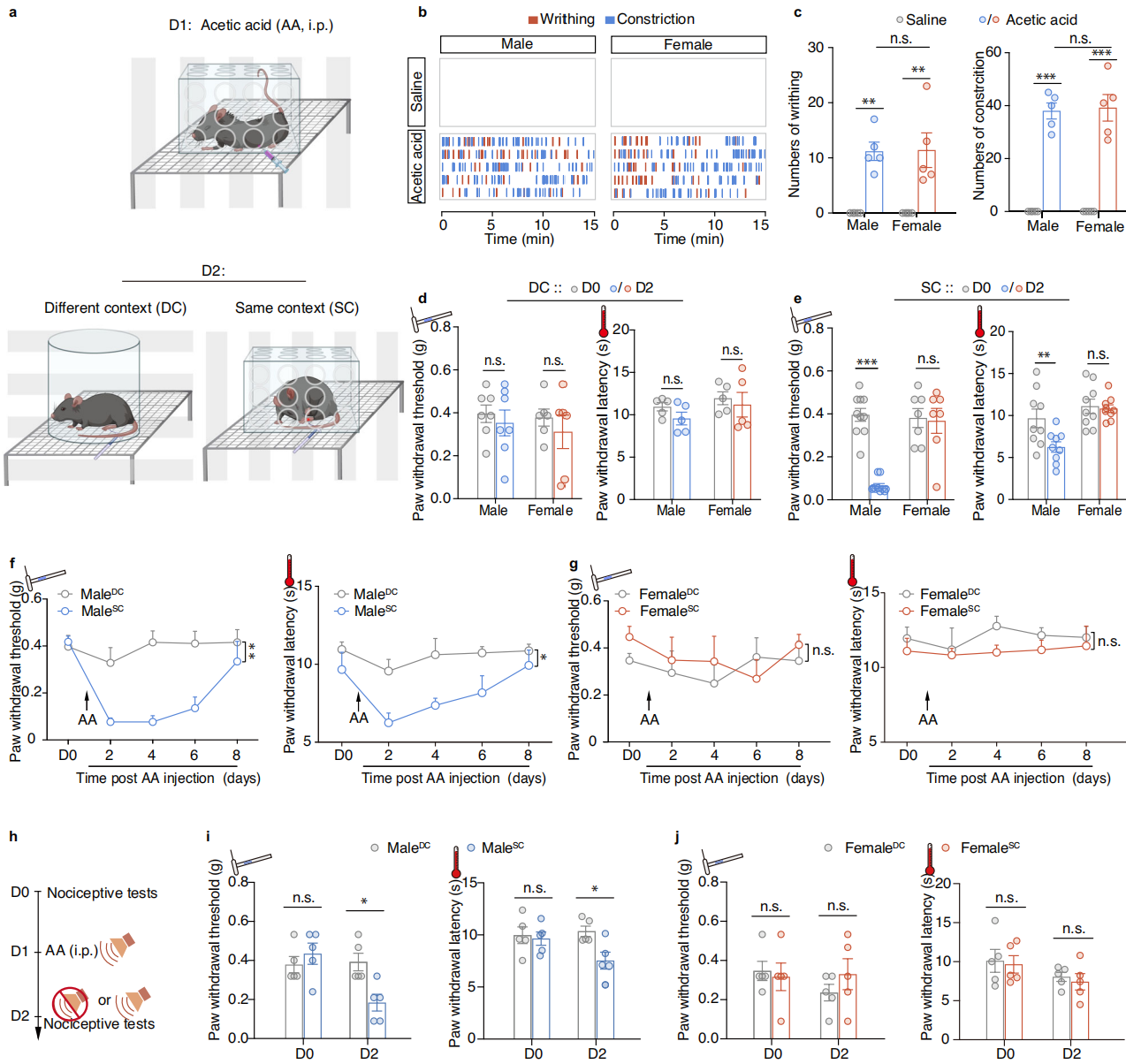
图1 雄性小鼠疼痛敏感性增强
为了验证Glu-mPOA神经元活动的增加是否归因于条件性情境疼痛超敏的建立所引发的变化,在自由活动的VgluT2-Cre小鼠中进行了光纤记录,小鼠的内侧视前区(mPOA)注射AAV-DIO-GCaMP6m(图2a-b)。结果显示,在乙酸注射后的第二天,表达GCaMP6m的Glu-mPOA神经元在male-SC小鼠中的活动显著高于 male-DC小鼠,而雌性组之间没有明显差异(图2c-e);在Vgat-Cre雄性或雌性SC小鼠中均未观察到此类活动增加。随后在自由活动的VgluT2-Cre小鼠mPOA注射AAV-DIO-ChR2进行体内多电极记录(图2f-h),结果显示两性小鼠在注射乙酸后5分钟,Glu-mPOA神经元的自发放电频率显著增加,但在3小时内恢复至基线水平。在第二天male-SC小鼠的自发放电频率显著高于male-DC 小鼠,而female-SC与female-DC小鼠之间则无差异(图2i-j)。Male-SC小鼠中 Glu-mPOA神经元活动的增加还表现出时间动力学变化,这与雄性特异性情境疼痛超敏行为随时间的变化显著相关(图1f)。
为了验证Glu-mPOA神经元是否介导了male-SC小鼠的疼痛超敏反应,将AAV-DIO-ChR2-mCherry病毒注入VgluT2-Cre小鼠的mPOA区域(图2k-l)。疼痛阈值测定和条件位置偏好测试显示,光激活Glu-mPOA神经元可在male-DC和female-DC小鼠中同时诱发疼痛超敏和位置回避行为(图2m-n)。光抑制表达AAV-DIO-eNpHR3.0-EYFP的Glu-mPOA神经元可消除male-SC小鼠的情境性疼痛超敏反应(图2o-q);然而,抑制Glu-mPOA神经元对第二天时female-SC小鼠的机械或热痛阈值均无影响(图2r)。对Glu-mPOA神经元进行化学遗传学抑制,结果显示在D2腹腔注射CNO后,male-SC小鼠的疼痛超敏反应被消除。
这些结果表明疼痛调节仅在雄性小鼠中诱导Glu-mPOA神经元发生情境依赖性过度活跃。
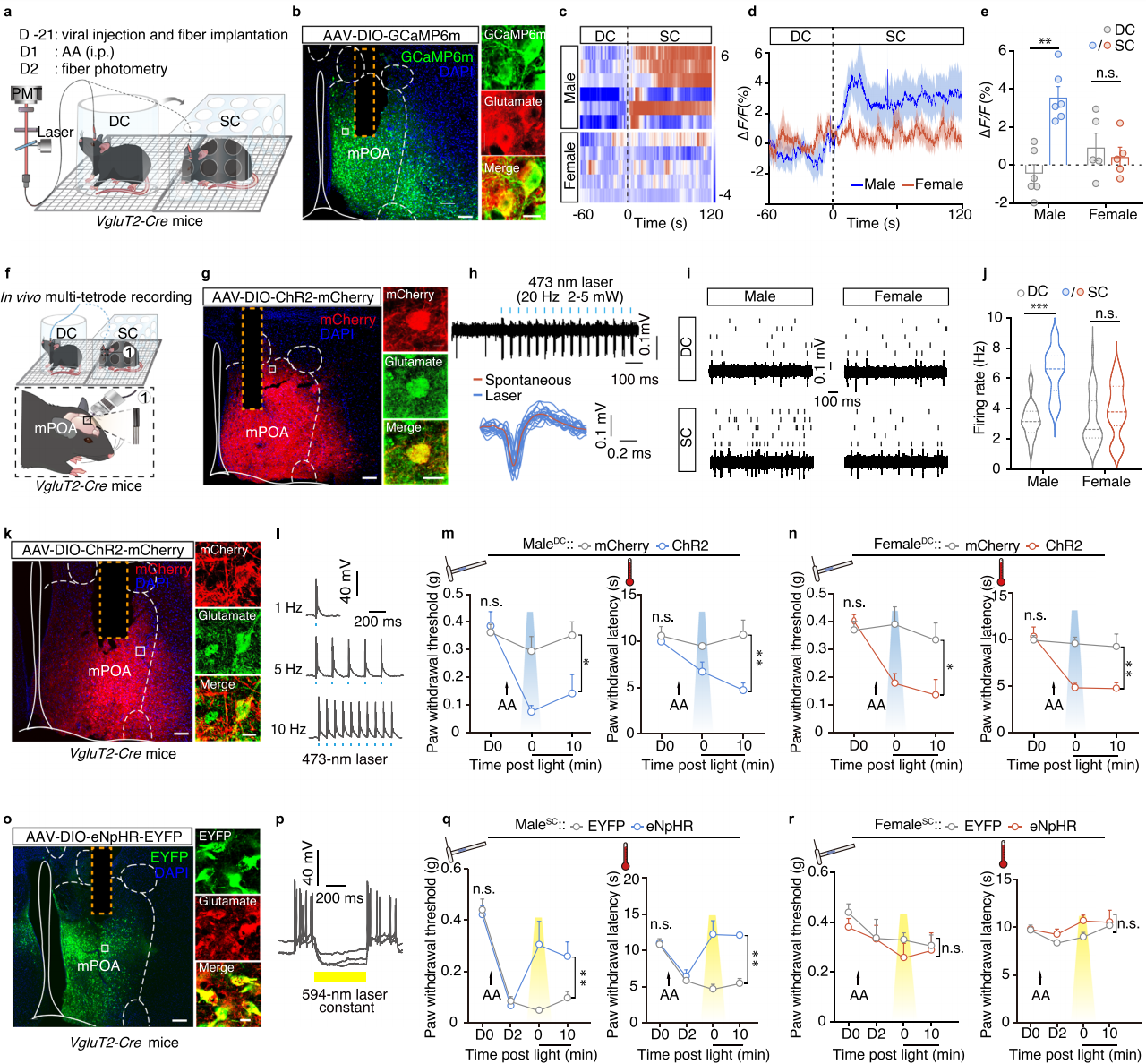
图2 条件性环境通过激活Glu-mPOA神经元引起疼痛过敏
游离睾酮作为睾酮的生物活性形式,可能通过雄激素受体调控雄性特异性情境性疼痛超敏。血清和血浆中游离睾酮的ELISA检测显示,male-SC小鼠的游离睾酮水平显著高于male-DC小鼠和未处理的雄性小鼠,且这种升高持续至D4,到D8时恢复基线水平(图3a)。为了研究人为降低游离睾酮对雄性小鼠情境性疼痛超敏的影响,研究人员对小鼠进行了去势手术(手术切除动物生殖腺),并随后每日皮下注射睾酮类似物丙酸睾酮,以恢复去势雄性小鼠的游离睾酮水平(图3b-c)。结果表明去势手术(雄性小鼠)后,male-SC小鼠的机械痛阈值(PWT)和热痛潜伏期(PWL)显著升高(疼痛超敏减轻),同时 Glu-mPOA 神经元活动降低(图 3d-g)。补充丙酸睾酮后,去势 male-SC小鼠的 PWT/PWL 降低(疼痛超敏恢复),表明睾酮直接驱动疼痛表型(图3d-e)。未处理雌性小鼠(female-SC)无疼痛超敏,但丙酸睾酮处理后,female-SC小鼠出现类似雄性的疼痛超敏表型(PWT 降低),且与载体对照组有显著差异(图3h-j)。外源性睾酮可诱导雌性小鼠产生雄性特异性疼痛表型,提示睾酮是性别差异的核心因素。卵巢切除(OVX)的雌性小鼠中建立了情境性疼痛超敏模型(图3k),结果表明OVX female-SC小鼠本身不表现疼痛超敏,但补充丙酸睾酮后可诱导疼痛超敏,排除雌激素干扰(图3l)。综述所述,游离睾酮通过雄激素受体介导雄性特异性情境性疼痛超敏,且该作用不依赖雌激素。
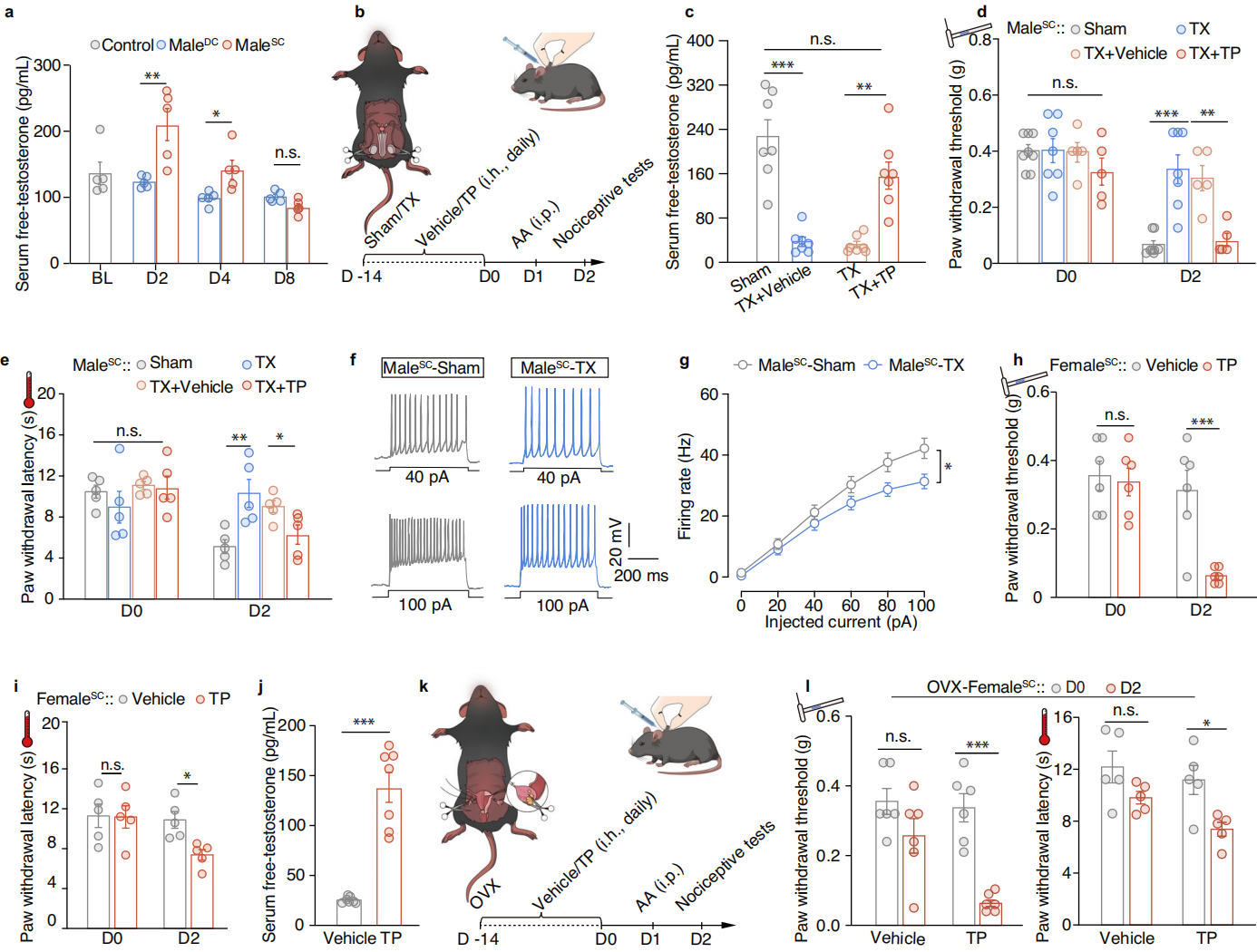
图3 游离睾酮有助于雄性特异性的情境疼痛高敏感性
急性应激通过升高皮质酮产生镇痛作用,慢性应激则诱发疼痛敏化,但需明确皮质酮是否参与雄性特异性情境性疼痛超敏。为了探究应激是否参与雄性特异性情境性疼痛超敏的形成,研究人员在第二天测试前 30分钟对 male-SC小鼠皮下注射皮质酮合成抑制剂(美替拉酮)(图4a),发现美替拉酮处理后,male-SC 小鼠的机械/热痛阈值恢复至正常水平,Glu-mPOA神经元过度活动被抑制(图 4b-d)。美替拉酮处理的male-SC小鼠的血清皮质酮和游离睾酮水平显著降低,但去势实验显示皮质酮升高与疼痛超敏无直接关联(图4e-f)。结果表明,雄性特异性情境性疼痛超敏需要的是游离睾酮,而非皮质酮。
鉴于不同的疼痛相关环境可诱导雄性特异性情境性疼痛超敏,推测记忆系统可能触发了这一反应。在第二天向male-SC小鼠的背侧海马CA1区(dCA1)递送 PKMζ 抑制剂Zeta抑制肽(ZIP),以抑制情景记忆的形成(图4g)。结果发现,ZIP处理的male-SC小鼠的条件性情境疼痛超敏被消除,且血清皮质酮和游离睾酮浓度显著低于载体处理的对照组(图4h-j)。直接注射了表达破伤风神经毒素的AAV病毒(AAV-hSyn-TetTox-EGFP)来灭活雄性小鼠dCA1区的突触传递(图4k)。结果发现,TetTox 感染的male-SC小鼠的条件性情境疼痛超敏和Glu-mPOA神经元的过度活跃均被逆转(图4l-q)。发现表明,情景记忆确实是触发雄性特异性情境性疼痛超敏的原因。
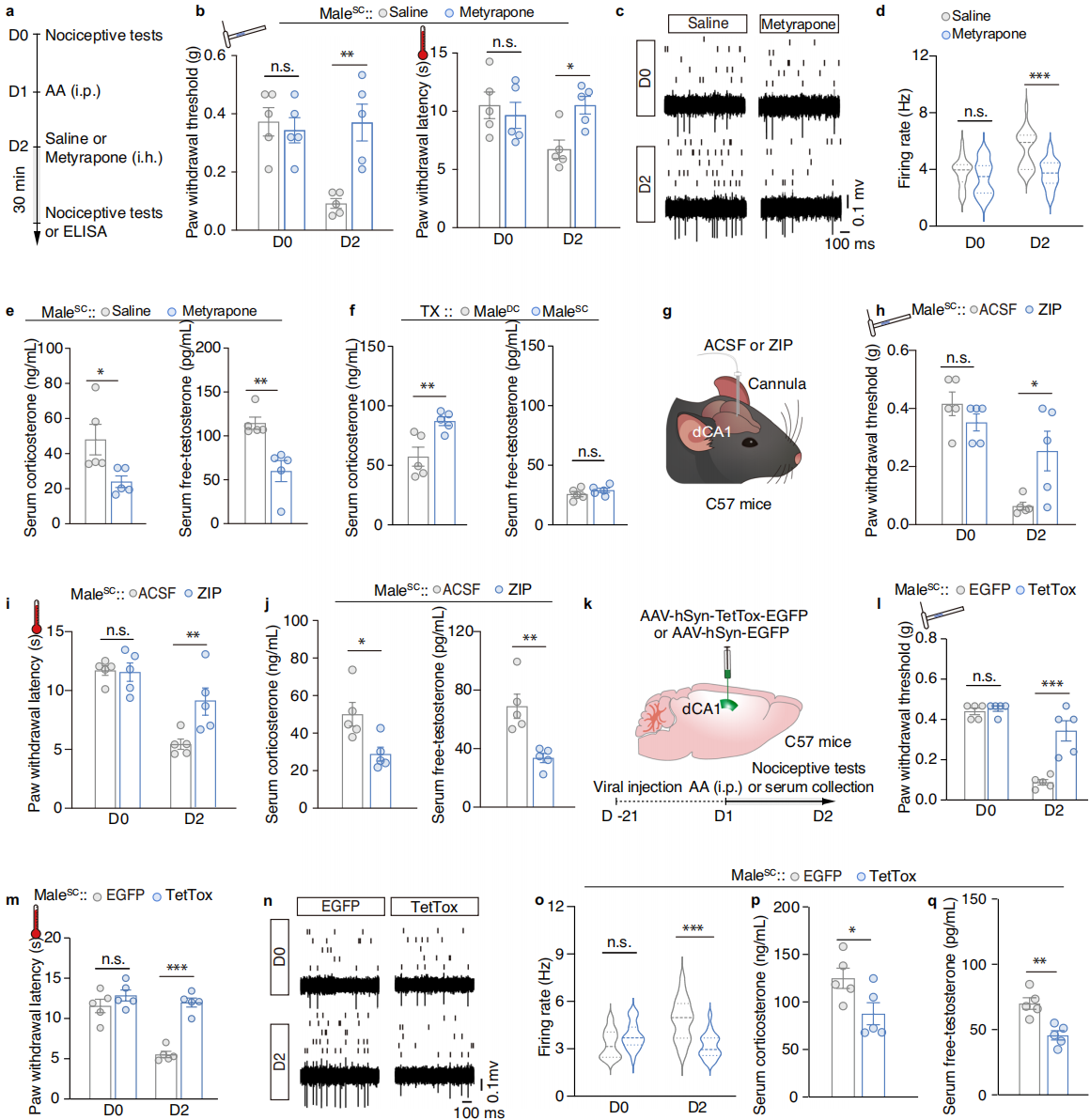
图4 应激和记忆系统调节雄性特异性的情境性痛觉过敏
体内微透析结合ELISA结果显示,与male-DC小鼠和未处理雄性小鼠相比,male-SC小鼠在D2时mPOA区的游离睾酮含量显著升高(图5a-b)。在含有0.05 μM、0.3 μM和1 μM丙酸睾酮的mPOA脑片上进行全细胞记录,发现0.3 μM和1 μM丙酸睾酮处理的Glu-mPOA神经元放电频率增加(图5c-d)。
为实时监测人为操纵雄激素水平诱导雄性情境性疼痛超敏模型小鼠的Glu-mPOA神经元活动变化,对去势雄性小鼠进行了体内多电极记录。结果显示,去势male-SC小鼠的Glu-mPOA放电频率显著低于假手术male-SC对照组,每日注射丙酸睾酮可恢复至对照组水平(图5e-f)。在自由活动雄性小鼠的体内光纤记录结果发现,丙酸睾酮注射可恢复去势male-SC小鼠的Glu-mPOA神经元活动(图5g-i)。此外,向未处理雄性小鼠的mPOA微注射丙酸睾酮,与载体处理对照组相比,其爪退缩阈值和潜伏期降低。综述所述,游离睾酮水平升高可通过增强雄性小鼠Glu-mPOA神经元的兴奋性引发情境性疼痛超敏反应。
随后注射AAV-shAR-EGFP病毒以诱导VgluT2-Cre小鼠的Glu-mPOA神经元中雄激素受体敲低(图5j-k)。Glu-mPOA特异性雄激素受体敲低的male-SC小鼠的爪退缩阈值和潜伏期显著升高(图5l)。体内多电极记录显示,在D2时,雄激素受体敲低的male-SC小鼠的Glu-mPOA神经元自发放电频率显著低于AAV-EGFP对照组,但AAV-shAR-EGFP和AAV-EGFP感染的male-DC组之间的放电频率无差异(图5m-n)。此外,向AAV-EGFP感染的未处理雄性小鼠的mPOA输注丙酸睾酮可显著降低其爪退缩阈值和潜伏期,而AAV-shAR-EGFP感染的小鼠则无此效应(图5o-p)。综上所述,游离睾酮通过雄激素受体依赖性方式诱导雄性小鼠的情境性疼痛超敏反应。
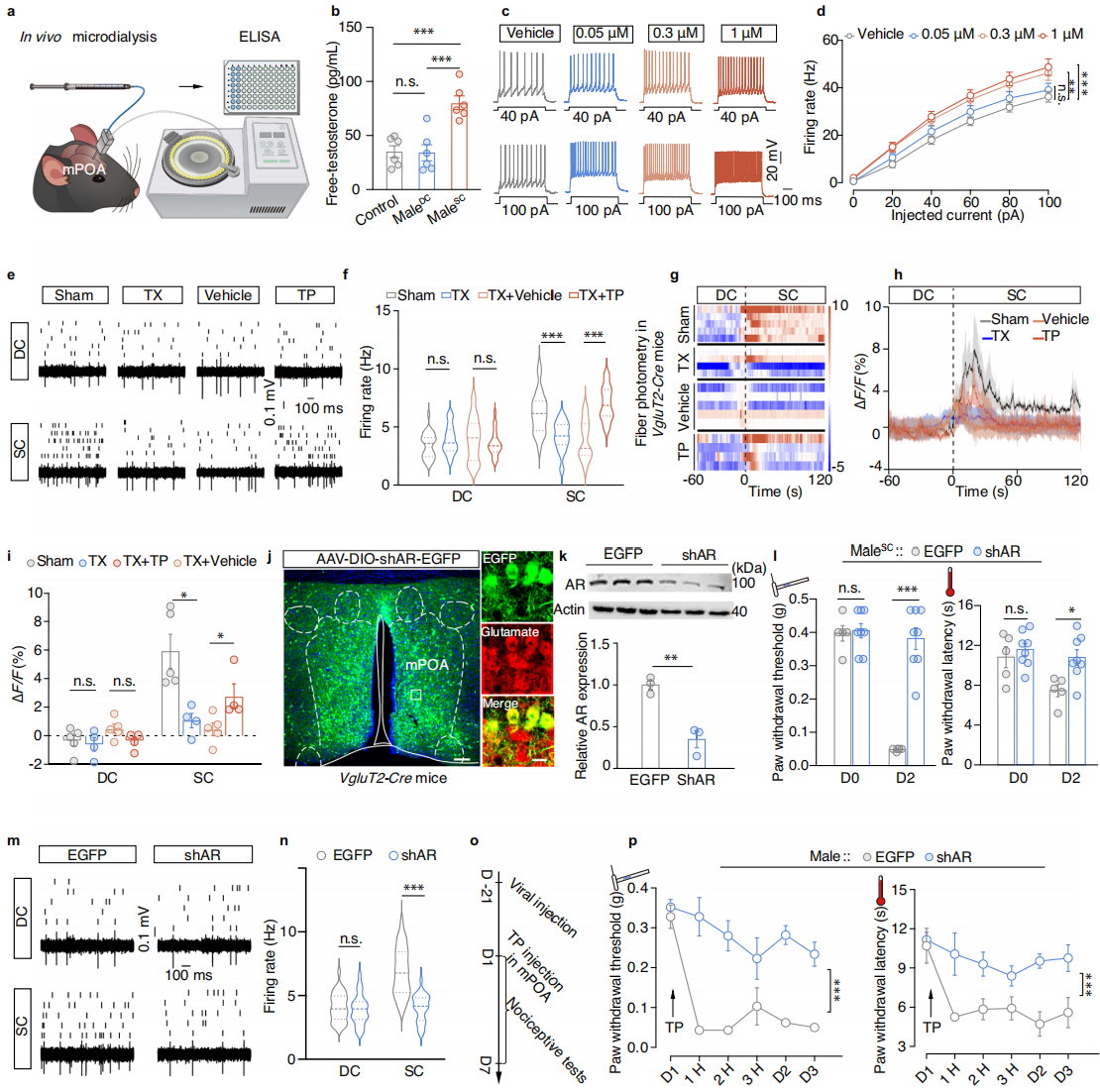
图5 雄激素受体对情境疼痛高敏感性的影响
有研究提示mPOA可能参与疼痛调控,但其尚未被视为疼痛处理的经典脑区。向VgluT2-Cre小鼠的mPOA注射AAV-DIO-ChR2-mCherry病毒进行顺行示踪,以探究Glu-mPOA神经元支配的脑区(图6a)。结果显示,发现Glu-mPOA 神经元的mCherry+神经末梢,分布于多个脑区,其中腹外侧导水管周围灰质(vlPAG)的信号最密集(图6b)。为明确mPOA→vlPAG投射的细胞类型,向C57小鼠的mPOA注射AAV2/1-Cre-EGFP病毒,并向vlPAG 注射 AAV-DIO-EGFP 病毒(图6c-d)。三周后发现,vlPAG内EGFP+神经元多数与 GABA 抗体共染(图6e-f)。此外,向vlPAG注射retroAAV-hSyn-EGFP进行逆行示踪,发现mPOA的EGFP+神经元主要与谷氨酸抗体共染。进一步在雄性和雌性 Vgat-Cre 小鼠的 vlPAG 注射改良狂犬病毒(EnvA 假型 RV-ΔG-EGFP)及辅助病毒(AAV-Ef1α-DIO-TVA-mCherry和AAV-Ef1α-DIO-RVG),结果显示 mPOA 内存在大量与谷氨酸抗体共染的EGFP+神经元。这些结果表明,雌雄小鼠均存在Glu-mPOA→GABA-vlPAG的神经连接。
为进一步阐明Glu-mPOA→GABA-vlPAG连接的功能,进行了光遗传学实验(图6g)。脑片全细胞记录显示,短暂光刺激 vlPAG 内表达 ChR2 的 Glu-mPOA 神经末梢,能在 GABA-vlPAG 神经元上诱发兴奋性突触后电流,且可被 AMPA受体拮抗剂阻断(图6h, i)。这表明GABA-vlPAG 神经元接受来自Glu-mPOA神经元的功能性单突触兴奋性谷氨酸能投射。
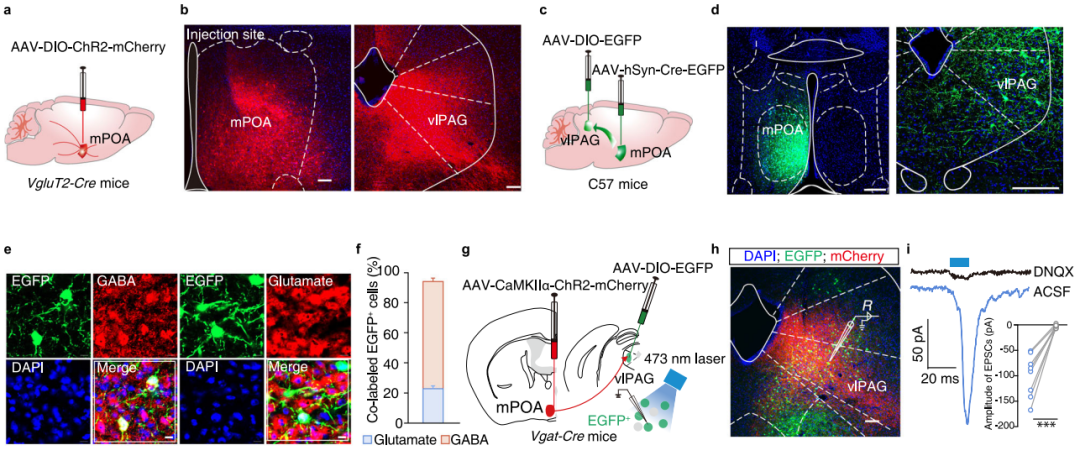
图6 兴奋性Glu-mPOA→GABA-vlPAG通路
为了验证情境性疼痛超敏模型小鼠中GABA-vlPAG神经元的活动增加是否源于Glu-mPOA神经元增强的兴奋性输入,向C57小鼠的mPOA注射AAV-DIO-hM4Di-mCherry,并向同侧vlPAG注射retroAAV-Cre(图7j)。随后,化学遗传学抑制投射至vlPAG的Glu-mPOA神经元,导致表达hM4Di的male-SC 小鼠的爪退缩阈值和潜伏期升高(图7k-l)。此外,激活vlPAG中的Glu-mPOA神经末梢可在male-DC和female-DC小鼠中诱发疼痛超敏和位置回避(图7m-n)。相反,抑制 Glu-mPOA→GABA-vlPAG 通路可减轻male-SC小鼠的情境性疼痛超敏(图7o-p)。值得注意的是,由于female-SC小鼠不表现情境性疼痛超敏,光抑制该通路对其伤害性阈值无显著影响。这些结果表明,Glu-mPOA→GABA-vlPAG 通路在情境性疼痛超敏的发生过程中起重要作用。
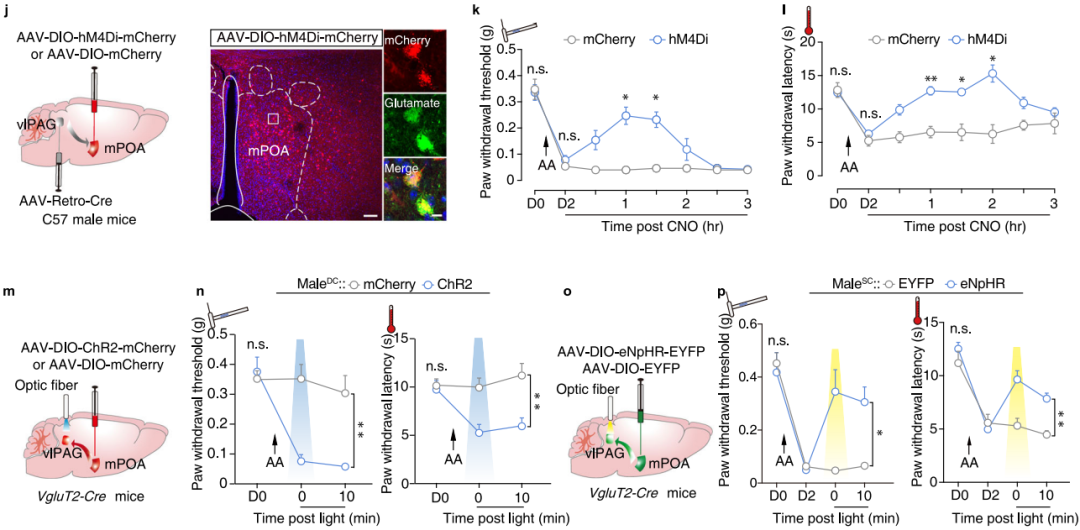
图7 Glu-mPOA→GABA-vlPAG通路在雄性情境性疼痛高敏感性中的重要作用
本文首次揭示雄性特异性疼痛超敏的神经环路及激素调控机制,为理解疼痛的性别差异提供了“记忆-激素-神经通路”的完整解释链,提示靶向雄激素受体或 Glu-mPOA→vlPAG通路可用于男性特异性疼痛治疗,并强调在疼痛研究和临床中需考虑性别因素对疗效的影响。
本文使用的来自布林凯斯的病毒产品列表如下:
同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。