恐惧消退是生物重新适应环境的重要过程,其功能缺陷与多种精神疾病相关,如创伤后应激障碍(PTSD)和焦虑症。当前基于暴露的疗法对恐惧和焦虑相关疾病疗效有限,此前研究多关注神经回路在恐惧消退中的作用,而星形胶质细胞和乙酰胆碱(ACh)信号在其中的作用尚不明确。
2025年4月4日,浙江中医药大学陈忠教授、汪仪研究员团队在Science Advances上发表了题为“Cholinergic signaling to CA1 astrocytes controls fear extinction”的研究论文,研究发现海马CA1区星形胶质细胞在恐惧消退过程中展现出全新的Ca2+动态变化。抑制该变化会阻碍恐惧消退,激活则促进其发生。研究揭示,后基底前脑(pBF)的胆碱能输入经烟碱型乙酰胆碱受体的α4和α7亚基,驱动CA1星形胶质细胞的Ca2+动态变化。

为探究星形胶质细胞是否参与恐惧消退过程,采用了情境恐惧消退范式。消退组:第1天接受情境恐惧条件反射(CFC)训练,足部电击;第2天,小鼠被放回训练箱中40分钟,期间不给予足部电击,进行情境恐惧消退训练。第3天,小鼠在训练箱中接受5分钟的消退记忆提取测试(图 1C)。非消退组:第1天和第3天与消退组相同的实验流程,但在第2天待在它们的饲养笼中,不进行消退训练(图 1B)。非条件反射组:第2天和第3天接受与消退组相同的实验流程,但在第1天不接受足部电击(图 1A)。在第2天行为测试后,通过免疫组织化学方法检测星形胶质细胞中即早基因Fos的活性依赖性表达。评估了多个脑区星形胶质细胞中Fos细胞的表达情况。分析显示,在背侧海马CA1区(dCA1),与非消退组和非条件反射组相比,只有消退组中 Fos⁺GFAP⁺双阳性/GFAP⁺细胞的比例显著升高(图 1A-D);非消退组和非条件反射组之间没有差异(图 1A-D)。这些结果表明,在恐惧消退过程中,海马dCA1区星形胶质细胞会特异性地产生新的活动。
使用光纤钙成像技术以动态记录在CFC、情境恐惧消退以及消退记忆提取过程中dCA1星形胶质细胞的活动(图 1E)。将AAV-GfaABC1D-GCaMP6f注射在dCA1脑区,对dCA1中表达GCaMP6f的细胞与GFAP共染色,83.7%的GCaMP6f阳性细胞是GFAP阳性的星形胶质细胞(图 1F-G),且CA1区62.0% 的GFAP阳性星形胶质细胞表达GCaMP6f(图 1F-G),然而用NeuN染色的神经元未检测到任何GCaMP6f 信号(图 1F)。行为实验结果显示动物在CFC训练后僵冻水平显著升高,在恐惧消退后降低(图 1I),而在CFC训练后,星形胶质细胞的Ca2+反应并没有立即改变(图 1J)。但是,在第二天的消退训练中,当小鼠被放回训练环境时,星形胶质细胞的钙离子反应增强(图 1H和J)。此外,星形胶质细胞的Ca2+反应与恐惧消退期间的僵冻水平呈负相关(图 1K),这表明星形胶质细胞的Ca2+反应可能对恐惧消退起到促进作用。
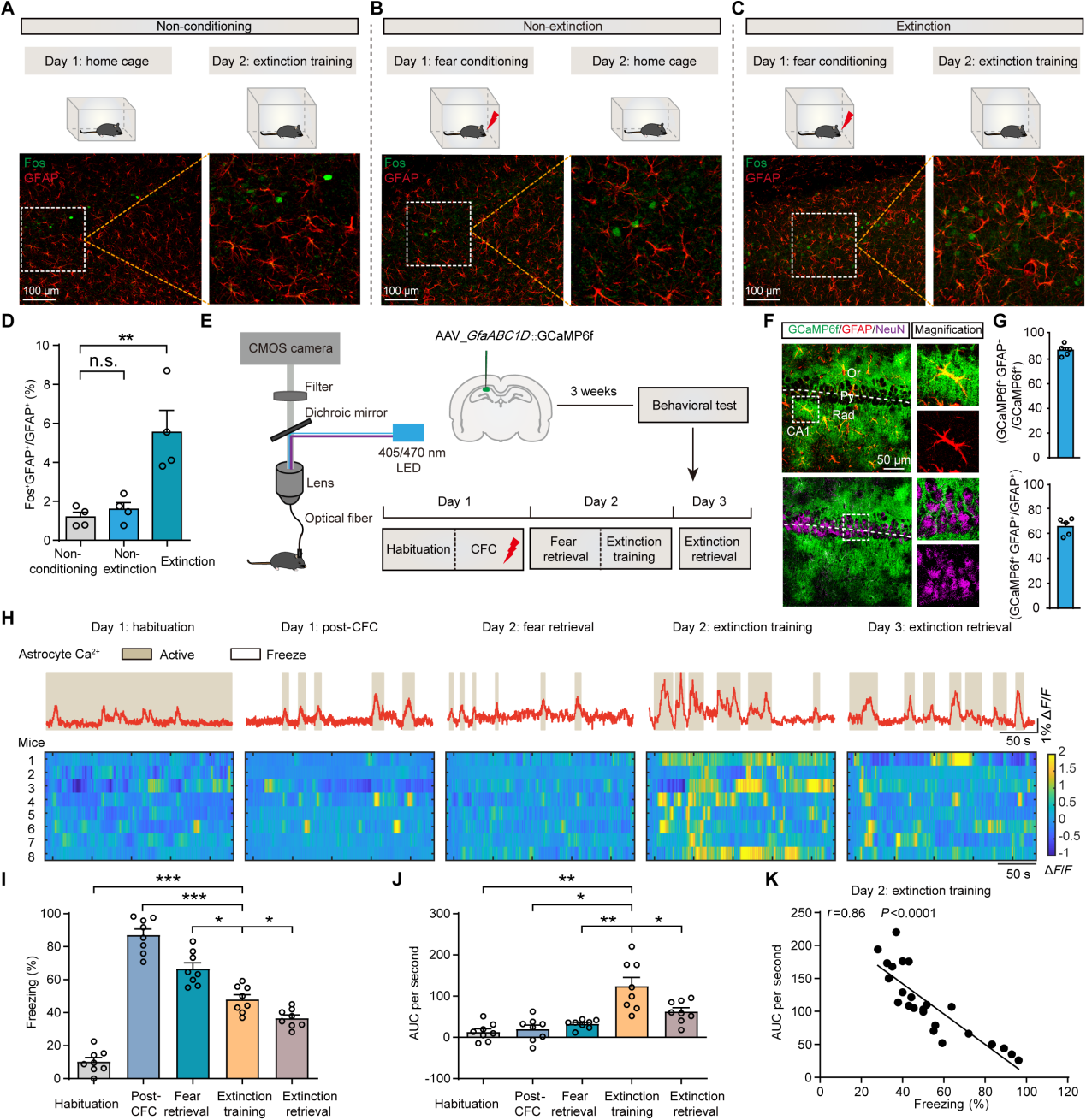
图1 情境恐惧消退过程中海马CA1星形胶质细胞Ca2+反应
为了测试星形胶质细胞的Ca2+活动是否是恐惧消退所必需的,将AAV-GfaABC1D-hPMCA2w/b注射在海马区来减弱星形胶质细胞的活动(图2A-B)。免疫组化结果显示hPMCA2w/b在GFAP+星形胶质细胞中特异性表达,而在NeuN+神经元中未检测到表达(图 2C)。光纤钙成像技术记录dCA1星形胶质细胞的Ca2+信号,可以观察到与对照组小鼠相比,hPMCA2w/b组小鼠在恐惧消退过程中,新生星形胶质细胞Ca2+反应显著减弱(图 2D-E)。在行为学测试中,hPMCA2w/b小鼠在第2天表现出较慢的的消退曲线,在第3天表现出较高的僵冻水平(图 2F-I)。这些结果表明,新生诱导的海马CA1星形胶质细胞 Ca²⁺反应是恐惧消退所必需的。
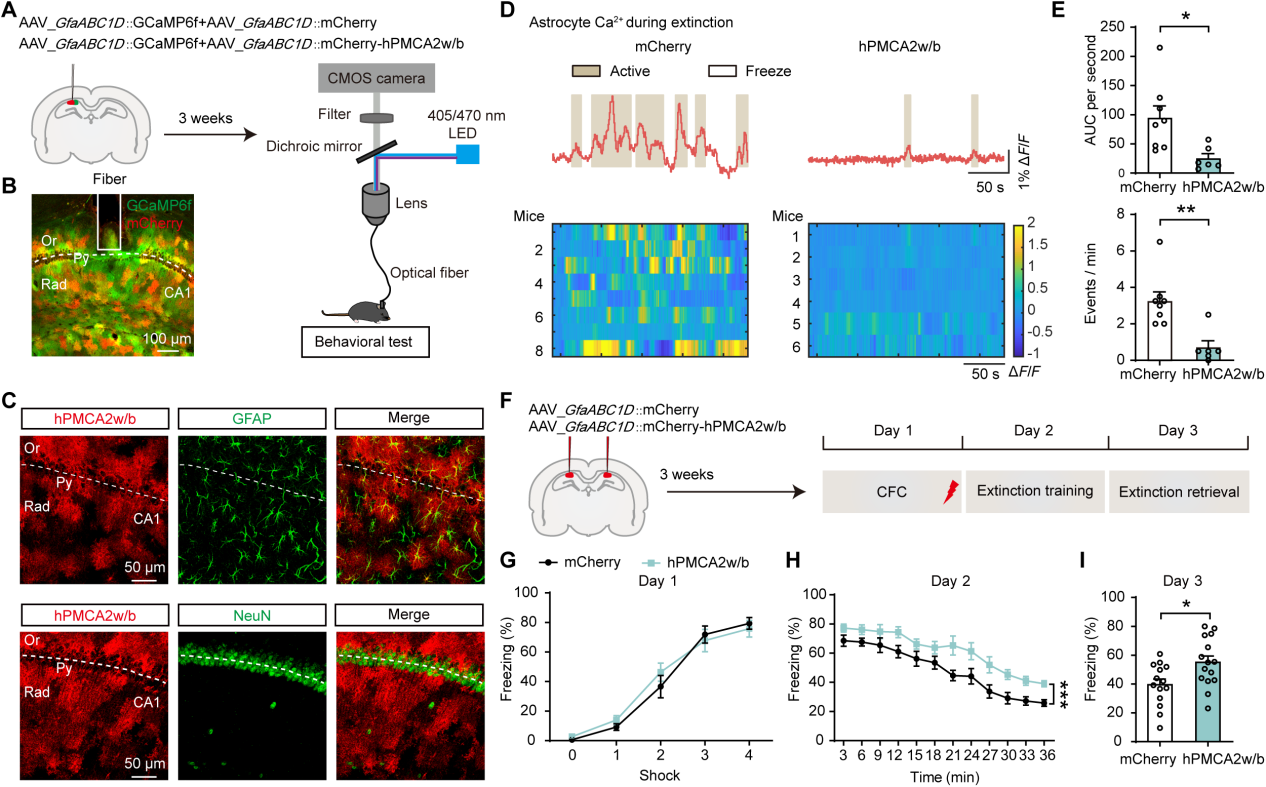
图2 抑制星形胶质细胞Ca2+信号传导可损害情境恐惧消退
在星形胶质细胞中持续表达的hPMCA2w/b无法精确地在时间上抑制星形胶质细胞的Ca2+信号传导,通过向dCA1区域注射AAV-GfaABC1D-ChR2-EGFP的病毒(图 3A-B),观察到95.5%的ChR2-EGFP⁺细胞是GFAP⁺星形胶质细胞,并且CA1区69.0%的GFAP⁺星形胶质细胞表达ChR2-EGFP(图 3B-C)。小鼠接受3天的情境恐惧消退实验(图 3D)。在第2天恐惧消退开始3分钟后,每隔60秒重复给予一次持续60秒的蓝色激光脉冲,以激发dCA1星形胶质细胞中表达的ChR2。结果显示光遗传激活星形胶质细胞增强了小鼠在第2天的恐惧消退学习能力,并降低了小鼠在第3天和第10天的僵冻水平(图 3D)。为了进一步区分星形胶质细胞在恐惧消退训练和恐惧消退记忆提取中的作用,在第3天恐惧消退记忆提取过程中对dCA1星形胶质细胞进行光遗传学激活,发现这种激活并未影响小鼠的僵冻水平(图 3E)。
为了进一步研究星形胶质细胞激活对恐惧消退的影响,向dCA1区域注射AAV-GfaABC1D-hM3Dq-mCherry的病毒(图 3F),结果发现91.8%的 hM3Dq-mCherry⁺星形胶质细胞为GFAP⁺,且CA1区69.8%的GFAP⁺星形胶质细胞表达hM3Dq-mCherry(图 3G-H)。在第2天恐惧消退训练前30分钟,给小鼠腹腔注射生理盐水(1mg/kg,hM3Dq+生理盐水)或氯氮平-N-氧化物(1mg/kg,mCherry+CNO、hM3Dq+CNO)。在消退训练期间化学遗传激活星形胶质细胞,同样增强了小鼠在第2天的恐惧消退学习能力,并降低了小鼠在第3天和第10天的僵冻水平(图 3I)。相比之下,在消退记忆提取过程中对星形胶质细胞进行化学遗传学激活,并未影响僵冻水平(图 3J)。综上所述,在dCA1区域使用光激活或化学激活增强星形胶质细胞的活性,能够加速恐惧消退。

图3 星形胶质细胞的激活促进了情境恐惧的消退
星形胶质细胞表达多种G蛋白偶联受体和离子通道,这些受体和通道会对突触活动释放并溢出的神经递质或神经调质做出反应,导致星形胶质细胞Ca2+升高。研究人员将AAV-GfaABC1D-gACh4h、AAV-GfaABC1D-cATP1.0或AAV-hSyn-5-HT3.0的病毒分别注射到CA1区域,光纤记录细胞外神经递质信号(图 4A-B)。观察恐惧消退过程中CA1区域细胞外乙酰胆碱(ACh)、5-羟色胺(5-HT)和三磷酸腺苷(ATP)的水平,在第2天的消退训练期间,ATP和5-HT信号没有明显变化。当恐惧水平较高时,消退记忆提取期间的ACh信号明显小于消退训练期间(图 4C-D)。进一步分析表明,恐惧消退期间的僵冻水平与ACh信号呈负相关(图 4E)。
为了进一步确定细胞外ACh水平升高与dCA1区域星形胶质细胞Ca2+活动之间的关系,在星形胶质细胞中同时通过病毒表达gACh4h探针和光谱兼容的jRGECO1a红色钙成像,并记录它们的信号(图 4F-G)。结果表明细胞外ACh信号和星形胶质细胞内Ca2+信号在时间上相互关联且呈正相关,细胞外ACh信号的升高比星形胶质细胞Ca2+浓度升高提前约2秒(图 4H-J)。这些发现表明,细胞外ACh水平的升高,可能是由于突触活动和神经递质递质溢出,在恐惧消退过程中刺激了星形胶质细胞的Ca2+动态变化。
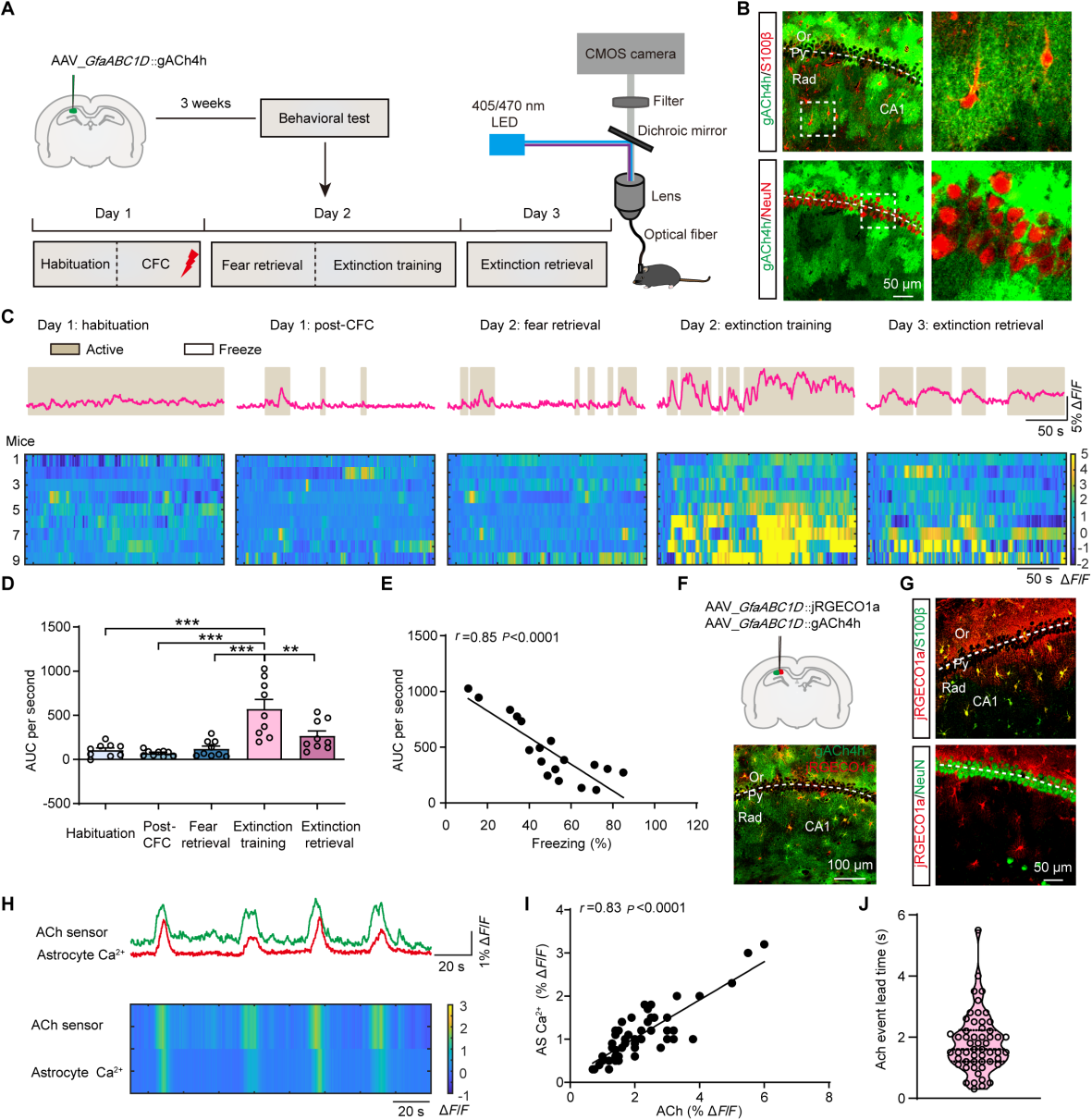
图4 情境恐惧消退中ACh信号先于星形胶质细胞Ca2+活性
先前的研究报道,海马的胆碱能输入主要来源于前基底前脑(aBF),如 Broca 的内侧隔膜和对角带(MS和DBB)。在ChAT-IRES-Cre小鼠海马脑区注射AAV2/2retro-hEF1a-DIO-EYFP的逆向示踪病毒,以此量化从dCA1区域逆行标记至基底前脑(沿其前后轴)的胆碱能神经元数量。结果显示,逆行标记到aBF的胆碱能细胞数量较少,而后基底前脑(pBF)中的胆碱能神经元数量较多(图 5A-C)。在ChAT-IRES-Cre小鼠pBF脑区注射AAV-hSyn-DIO-EYFP的顺行示踪病毒,结果在dCA1区域发现了EYFP标记的pBF投射,胆碱能轴突末梢分散在星形胶质细胞标记物GFAP周围,这表明星形胶质细胞与pBF胆碱能投射在解剖位置上紧密相邻(图 5D)。
为了测试pBF胆碱能输入是否会驱动dCA1区域星形胶质细胞产生Ca²⁺反应,在ChAT-IRES-Cre小鼠的pBF注射AAV-hSyn-FLEX-ChrimsonR-tdTomato病毒和AAV-GfaABC1D-GCaMP6f病毒(图 5E)。然后,利用光遗传激活dCA1区域的胆碱能轴突末梢,并使用光纤记录星形胶质细胞的Ca2+反应。用638nm激光(10ms/脉冲,10Hz,持续10s)对胆碱能末梢中的ChrimsonR进行光激活,在第1天可诱导处于家笼中的小鼠的星形胶质细胞产生Ca²⁺反应,而在第2天接受消退训练的小鼠中,星形胶质细胞的反应增强(图 5F-G),这表明这种神经元-星形胶质细胞信号传导具有可塑性。
为了确定介导 ChAT-IRES-Cre 小鼠在接受第2天的消退训练后星形胶质细胞Ca²⁺反应增强的ACh受体类型,即烟碱型(nAChRs)和或毒蕈碱型(mAChRs)。在dCA1区域分别注射受体拮抗剂,结果表明nAChR拮抗剂MECA可阻断ChrimsonR光激活的星形胶质细胞Ca²⁺反应(图 5H-I),而mAChR拮抗剂阿托品则不能阻断此反应。此外,单独使用α4亚基拮抗剂DHβE或α7亚基拮抗剂MLA也能阻断该反应,且同时使用DHβE和MLA时有相加阻断效应的趋势。用RNAscope进行了原位杂交量化了α4和α7烟碱型乙酰胆碱受体亚基的 mRNA 转录本,在2天恐惧消退后的小鼠dCA1星形胶质细胞中,与第1天处于家笼中的小鼠相比,α4和α7 nAChR亚基的mRNA显著增加(图 5J-K)。这些数据表明,恐惧消退导致dCA1区域星形胶质细胞中α4和α7 nAChR亚基的上调;这些亚基介导了由附近pBF胆碱能末端驱动的海马星形胶质细胞中增强的Ca2+活性。
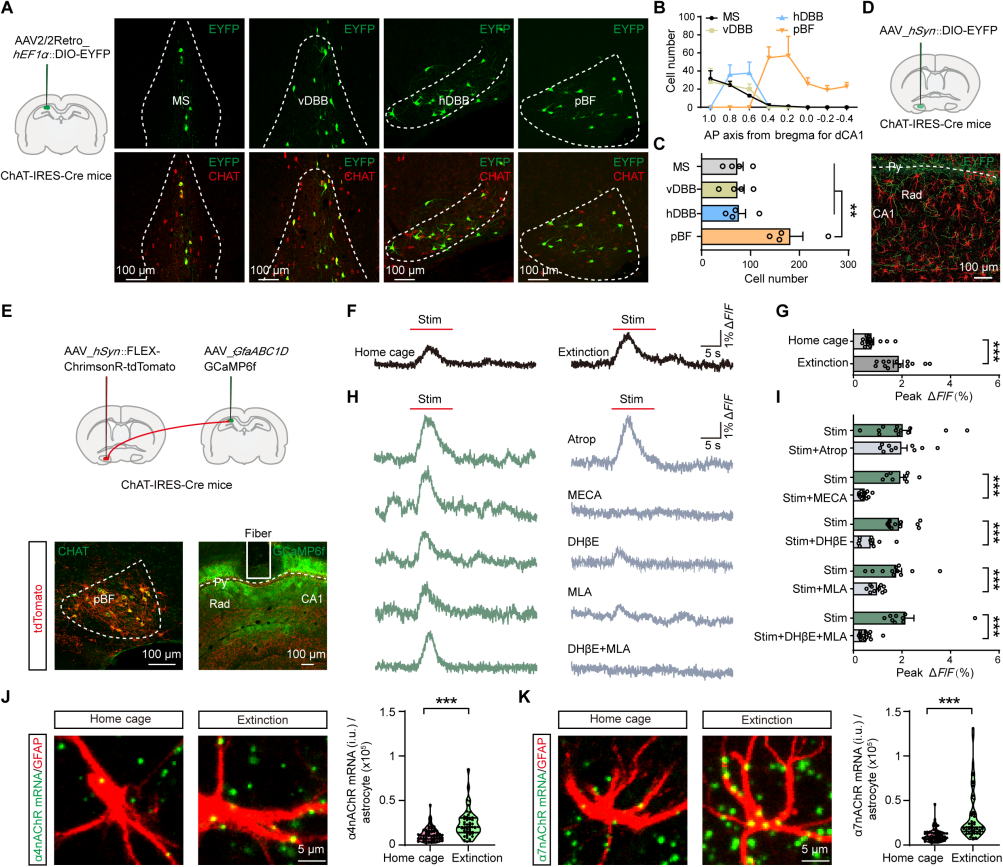
图5 pBF胆碱能投射通过nAChR激活星形胶质细胞
为了评估胆碱能输入对于星形胶质细胞新生的Ca²⁺反应及其对恐惧消退的影响是否是必需的,将AAV-hEF1a-FLEX-taCasp3病毒注射到ChAT-IRES-Cre小鼠的pBF,用来消融pBF中的胆碱能(ChAT阳性)神经元(图 6A)。在注射病毒四周后,taCasp3+EGFP组小鼠pBF中的ChAT阳性神经元几乎消失(图 6B-C)。接下来,评估了恐惧消退过程中dCA1星形胶质细胞的Ca²⁺动态变化,发现taCasp3+EGFP组小鼠CA1星形胶质细胞的Ca²⁺活性显著降低(图 6D-E)。在行为学测试中,与对照组相比,taCasp3+EGFP组小鼠在第2天的消退曲线明显更慢,在第3天的僵冻水平更高(图 6F-I),而光激活星形胶质细胞后,与对照组相比,taCasp3+EGFP组小鼠在第2天和第3天的僵冻水平恢复到了正常水平(图 6H-I)。这些结果表明,增强的星形胶质细胞Ca²⁺动态变化对于pBF胆碱能输入介导的恐惧消退调节是必需的。
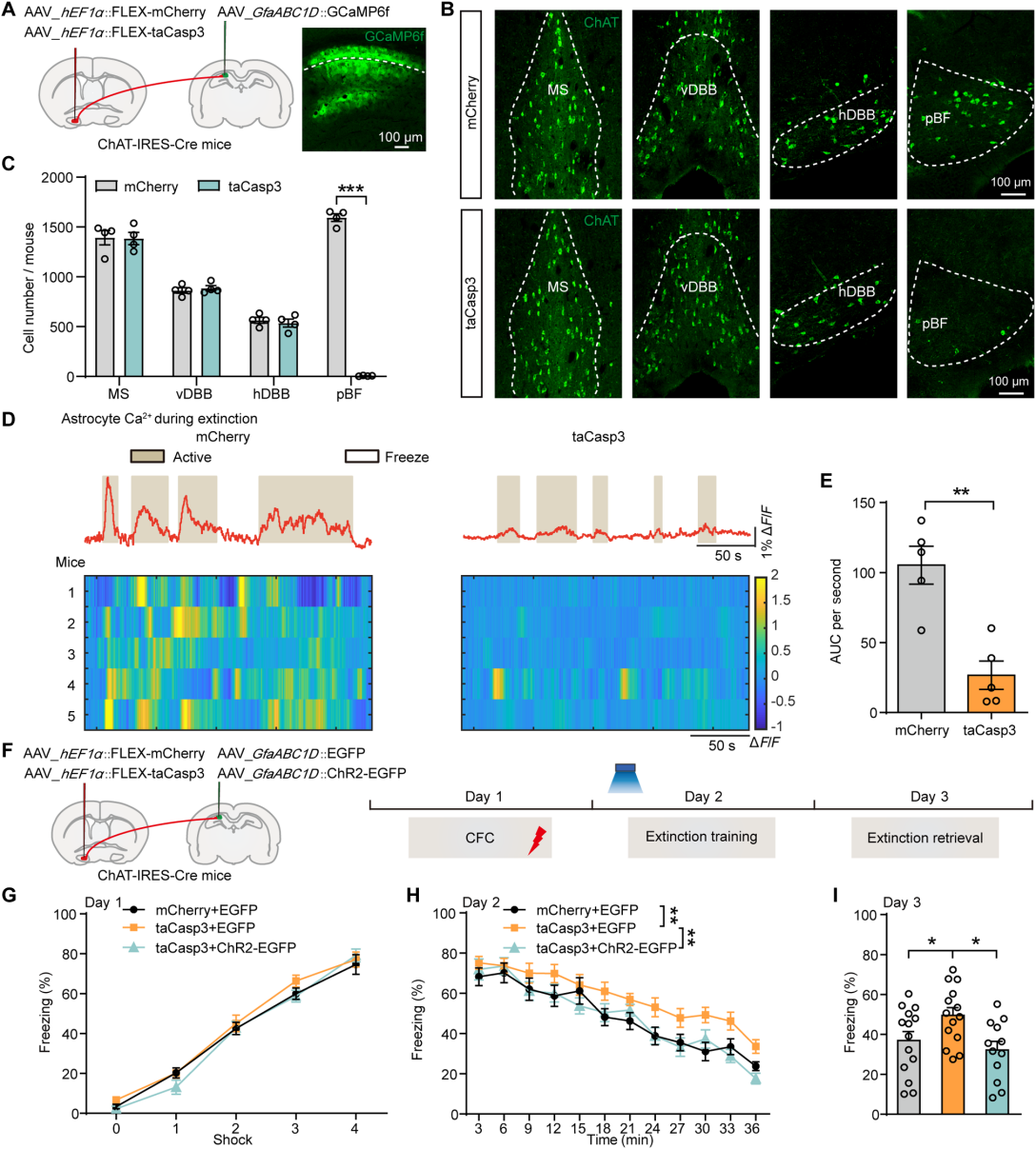
图6 pBF胆碱能神经元消融降低了dCA1星形胶质细胞Ca2+活性
增强胆碱能神经传递是治疗轻、中度阿尔茨海默病的主要方法,多奈哌齐作为常用药物,探究其能否增强星形胶质细胞钙离子活性和促进恐惧消退有重要意义。向CA1区局部注射乙酰胆碱酯酶抑制剂多奈哌齐(0.1 mM),与注射生理盐水相比,多奈哌齐显著增加了星形胶质细胞的Ca2+活性(图 7A-C)。在恐惧消退训练前,向CA1区双侧注射多奈哌齐(0.1 mM),该组小鼠在第2天恐惧消退明显加快,第3天恐惧记忆降低,且不影响小鼠在旷场实验中的运动表现,表明多奈哌齐可促进恐惧消退(图 7C)。此外,腹腔注射多奈哌齐(0.25 mg/kg)在第2天对恐惧消退有促进作用但不影响第3天僵冻水平,更高剂量(0.5 mg/kg)不仅在第2天显著促进恐惧消退,还降低了第3天的僵冻水平,且腹腔注射不影响小鼠在旷场实验中的运动表现(图 7E)。结果显示,通过药物增强pBF胆碱能神经元到CA1星形胶质细胞的信号通路可促进恐惧消退,多奈哌齐在治疗与恐惧、焦虑相关的疾病(如 PTSD)方面具有应用潜力。
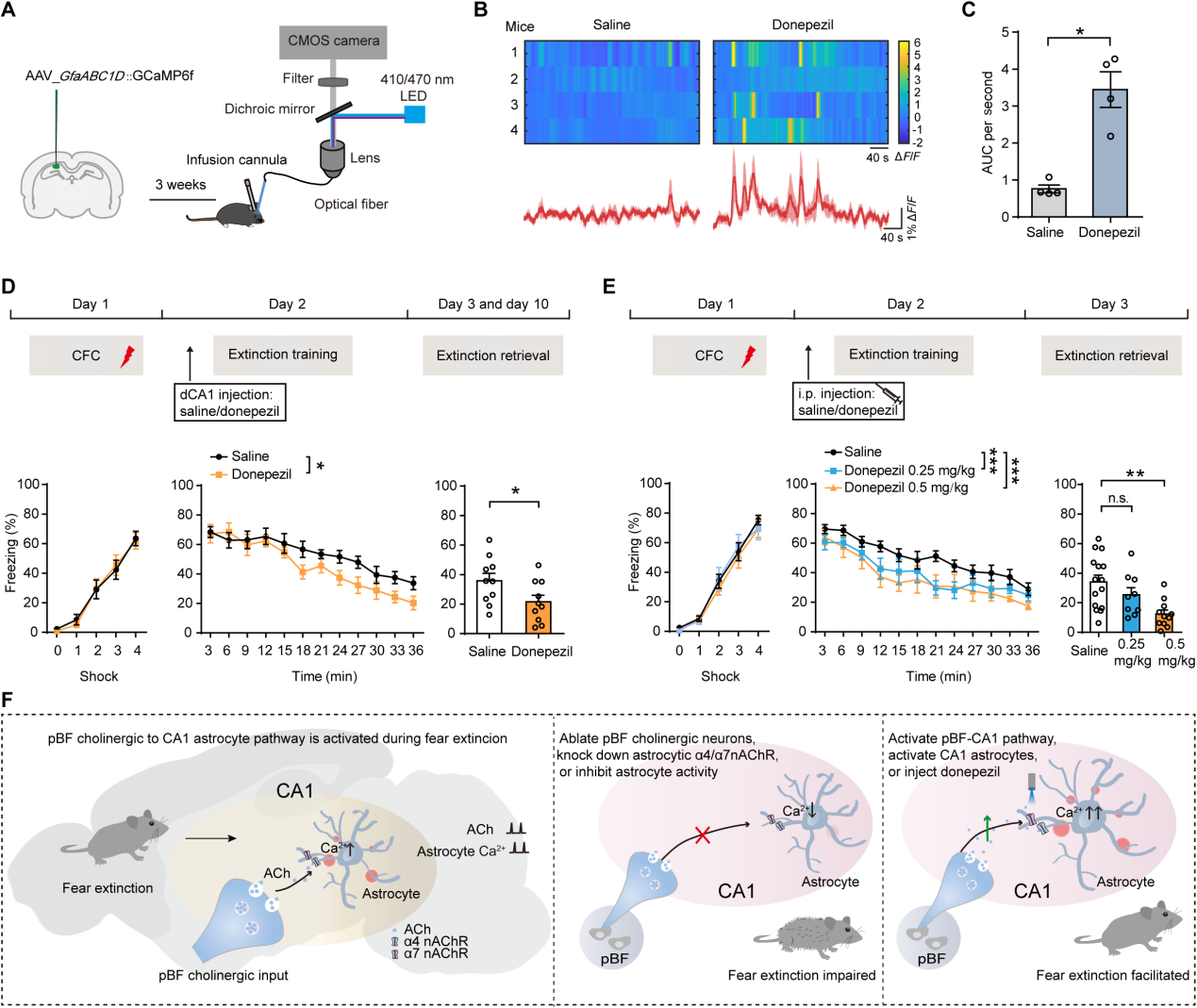
图7 多奈哌齐增加星形胶质细胞Ca2+活性并促进恐惧消退
CA1星形胶质细胞在恐惧消退中起重要保护作用,pBF胆碱能信号与CA1 星形胶质细胞活动耦合调控恐惧消退。从pBF胆碱能神经元到CA1星形胶质细胞的信号通路是治疗恐惧和焦虑相关疾病的潜在靶点。
本文使用的工具病毒布林凯斯均可提供:
同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。