慢性应激对人体健康影响广泛,不仅常引发动脉粥样硬化、自身免疫疾病、抑郁和焦虑等多种病症,还在流行病学上与肠道疾病如炎症性肠病、肠易激综合征相关。在应激反应中自主神经系统的交感和副交感神经起着关键作用。“大脑-肠道轴” 是一个复杂的系统,其中肠神经系统虽能独立运作且参与大脑信号传递,但在肠道功能方面的具体机制仍不明确。而肠道干细胞对维持肠道上皮的持续自我更新和内稳态至关重要,其功能失调会破坏肠道正常生理状态。
2025年3月21日,中国科学院上海营养与健康研究所秦骏、上海交通大学韩齐、同济大学林谋斌、中国科学院上海免疫与感染研究所苏枭共同通讯在Cell Stem Cell(IF=19.8)在线发表题为“Vagal pathway activation links chronic stress to decline in intestinal stem cell function”的研究论文,研究发现慢性应激会激活中央杏仁核-迷走神经背核(CeA-DMV)通路,通过迷走神经-胆碱能肠神经元-乙酰胆碱(ACh)-M3毒蕈碱型乙酰胆碱受体(CHRM3)途径,激活肠道干细胞(ISC)中的p38信号通路,导致ISC衰老和干性受损,影响肠道再生。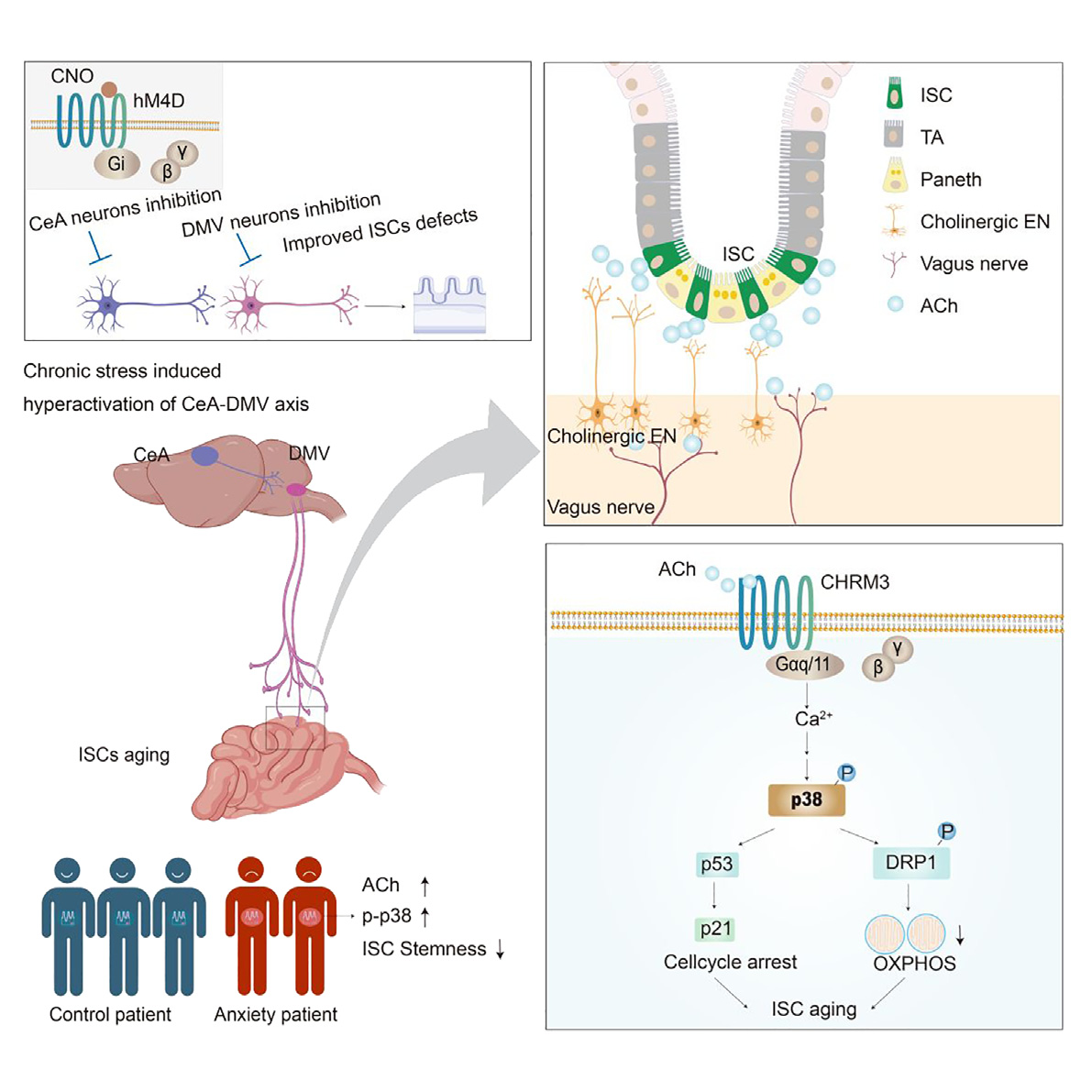
采用小鼠接受重复电击(ES)、社会挫败(SD)和慢性不可预测应激(CUS)方案,在野生型(WT)C57BL/6J 小鼠中诱导应激反应,旨在尽量减少模型偏差(图1A)。与未处理(NT)的同窝小鼠相比,应激小鼠的探索兴趣降低,表明成功诱导出了应激反应,应激小鼠的体重也有所下降(图1B)。组织学评估显示,隐窝高度降低,绒毛长度略有缩短(图1C)。对干细胞、短期扩增(TA)细胞、增殖细胞和潘氏细胞的标记物进行分析,包括 OLFM4、CD44、EdU和溶菌酶(LYZ),结果显示干细胞、TA 细胞和增殖细胞显著减少,而潘氏细胞数量没有明显变化(图1D)。分离隐窝细胞并进行了单细胞RNA测序(scRNA-seq)分析,与TA细胞相比,ISC显示出更高的干细胞基因表达。ES处理降低了干细胞和TA细胞的比例,同时使分化细胞的比例相应增加(图1E)。转录组分析表明,ES处理小鼠的ISC干性和增殖特征减少(图1F),同时与衰老相关的变化和分化增加。应激小鼠的ISC增殖、DNA复制和 YAP蛋白活性较低,而与ISC的增殖和分化相关的信号通路Wnt和Notch信号保持不变(图1F)。细胞周期预测分析显示,暴露于ES的小鼠中,处于G0期停滞的ISC比例更高。免疫荧光染色证实,ES处理后,Lgr5-GFP+ISC减少(富含亮氨酸重复序列的G蛋白偶联受体5,肠道干细胞的特异性标记物),且Lgr5-GFP+群体中EdU+的比例降低,这表明ISC增殖受损。
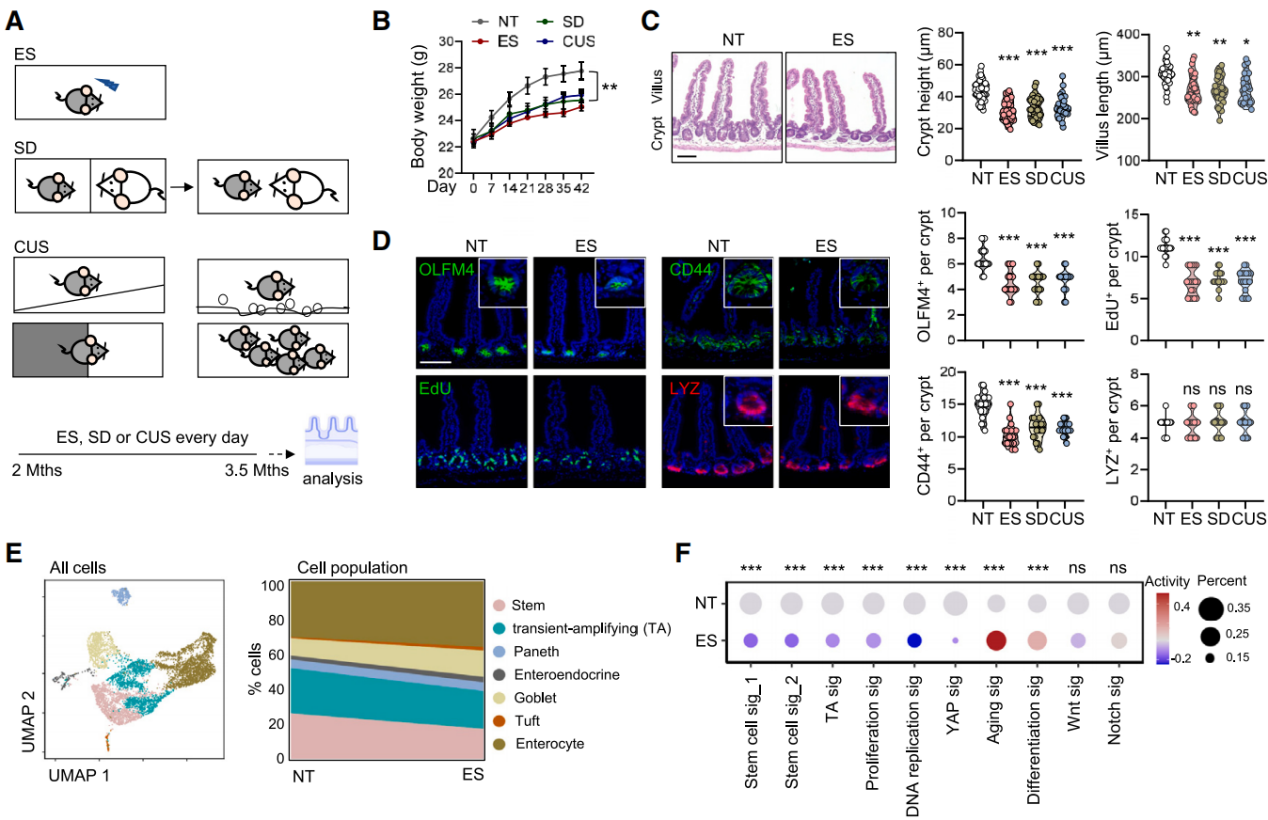
图1 慢性应激会损害小鼠的肠道干细胞干性
为了评估与衰老的相关性,对NT小鼠和ES处理小鼠经荧光激活细胞分选(FACS)分离出的Lgr5-GFP高表达细胞进行了RNA测序,与年轻(2月龄)和年老(18月龄)小鼠ISC转录组进行比较。主成分分析(PCA)显示ES 处理小鼠的ISC转录组与年老小鼠的ISC转录组紧密聚集,却与年轻小鼠的ISC转录组明显不同(图2G)。应激状态下的ISC表现出干细胞自我更新能力下降和衰老相关分泌表型(SASP)分子的诱导表达(图2H)。与年老小鼠类似,应激小鼠的ISC对衰老相关β-半乳糖苷酶(SA-β-gal)呈阳性染色(图2I)。总之,慢性应激会损害肠道干细胞的干性,部分表现与衰老相关衰退相似。为了评估应激状态下ISC的增殖和分化缺陷,将Lgr5+ISC在WENR培养基中培养3天以促进其扩增,然后在ENR培养基中培养,诱导类器官出芽和分化(图2J)。ES处理第3天降低了类器官的形成效率和大小(图2J),并在第6天损害了类器官的出芽(图2K)。此外,应激状态下的类器官向肠上皮细胞和肠内分泌细胞的分化减少。为了评估ISC产生分化细胞的能力,使用了Lgr5 EGFP-IRES-CreERT2; Rosa26LSL-tdTomato(Lgr5 tdTomato)小鼠。在给予他莫昔芬(TAM)5天后,应激小鼠沿隐窝-绒毛轴的tdTomato 标记的皮层长度缩短了20%-30%(图2L)。进一步利用全身照射(WBI)诱导的再生模型进行研究,主要用于探究生物体在遭受辐射损伤后组织和器官的再生修复机制。在照射后第5天,对照组同窝小鼠出现了以绒毛长度为指标的明显肠道再生,而应激小鼠的这一过程受到损害(图2M)。
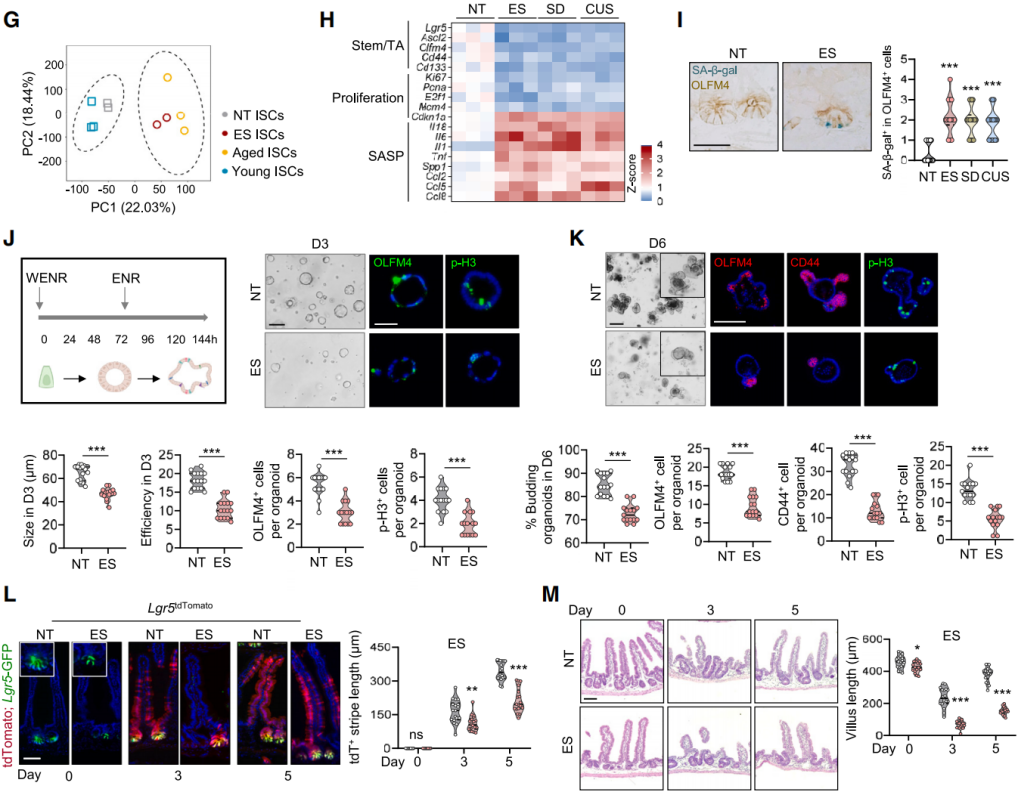
图2 慢性应激诱导小鼠 ISC 过早衰老
下丘脑-垂体-肾上腺(HPA)轴和自主神经系统(ANS)都精细地调节着应激反应(图3A)。心理或生理应激源会促使肾上腺将应激激素和儿茶酚胺释放到血液中。与先前的发现一致,研究人员发现应激小鼠血液中仅皮质酮水平持续升高(图3B),肾上腺素、去甲肾上腺素(NA)和血清素水平没有变化。皮质酮会与细胞质中的糖皮质激素受体(也称为 NR3C1)结合,该受体是配体依赖性转录因子。研究人员培育了Lgr5 EGFP-IRES-CreERT2、Nr3c1flox/flox(Nr3c1Lgr5-/-)小鼠,Nr3c1在Lgr5-GFP+细胞及其后代中被敲除。然而,Nr3c1基因缺失和双侧肾上腺切除术(以去除皮质酮)未能减轻ES诱导的ISC数量减少和增殖能力下降,表明肾上腺来源的类固醇和儿茶酚胺并非应激诱导ISC损伤的唯一介导因素。
为了探究ANS是否导致ISC功能障碍,使用表达EGFP的逆行跨突触伪狂犬病病毒(PRV)来绘制连接大脑和肠道的神经通路(图3D)。外侧巨细胞旁核/延髓头端腹外侧区(LPGi/RVLM)通过脊髓的中间外侧柱(IML)和腹腔神经节调节肠道的交感神经支配,而迷走神经背运动核(DMV)则是副交感迷走神经控制的中枢枢纽。PRV逆行追踪显示LPGi/RVLM、IML、腹腔神经节和DMV中出现EGFP荧光信号(图3D)。此外发现ES小鼠LPGi/RVLM中c-FOS+神经元的数量增加。交感神经纤维(以酪氨酸羟化酶TH为标记)与含有Lgr5+ISC的隐窝相邻。因此,使用6-羟基多巴胺(6-OHDA,一种优先消耗交感神经元的神经毒素)降低了交感神经纤维密度和肠道NA水平,并没有改善ISC功能(图3E),这表明应激诱导的交感神经系统(SNS)激活在肠道干细胞干性损伤中起的作用很小。
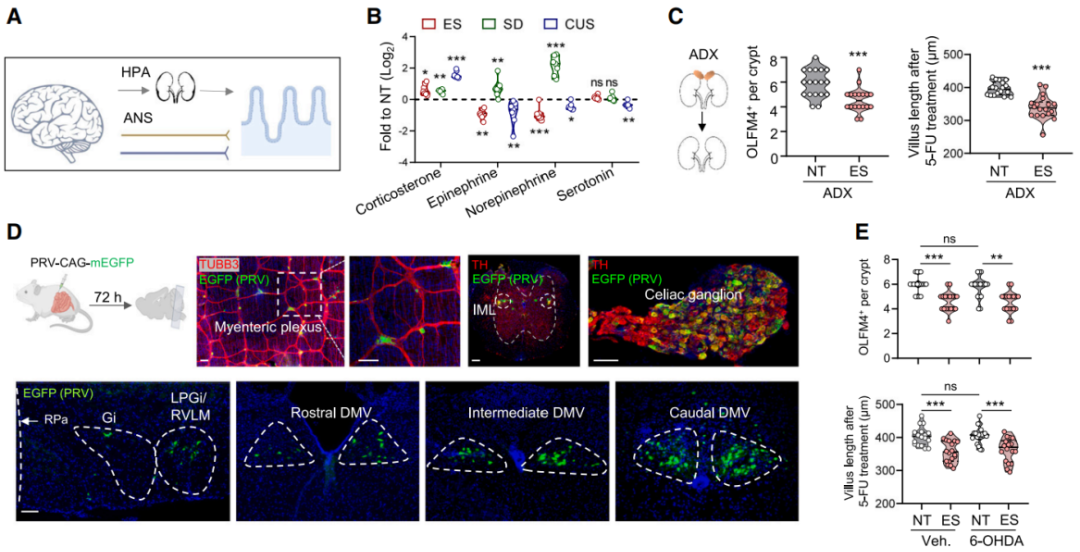
图3 慢性应激通过HPA轴和ANS对ISC损伤作用很小
假设长期应激诱导的DMV中迷走神经的激活可能会损害ISC。由于转录因子Phox2b对迷走神经的发育至关重要;因此利用Phox2b tdTomato小鼠(Phox2bCre;Rosa26LSL-tdTomato)红色荧光标记DMV神经元。免疫染色发现ES小鼠DMV的中间和尾部区域c-FOS+tdTomato+神经元数量增加(图4F),并且随着应激持续时间的延长这种诱导作用更加明显。急性脑片全细胞膜片钳记录结果显示ES处理增加了DMV中间和尾部区域 Phox2b+神经元的整体兴奋性(图4G),显著增加了DMV尾部区域自发放电的 Phox2b⁺神经元的比例和放电频率(图4H)。结果表明,ES选择性地增强了Phox2b⁺神经元的兴奋性,在DMV尾部区域的作用最为显著。
用膈下迷走神经切断术切断投射到胃肠道的迷走神经,来评估迷走神经的消除是否能减轻ISC的损伤。将rAAV-CAG-DIO-EGFP注入Phox2b tdTomato小鼠DMV尾部,以选择性标记DMV在肠道的传出纤维(图4I),迷走神经传出纤维同时表达GFP和tdTomato,而仅表达tdTomato的则被归类为肠神经元;迷走神经切断术后OLFM4+ISC附近的GFP+tdTomato+迷走神经末梢减少,而仅表达dTomato的肠神经元数量没有显著下降(图4J)。结果表明迷走神经切断术显著恢复了ISC的数量,加速了5-FU处理后ISC的再生,并促进了类器官的生长(图4K-4L)。此外,对Lgr5 tdTomato小鼠进行谱系追踪发现,破坏迷走神经支配恢复了应激(ES)小鼠的ISC分化能力(图4M)。综上所述,慢性应激激活了迷走神经通路,损害了ISC的干性。
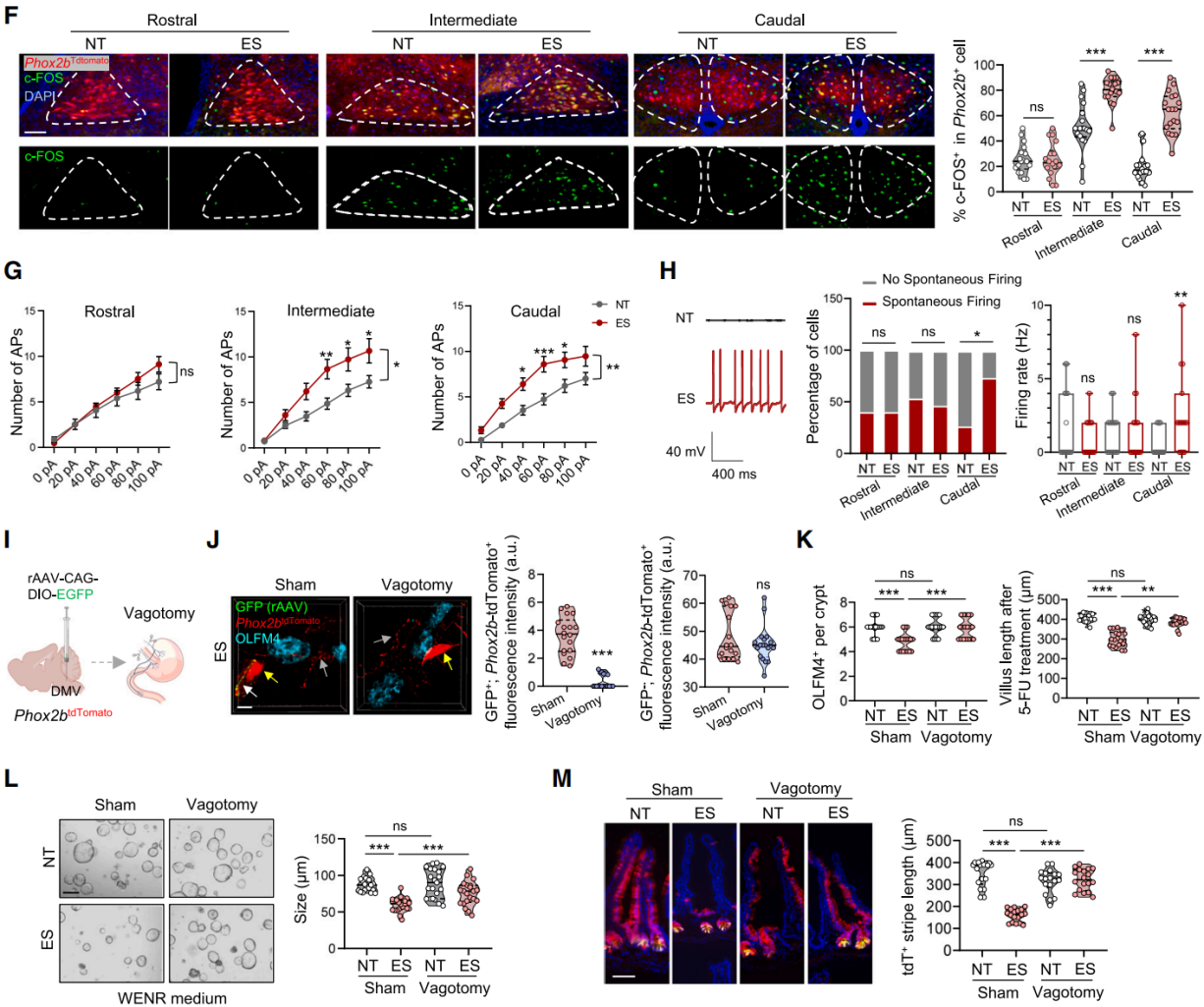
图4 慢性应激通过激活DMV神经元损害ISC功能
DMV神经元与肠神经元相互作用调节肠道的各种功能。为了探究DMV神经元是直接影响ISC,还是通过肠神经元间接发挥作用。构建了Phox2bDTR; tdTomato小鼠,Phox2b在肠神经元中广泛表达,使用聚乙二醇化白喉毒素(PEGyDT,一种不会穿过血脑屏障的聚乙二醇化白喉毒素衍生物)来选择性地清除中枢神经系统(CNS)以外的Phox2b+细胞。结果显示给暴露于电击(ES)的Phox2bDTR; tdTomato小鼠注射PEGyDT后,外周的Phox2b+肠神经元被清除,但DMV神经元得以保留(图5A),显著恢复了ISC的数量,并加速了5-FU处理后的肠道再生(图5B)。同样,将Lgr5+ISC与经FACS得到的Phox2b+肠神经元共培养会减小类器官的大小,而通过白喉毒素(DT)处理耗尽Phox2b+肠神经元则减轻了这种影响(图5C)。结果表明,迷走神经通过肠神经元抑制肠道干细胞的干性。
研究人员观察到迷走神经主要与表达神经元型一氧化氮合酶(nNOS)或胆碱乙酰转移酶(ChAT)的两种Phox2b+肠神经元之间存在相互作用。用7-硝基吲唑(7-NI,一种选择性的nNOS抑制剂)处理遭受ES的小鼠并没有改善肠道干细胞的干性。应激小鼠肠道中的乙酰胆碱(ACh)水平高于对照组,而一氧化氮(NO)水平没有显著差异(图5D)。值得注意的是,迷走神经切断术和消除肠神经元都消除了应激小鼠肠道中ACh的积累。连续10天给予ACh类似物卡巴胆碱,显著减少了ISC的数量并损害了其再生能力。将AAV-Cre病毒注射到Chat flox/flox小鼠的十二指肠壁敲除ChAT神经元,结果显示ChAT+胆碱能神经元(ChAT+ HuC/D+,图5E)显著减少,肠道ACh水平降低,并有效地恢复了ES处理后OLFM4+ISC和EdU+增殖细胞的数量(图5F和5G),这表明在应激状态下,胆碱能肠神经元释放ACh会损害ISC的功能。
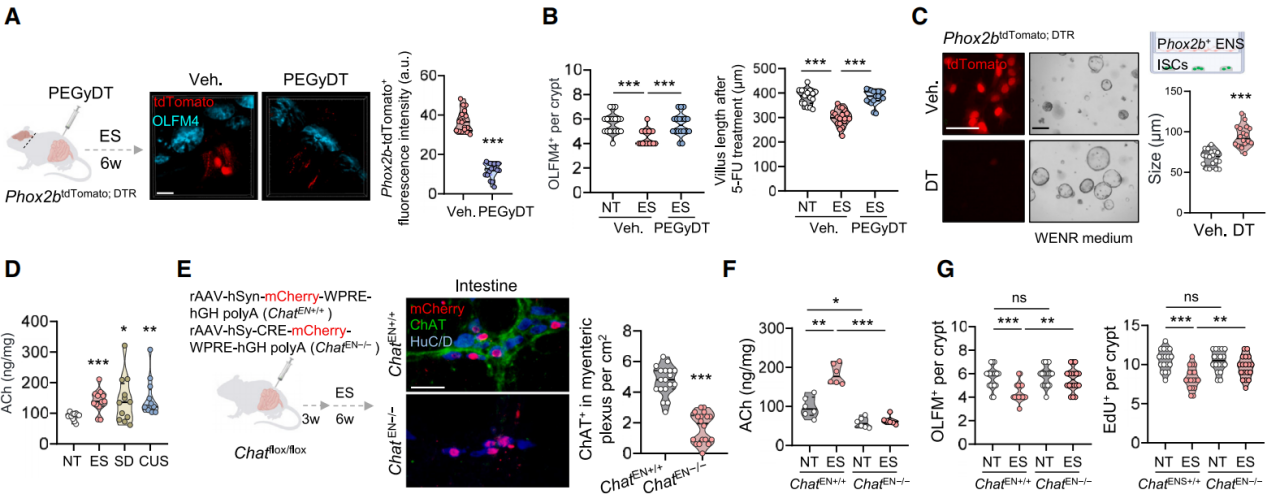
图5 应激状态下迷走神经激活胆碱能肠神经元释放ACh会损害ISC的功能
接着,探究了在应激状态下迷走神经是如何激活胆碱能肠神经元的。由于ACh是迷走神经传出神经元释放的主要神经递质 ,在Phox2b-Cre小鼠中注射rAAV-EF1a-DIO-GCaMp6m进行钙成像,证实了卡巴胆碱处理能强烈刺激肠神经元。为了确认迷走神经来源的ACh在刺激肠神经元中的作用,在Chat flox/flox小鼠DMV脑区注射AAV-Cre病毒,选择性地敲除 DMV中的Chat 基因(图6H)。结果显示DMV神经元中ChAT的表达以及肠道中ACh的水平显著降低,但不影响ChAT+肠神经元(图6H-6J),并逆转了应激状态下的ISC缺陷,表现为ISC数量的恢复和EdU的增加(图6K)。这些发现表明,迷走神经释放的ACh会激活肠神经元,引发过量的ACh释放,从而损害ISC的功能。尽管迷走神经和肠神经元都会释放ACh,但肠神经元对肠道ACh水平升高的贡献更为显著。研究结果表明,DMV通过迷走神经-肠神经系统-ISC这条通路间接影响ISC,其中ACh是关键的信号传递分子。
ACh通过代谢型毒蕈碱受体(mAChRs)和离子型烟碱受体(nAChRs)传递信号,在 Lgr5+的 ISC 中存在选择性的Chrm3表达(图6L),用mAChR 激动剂处理会减少ISC数量和再生能力(图6M)。培育了两种Chrm3基因敲除小鼠(Chrm3IEC−/−和 Chrm3Lgr5−/−)。在基础条件下,Chrm3缺失无影响,但在应激小鼠中,能恢复OLFM4+ ISC数量和再生能力,还能恢复Lgr5-GFP+ISC 数量及其中 EdU+细胞比例(图6N)。在类器官培养实验中,Chrm3缺失能恢复应激小鼠ISC的数量、增殖和分化能力。将 Phox2b+肠神经元与Chrm3修饰的ISC共培养,表明Chrm3缺失赋予ISC应激耐受性(图6O)。对ISC的转录组分析显示,Chrm3缺失使 56%受应激干扰的基因表达正常化,恢复正常的基因在干性和增殖相关类别富集,应激诱导上调基因与钙信号传导相关(图6P-6Q)。结果表明,ACh-CHRM3信号通路是一条与应激相关的神经传导途径,会损害肠道干细胞的干性。
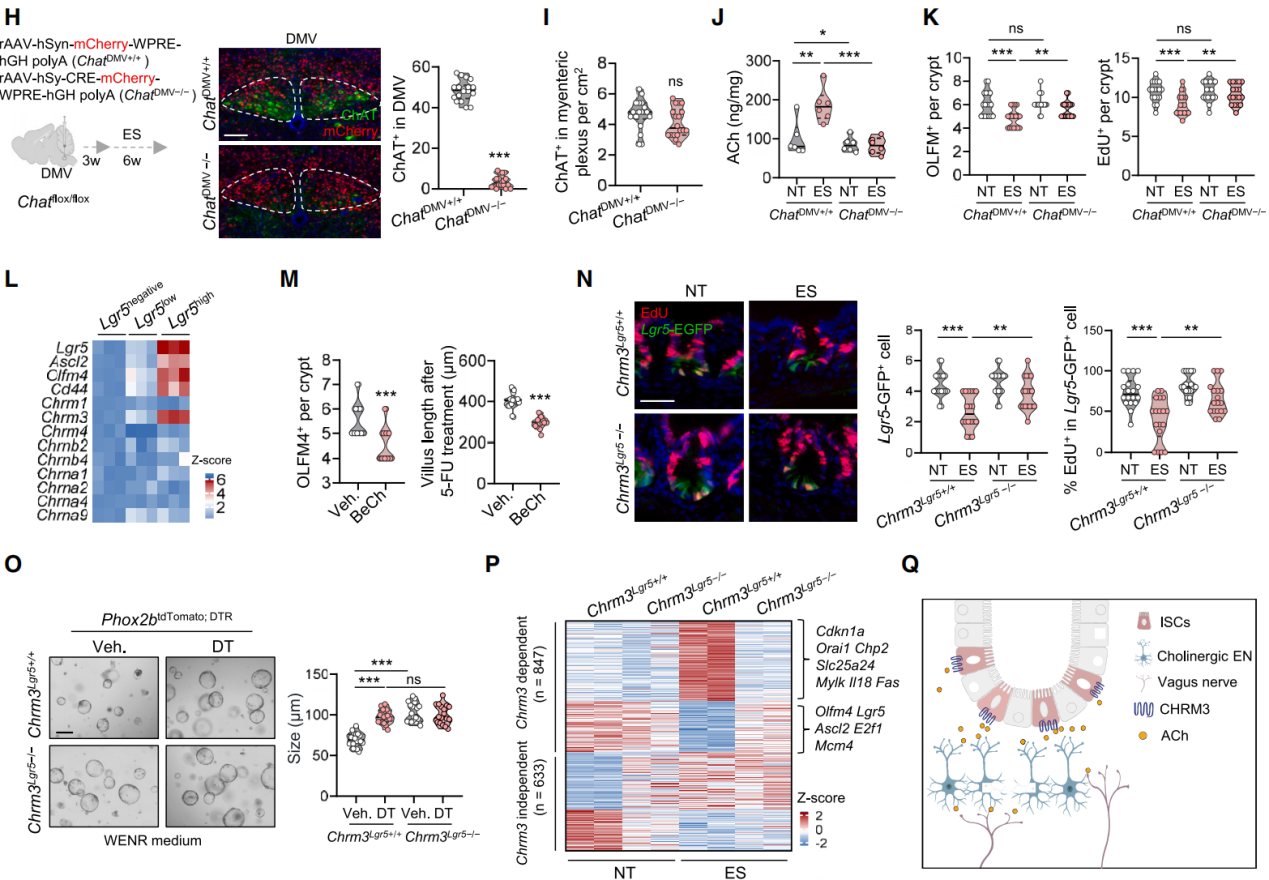
图6 迷走神经-胆碱能肠内神经元通过ACh-CHRM3通路损害肠道干性
Chrm3基因缺失可减弱应激小鼠ISC 中与衰老相关的转录组变化(图7A、7B),减少衰老相关 β-半乳糖苷酶SA-β-gal染色(图7C)。哺乳动物雷帕霉素靶蛋白复合物1(mTORC-1)和p38信号能促进肠道干细胞衰,对相关活性指标p-S6和p-p38进行免疫染色发现,应激小鼠肠隐窝中p-p38染色显著增加,p-S6无变化,Chrm3基因敲除小鼠无此现象(图7D),在经历应激的小鼠的隐窝裂解物中,p53和p21的水平大幅升高。使用阿地马哌(一种选择性的p38丝裂原活化蛋白激酶(MAPK)抑制剂)处理可抵消应激对 ISC 的有害影响。丝裂原活化蛋白激酶14(Mapk14,编码 p38α)基因缺失使 NT 组小鼠在5-FU处理后ISC数量增加、再生能力增强(图7E-7F),还能恢复应激小鼠的肠道干细胞干性(图7E-7G),逆转应激诱导的营养吸收缺陷(图7H),缓解体重减轻(图7I),同样地,在经历应激处理的情况下,在 Lgr5+肠道干细胞中删除 Mapk14基因恢复了肠道干细胞的数量和 EdU阳性率(图8J)。在分子水平上增加与干细胞及增殖相关基因表达,减少衰老相关基因表达。结果表明,抑制p38信号传导可促进经历应激的小鼠的肠道干细胞年轻化。
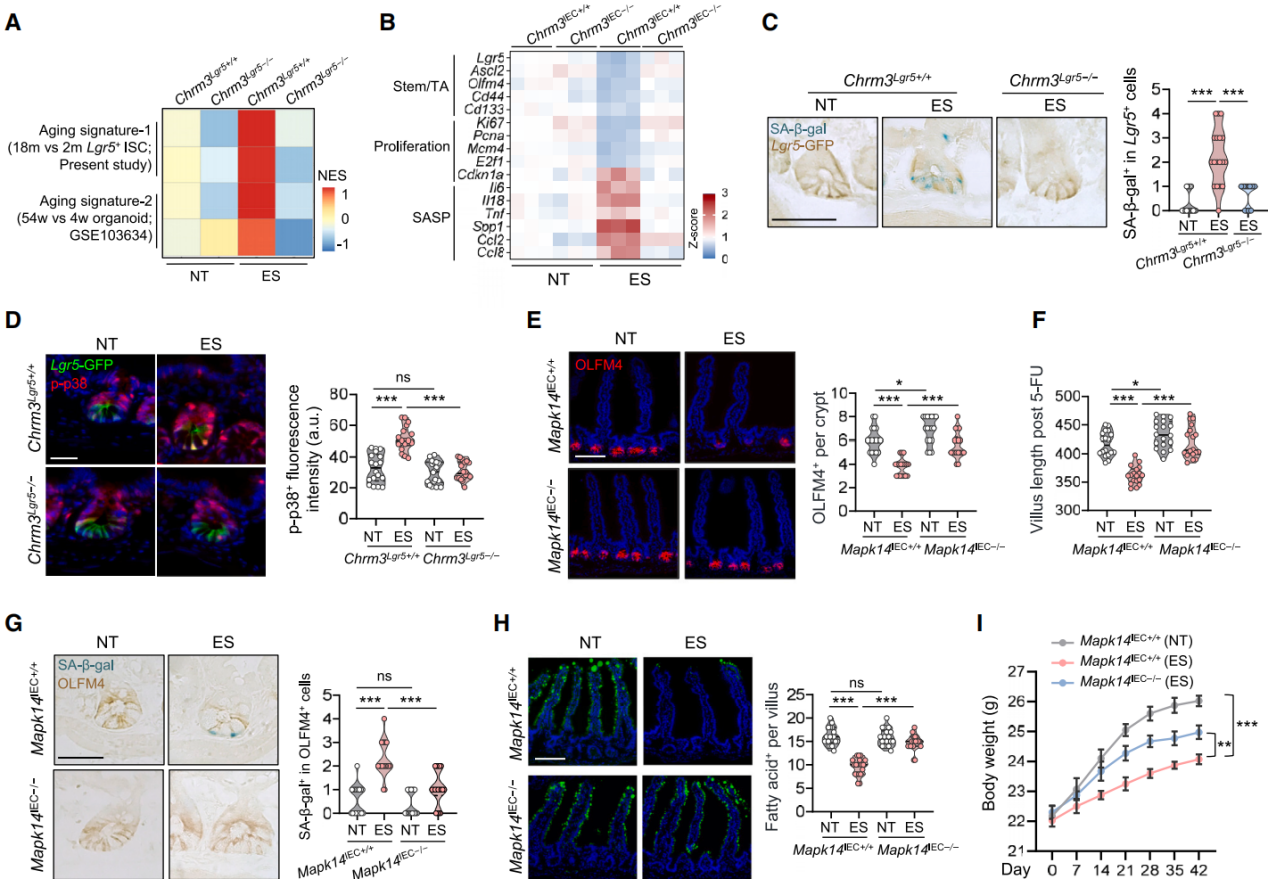
图7 抑制p38信号传导可促进经历应激的小鼠的肠道干细胞年轻化
ACh通过Gαq/PLC/IP3通路触发Ca2+释放,体内双光子荧光钙成像显示应激小鼠Lgr5+ ISC中Ca2+波动更高(图8K),Chrm3基因缺陷的ISC中氨甲酰甲胆碱(BeCH)诱导的Ca2+内流被消除。离子霉素(Iono,一种钙离子载体)处理减少ISC数量和再生能力(图8L),增加p-p38水平,相比之下,肠道干细胞中Mapk14基因的失活阻止了离子霉素处理后肠道干细胞数量和再生能力的这些变化(图8M)。将p38激活的信号通路追溯到钙信号传导,发现应激小鼠ISC中p-CaMKII和p-ASK1水平升高,说明Ca2+激活的CaMKII-ASK1机制是应激诱导的p38激活的基础。离子霉素处理的ISC也有类似升高,Mapk14 基因缺失可减少离子霉素诱导的p53和p21表达(图8N),表明 p38在ACh-CHRM3介导的钙信号传导下游驱动ISC出现类似衰老的表型。
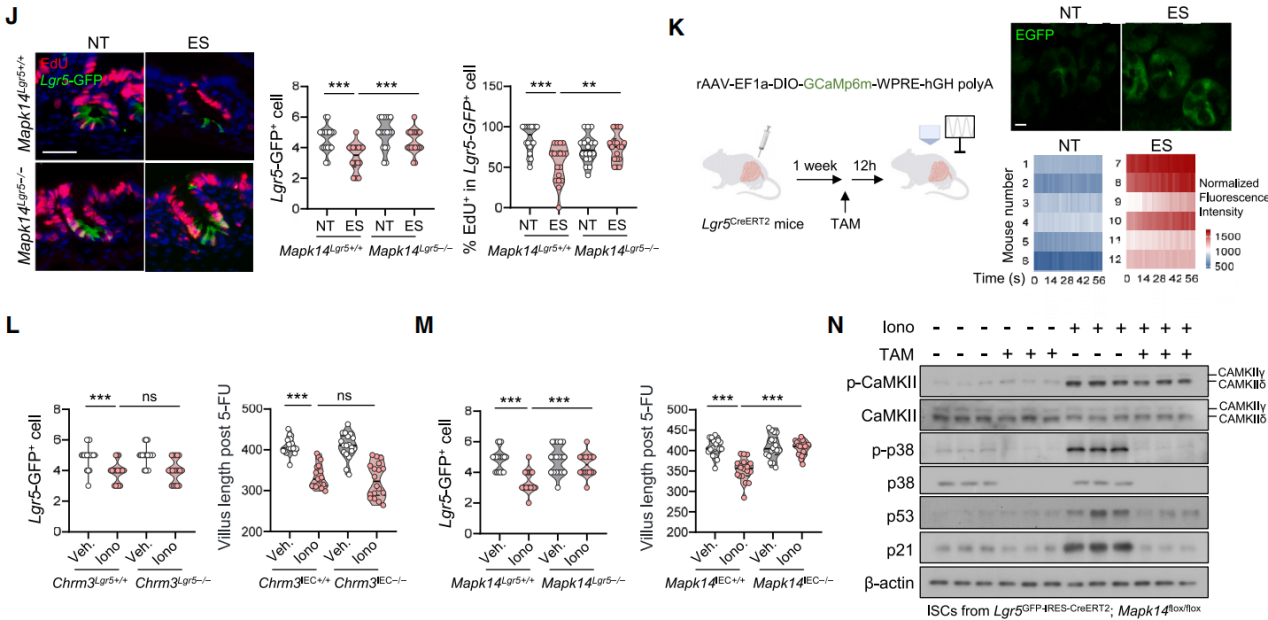
图8 p38在ACh介导的钙信号通路的下游发挥作用
基于p38在细胞周期和氧化磷酸化(OXPHOS)调节中的作用,以及OXPHOS对ISC功能的重要性,提出p38激活可能通过降低OXPHOS损害ISC的假设。通过海马体分析仪分析细胞能量代谢发现,应激小鼠的ISC在葡萄糖或脂肪酸处理后耗氧率显著下降(图9A),糖酵解略有增加(图9B),基础耗氧率和ATP 生成减少,提示线粒体可能存在异常。透射电镜和 TOM20 染色进一步表明,应激小鼠的ISC线粒体更小、碎片化(图9D),中等和点状线粒体数量增加。p38 MAPK介导的线粒体分裂蛋白-动力蛋白样蛋白1(DRP1)在丝氨酸616位点磷酸化(p-DRP1S616)会触发线粒体分裂。研究发现,应激增强了p-DRP1S616 的磷酸化水平(图9E-9F),而线粒体融合蛋白2(MFN2)和动力蛋白样GTP酶(OPA1)等相关蛋白水平不变(图9E)。给予线粒体分裂抑制剂1(Mdivi-1)抑制DRP1依赖的线粒体分裂(图9G),可防止线粒体碎片化,增加应激小鼠 ISC 的耗氧率,并部分恢复肠道干细胞干性(图9H-9I)。在ISC或肠上皮细胞中敲除Mapk14基因,可减弱应激小鼠中DRP1在丝氨酸 616位点的磷酸化(图9J),使线粒体伸长、耗氧率增加(图9K-9L)。Chrm3 基因敲除小鼠也有类似结果,证实CHRM3-p38信号传导驱动DRP1(S616)磷酸化,促进线粒体碎片化和IS类似衰老的衰退。
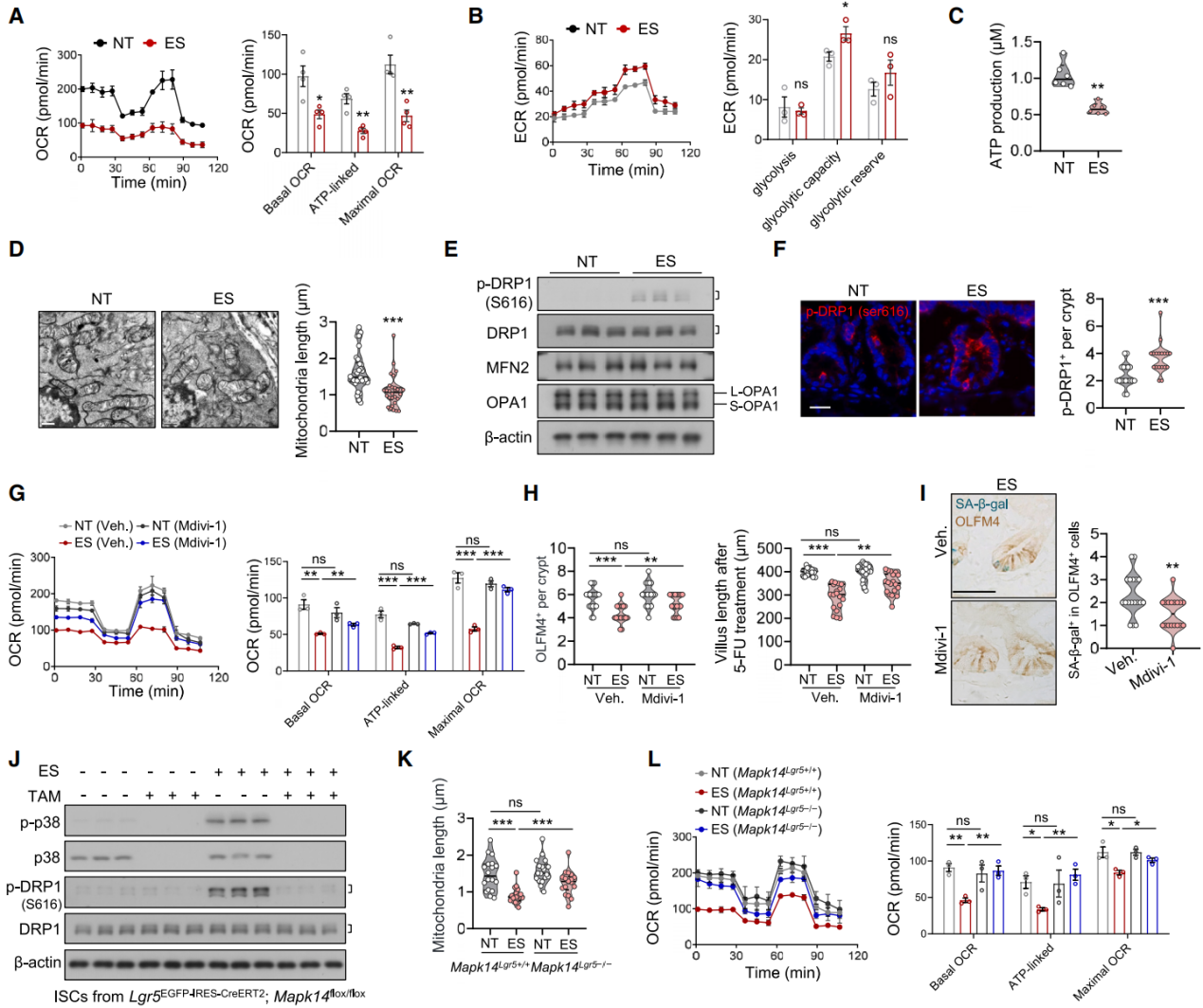
图9 慢性应激诱导的p38激活会损害线粒体功能
为了测试抑制DMV神经元活动是否能减轻慢性应激对ISCs的影响,向Phox2b tdTomato小鼠的DMV双侧注射表达Cre依赖型 hM4D (Gi) 的腺相关病毒(图10A)。通过化学遗传学方法沉默DMV神经元,有效地逆转了应激诱导的ISCs功能障碍,具体表现为OLFM4+ISCs 数量增加、肠道再生能力改善、SA-β-gal+ISCs减少、类器官生长更好、EdU+细胞数量增多,以及线粒体氧化磷酸化增强(图10B-10D)。相反,持续激活DMV神经元,显著减少了OLFM4+ISCs的数量,并降低了其再生能力。结果表明,DMV神经元活动协调了肠道的应激反应。
为了探究参与 DMV 诱导的 ISCs 功能障碍的神经环路,使用RV逆向跨单病毒来示踪表达Phox2b的DMV神经元的传入连接。将病毒注射到Phox2b-Cre小鼠的DMV中(图10E)。分析显示室旁核(PVN)、中央杏仁核(CeA)、丘脑底旁核(PSTh)等脑区被RV标记(图10F)。其中c-FOS 染色表明PVN和CeA在慢性应激模型中显示出明显的激活(图10G)。化学遗传学方法抑制CeA神经元导致OLFM4+细胞显著增加、再生潜能增强,并且ISCs中的 SA-β-gal染色减少(图10H-10I)。相比之下,抑制 PVN 中的神经元并没有产生这些效果。结果表明,CeA在介导影响 ISCs功能的应激反应中起着重要作用。利用化学遗传学方法抑制或激活CeA-DMV神经环路(图10J 和图10L),结果发现抑制 CeA-DMV环路显著增加了Lgr5+ISCs的数量,增强了EdU的掺入,减少了应激诱导的p-p38、p53和p21信号的激活,并维持了ISCs中的OXPHOS(图10K)。相反,在非应激小鼠中激活该环路产生了类似应激的效果(图10M)。总之,这些结果强调CeA-DMV环路是影响ISCs功能的应激反应的关键调节因子。
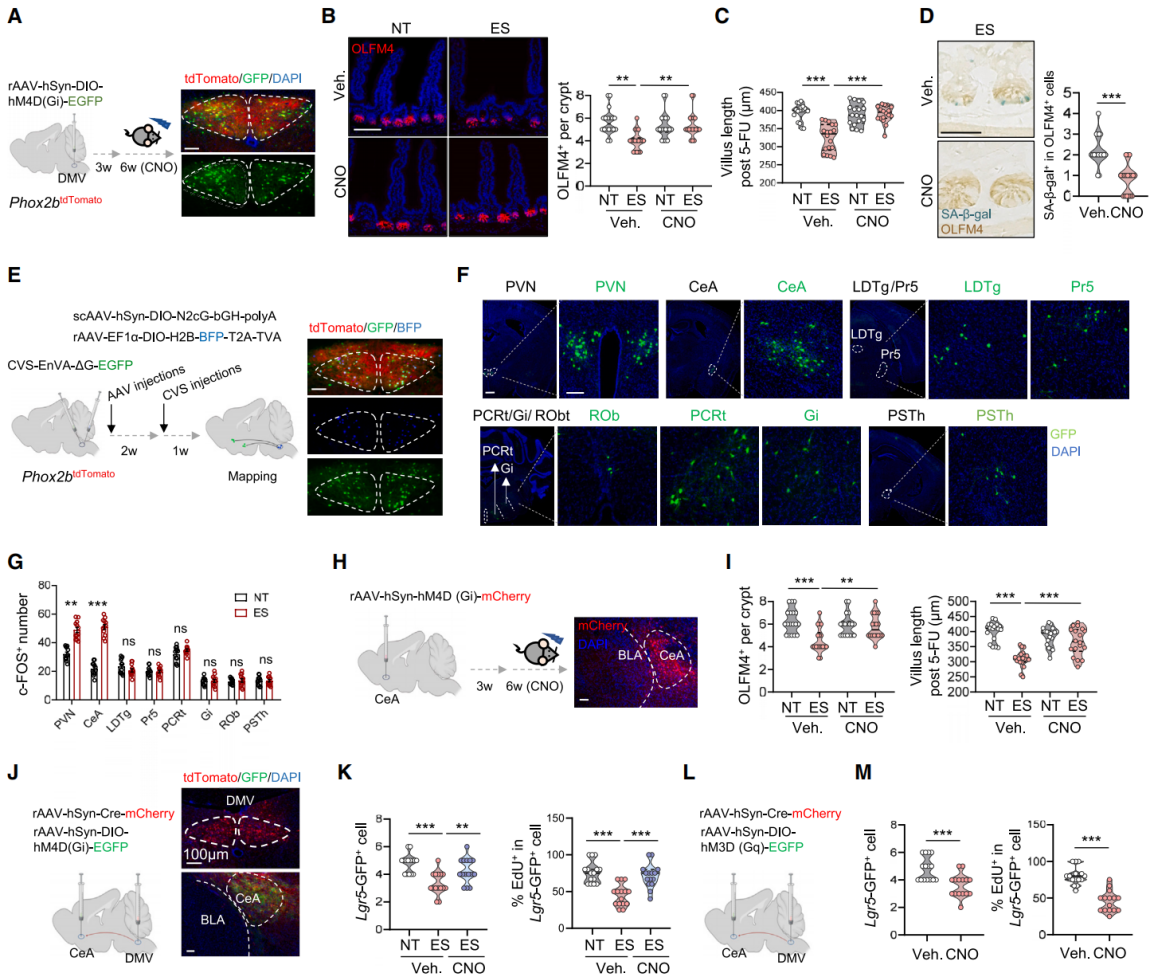
图10 靶向CeA-DMV轴可减轻应激诱导的ISC功能障碍
为评估临床相关性,我们分析了结直肠癌患者的癌旁正常组织和血清,因获取健康个体的肠道组织不可行。使用广泛性焦虑障碍量表 7(GAD-7)评估焦虑状况 ,患者健康问卷 9(PHQ-9)评估抑郁情况 ,失眠严重程度指数(ISI)评估失眠状态 ,对患者进行心理健康评估,据此确定感知压力评分。并收集25名无压力患者和20名有压力患者的正常结肠样本及血清,运用质谱法测定组织和血清中皮质醇和ACh的水平(图11A)。肠道组织中皮质醇和 ACh 水平与压力评分正相关,血清中仅皮质醇水平与压力评分显著相关(图11B-11C)。免疫荧光显示,有压力患者的结肠组织中干细胞和增殖细胞(OLFM4 和 Ki67 染色)显著减少,p-p38信号更强(图11D-11F)。qPCR 分析表明,有压力患者的干细胞标记物(LGR5、OLFM4、ASCL2)和 TA / 增殖基因(CD44、CD133、KI67)表达下调,衰老/SASP基因表达上调。研究表明压力也可能通过类似机制损害人类肠道干细胞的干性。
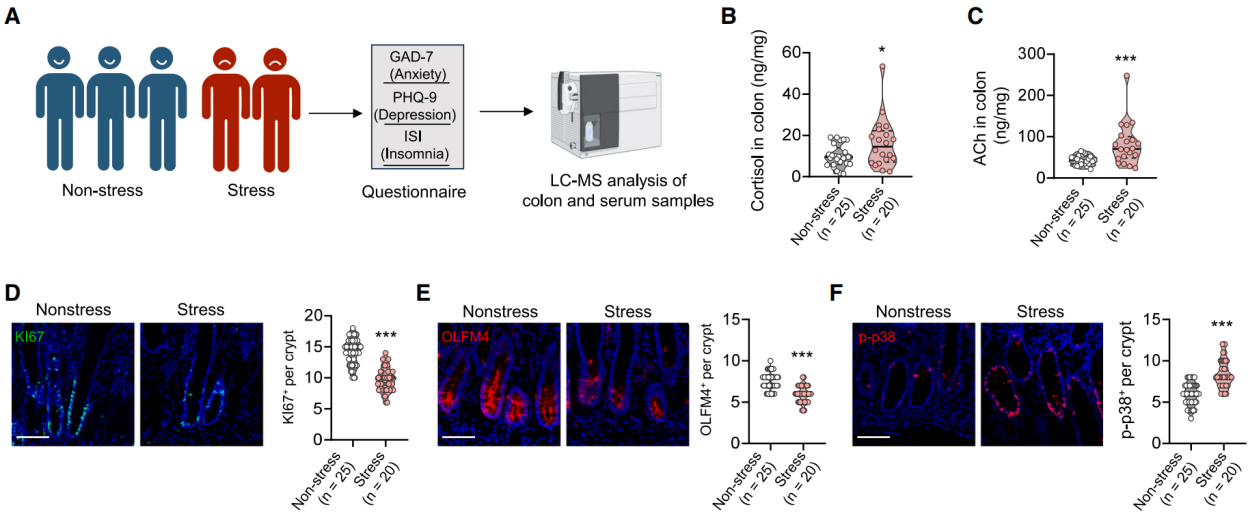
图11 心理压力影响人体肠道ACh水平和增殖缺陷
本文围绕慢性应激对肠道干细胞(ISC)的影响展开研究,证实慢性应激会损害肠道干细胞干性,降低其自我更新和分化能力,导致肠道再生障碍。应激主要通过下丘脑-垂体-肾上腺(HPA)轴和自主神经系统起作用,其中迷走神经背运动核(DMV)激活引发的迷走神经通路活化,通过肠神经元释放乙酰胆碱,损害肠道干细胞功能。研究还发现中央杏仁核(CeA)与DMV形成的CeA-DMV 神经轴,在调控应激对肠道干细胞功能影响中发挥关键作用。此外,对结直肠癌患者的分析表明,人类中也存在相似机制。
本文使用的工具病毒布林凯斯生物科技有限公司均可提供:
同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。