趋化因子(chemokine)CXCL10是介导发育和免疫反应中细胞迁移的关键信号分子之一,可特异性招募效应细胞的定向迁移并调控其活化、增殖和存活等功能,展现出功能上的高度复杂性和特异性1-3。趋化因子信号的异常与脑肿瘤及自身免疫疾病密切相关,具有重要的临床价值4,5。研究表明,趋化因子的功能不仅取决于稳态浓度,还依赖于其时空动态模式,如空间梯度的陡度、随时间的动态变化等6。这些“时空编码”机制可由受体内吞、蛋白酶修饰等分子过程精细调控7-10。然而,目前缺乏能在活体中以高时空分辨率追踪趋化因子CXCL10动态的技术,限制了对其功能机制的深入理解。
2025年8月15日,北京脑科学与类脑研究所井淼实验室在《Immunity》杂志发表题为“Spatiotemporal dynamics of CXCL10 encode contextual immune information revealed by the genetically encoded fluorescent sensor”的研究论文,突破现有技术瓶颈,设计并开发新型基因编码的,基于G蛋白偶联受体激活(GRAB)原理的荧光探针GRAB-LoX3-1.0,在活体动物中实现了趋化因子CXCL10的高分辨率追踪,并揭示了不同免疫状态下CXCL10通过“时空编码”传递环境信息的潜在原理。该研究为深入解析趋化因子的复杂功能提供了有力工具和理论支持。

研究者基于GRAB探针的模块化原理11,构建了识别配体的感知模块和荧光报告模块,并从多种天然和病毒来源的CXCL10受体中筛选出CXCR3与构象敏感荧光蛋白cpGFP的组合,作为初始骨架。通过在跨膜区、界面以及荧光蛋白内部关键位点的迭代筛选,获得了对CXCR3激动剂产生约200%响应幅度的探针LoX3-1.0。
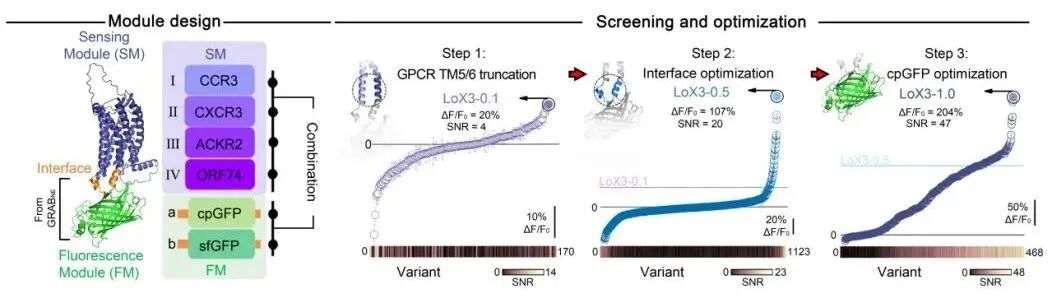
图一 趋化因子 CXCL10 荧光探针的设计策略和迭代筛选
基于LoX3-1.0在体外表现出的优异性能,研究者进一步应用LoX3-1.0解析不同免疫状态下脑内CXCL10的动态变化。持续低剂量或预先高剂量的LPS刺激可促使脑内免疫状态进入特定的“耐受”或“增强”状态,而不同状态会对后续面临相同刺激表现出截然不同的应答模式。与初次(Naïve)接受LPS处理后LoX3-1.0信号的启动延迟、强度适中的反应模式相比,复发组(Recurrent)在接受高剂量LPS二次刺激后,信号启动显著提前,响应更强烈,但在约12小时后迅速衰减,持续时间较短。而耐受组(Tolerant)在接受高剂量LPS刺激后几乎未发生明显信号上升。这些结果表明,LoX3-1.0能够在活体内捕捉与免疫状态匹配的CXCL10的多维动态特征。
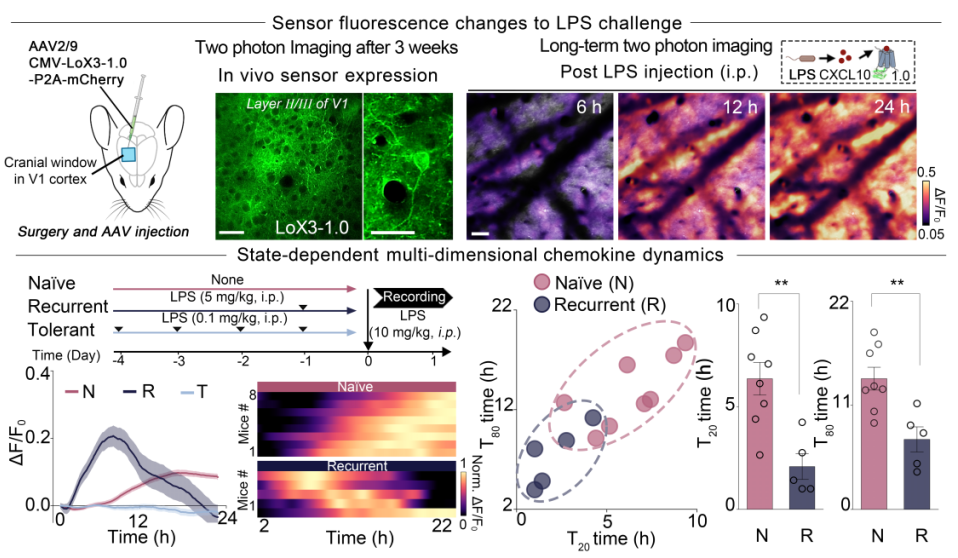
图二 大脑炎症中状态依赖性的 CXCL10 动态变化
研究者进一步从空间视角出发,系统分析了在炎症过程中CXCL10在脑内的空间梯度及其随时间的动态演化规律。结果显示,CXCL10呈现出以血管为中心的梯度分布模式,并随免疫进展不断变化。进一步量化这一梯度的时空特征发现,在炎症早期,趋化因子表现为缓而弱的小范围梯度;中期后,其梯度峰值显著抬升,空间覆盖范围扩大且变得陡峭;而发展到炎症后期,尽管梯度的峰值和斜率依然保持较高水平,但整体信噪比显著下降。重要的是,在免疫进程中后期即使趋化因子的绝对浓度和影响范围发生了变化,其空间梯度的斜率仍然维持稳定,暗示着梯度这一信号维度对于指导细胞迁移的潜在重要性。CXCL10在体内的空间变化可能为精细调控下游细胞行为提供了丰富的环境信息。综上,LoX3-1.0实现了对天然组织中趋化因子动态空间分布的精确刻画,为其功能研究奠定了基础。
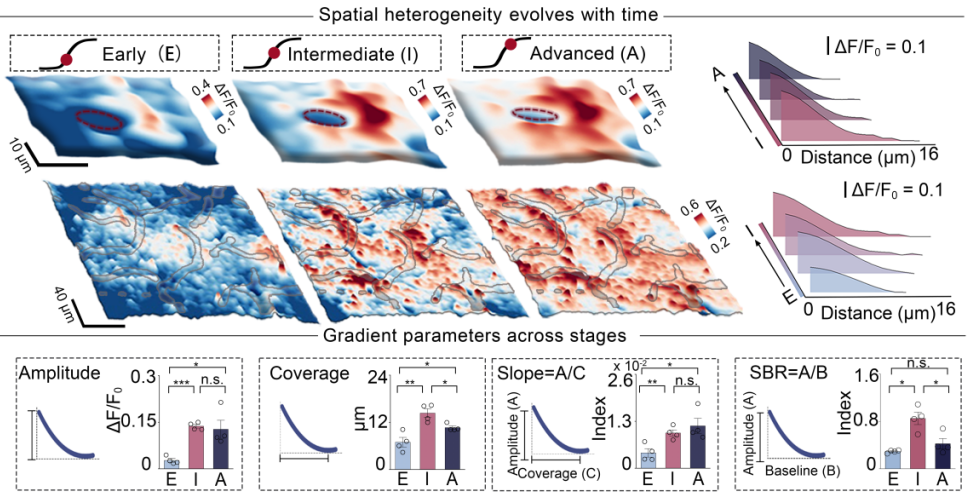
图三 大脑炎症反应中 CXCL10 的微米级梯度及其演化
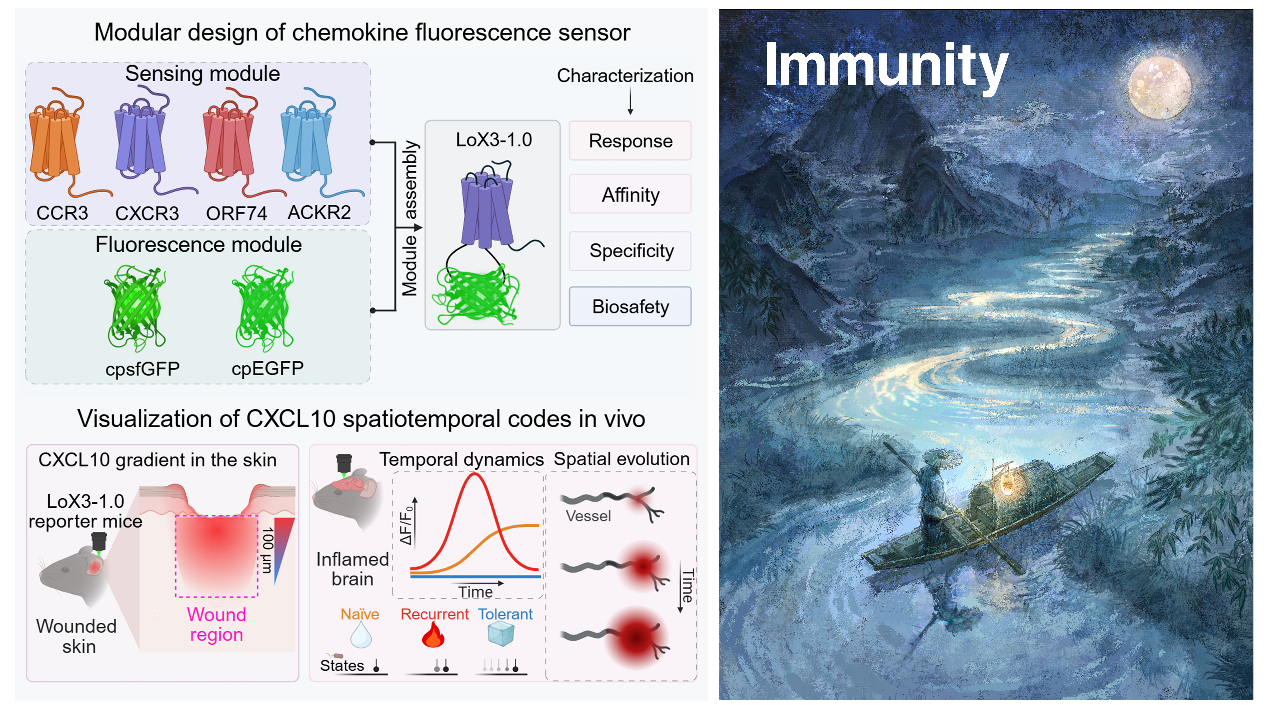
趋化因子是调控细胞迁移和免疫平衡的核心信号,但其通过动态模式传递信息的机制尚不清晰。本研究开发了基因编码荧光探针GRAB-LoX3-1.0,具备高信噪比、纳摩尔级亲和力、毫秒级时间分辨率和亚微米空间分辨率,首次实现对CXCL10动态变化的高精度可视化。借助LoX3-1.0,研究者系统揭示了CXCL10在不同免疫状态下的时空变化模式及多维编码特征,并在皮肤损伤与脑炎症模型中验证了其动态分布。这一工作为解析趋化因子功能及炎症环境下的免疫信息传递提供了全新工具和理论支持。研究者为该工作绘制了一份艺术插图,抽象体现了趋化因子(月光)指引细胞(船夫)向目的地航行的过程(由清华大学孙致璇绘制)。
作者信息
论文链接
https://www.cell.com/immunity/fulltext/S1074-7613(25)00314-0
参考文献
2. Whiting, D., Hsieh, G., Yun, J.J., Banerji, A., Yao, W., Fishbein, M.C., Belperio, J., Strieter, R.M., Bonavida, B., and Ardehali, A. (2004). Chemokine monokine induced by IFN-gamma/CXC chemokine ligand 9 stimulates T lymphocyte proliferation and effector cytokine production. J Immunol 172, 7417-7424. 10.4049/jimmunol.172.12.7417.
3. Yoneyama, H., Narumi, S., Zhang, Y., Murai, M., Baggiolini, M., Lanzavecchia, A., Ichida, T., Asakura, H., and Matsushima, K. (2002). Pivotal role of dendritic cell-derived CXCL10 in the retention of T helper cell 1 lymphocytes in secondary lymph nodes. J Exp Med 195, 1257-1266. 10.1084/jem.20011983.
4. Kim, B., Park, Y.Y., and Lee, J.H. (2024). CXCL10 promotes melanoma angiogenesis and tumor growth. Anim Cells Syst (Seoul) 28, 453-465. 10.1080/19768354.2024.2402024.
5. House, I.G., Savas, P., Lai, J., Chen, A.X.Y., Oliver, A.J., Teo, Z.L., Todd, K.L., Henderson, M.A., Giuffrida, L., Petley, E.V., et al. (2020). Macrophage-Derived CXCL9 and CXCL10 Are Required for Antitumor Immune Responses Following Immune Checkpoint Blockade. Clin Cancer Res 26, 487-504. 10.1158/1078-0432.CCR-19-1868.
6. Schwarz, J., Bierbaum, V., Vaahtomeri, K., Hauschild, R., Brown, M., de Vries, I., Leithner, A., Reversat, A., Merrin, J., Tarrant, T., et al. (2017). Dendritic Cells Interpret Haptotactic Chemokine Gradients in a Manner Governed by Signal-to-Noise Ratio and Dependent on GRK6. Curr Biol 27, 1314-1325. 10.1016/j.cub.2017.04.004.
7. Sarris, M., and Sixt, M. (2015). Navigating in tissue mazes: chemoattractant interpretation in complex environments. Curr Opin Cell Biol 36, 93-102. 10.1016/j.ceb.2015.08.001.
8. Boldajipour, B., Mahabaleshwar, H., Kardash, E., Reichman-Fried, M., Blaser, H., Minina, S., Wilson, D., Xu, Q., and Raz, E. (2008). Control of chemokine-guided cell migration by ligand sequestration. Cell 132, 463-473. 10.1016/j.cell.2007.12.034.
9. Song, J., Wu, C., Korpos, E., Zhang, X., Agrawal, S.M., Wang, Y., Faber, C., Schafers, M., Korner, H., Opdenakker, G., et al. (2015). Focal MMP-2 and MMP-9 activity at the blood-brain barrier promotes chemokine-induced leukocyte migration. Cell Rep 10, 1040-1054. 10.1016/j.celrep.2015.01.037.
10. Alanko, J., Ucar, M.C., Canigova, N., Stopp, J., Schwarz, J., Merrin, J., Hannezo, E., and Sixt, M. (2023). CCR7 acts as both a sensor and a sink for CCL19 to coordinate collective leukocyte migration. Sci Immunol 8, eadc9584. 10.1126/sciimmunol.adc9584.
11. Sun, F., Zeng, J., Jing, M., Zhou, J., Feng, J., Owen, S.F., Luo, Y., Li, F., Wang, H., Yamaguchi, T., et al. (2018). A Genetically Encoded Fluorescent Sensor Enables Rapid and Specific Detection of Dopamine in Flies, Fish, and Mice. Cell 174, 481-496 e419. 10.1016/j.cell.2018.06.042.
布林凯斯上新趋化因子 CXCL10 荧光探针产品:

同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。