肺部是人体的重要免疫屏障,持续面临空气中的病原体或过敏原的挑战。2型免疫反应在维持肺部屏障功能和抵御真菌或寄生虫感染中起关键作用,功能失调可能导致过敏性疾病,如哮喘。哮喘患者的症状常在进食后加重,但其背后的病理生理机制尚不完全清楚。肺部不仅存在丰富的免疫细胞,还受到来自感觉神经、交感神经和副交感神经的广泛调控。越来越多的证据表明,神经信号对2型天然淋巴细胞(ILC2s)等免疫细胞具有重要的调节作用。因此,进食后副交感神经信号对肺部2型免疫反应的潜在影响值得深入研究。
2025年1月20日,北京大学第三医院肿瘤中心杨竞团队与北京大学第三医院付卫院长团队合作在Neuron杂志发表了题为“Postprandial Parasympathetic Signals Promote Lung Type 2 Immunity”论文,研究进食后副交感神经信号如何增强小鼠模型中的肺部2型免疫反应,并揭示了这一过程的神经免疫机制。研究结果表明,进食诱导的副交感神经激活通过作用于肺部2型天然淋巴细胞(ILC2s)上的毒蕈碱型乙酰胆碱受体4(Chrm4),促进了肺部2型免疫反应,这一机制可能有助于保护机体免受食物相关病原体的侵害。
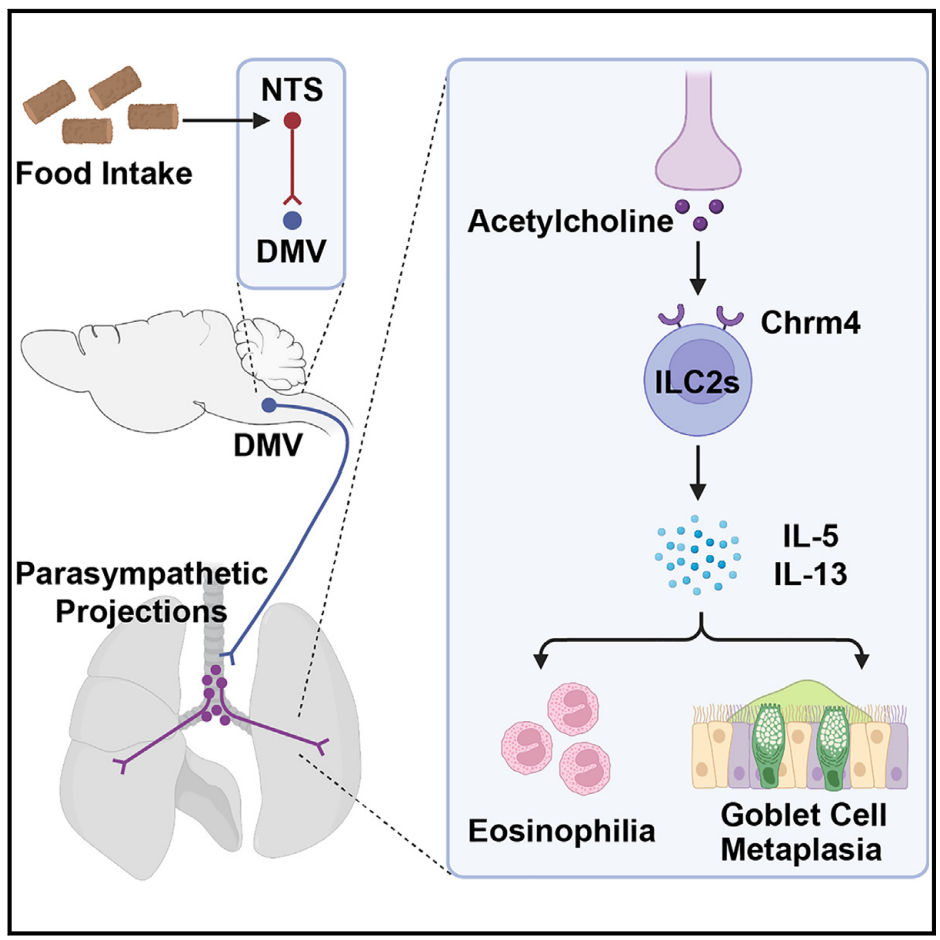
首先,研究利用小鼠2型免疫相关哮喘模型——通过鼻内给予重组小鼠IL-33来诱导肺部2型免疫反应。IL-33处理的小鼠随后被喂食正常饲料,以测试是否会影响2型免疫反应。在进食后3小时内,2型细胞因子IL-5和IL-13的mRNA水平显著增强(图1A),而在6小时左右恢复到基线水平。相应地,ELISA分析证实,进食条件下肺组织中IL-5和IL-13蛋白的含量增加(图1B)。尽管进食没有改变ILC2s的细胞数量(图1C)或它们的增殖(图1D),但通过荧光激活细胞分选(FACS)评估,发现它显著促进了ILC2s中2型细胞因子的蛋白表达(图1E)。此外,嗜酸性粒细胞的招募,作为2型免疫的一个关键特征,在进食小鼠的肺组织中也有所增加(图1F)。与此同时,作者发现进食能诱导由木瓜蛋白酶鼻内处理触发的2型免疫反应增强。值得注意的是,IL-33在这个由木瓜蛋白酶诱导的哮喘小鼠模型中发挥着关键作用。这些结果表明,进食后肺部2型免疫反应的加剧可以在小鼠模型中重现。
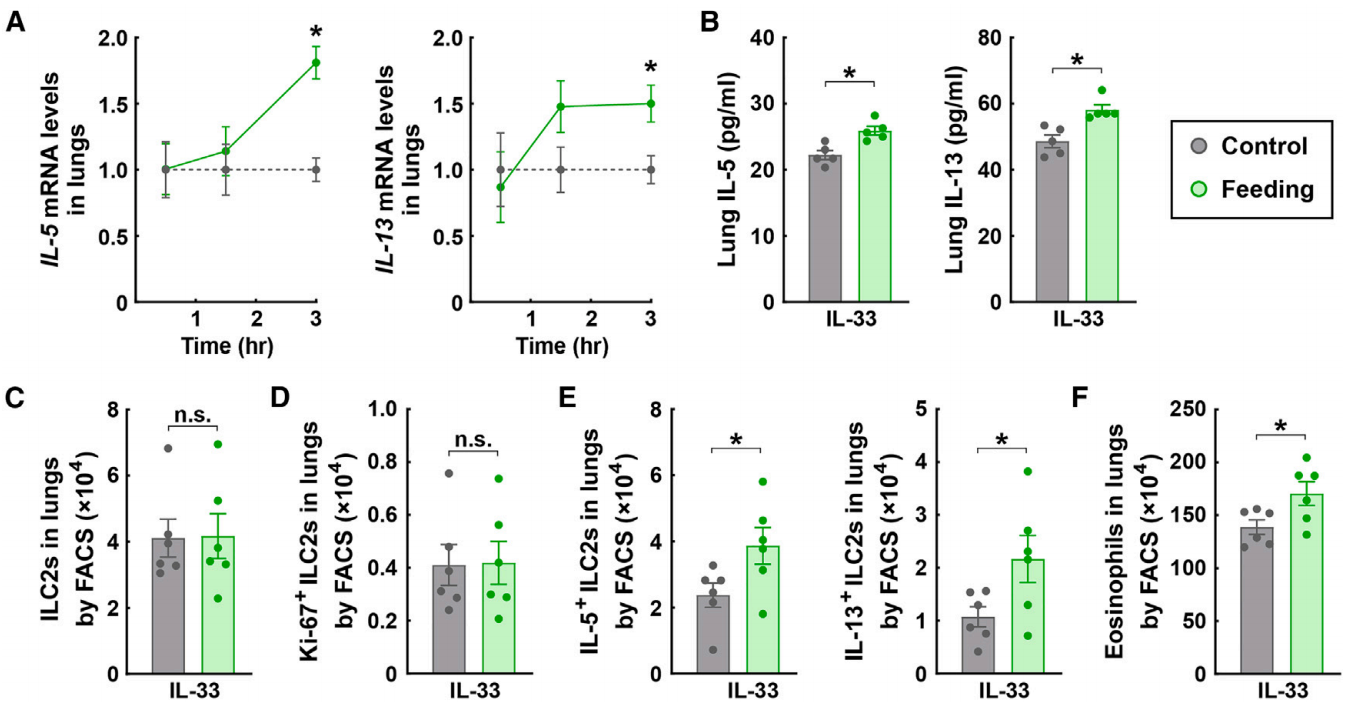
图1 进食促进由IL-33触发的肺2型免疫反应
对小鼠大脑进行了c-Fos免疫标记,c-Fos是早期神经元活动的特异性标记物。利用光片3D成像技术和组织透明处理技术对c-Fos免疫标记进行分析,结果显示,进食增加了迷走神经背运动核(DMV)中c-Fos阳性神经元的数量(图2G-2I),DMV是产生副交感神经节前信号的中枢区域。此外,通过全脑免疫标记和3D成像技术检测另一个早期神经元活动标记物——磷酸化核糖体蛋白S6(p-S6),也验证了进食诱导的DMV区域的副交感神经反应(图2J-2L)。相比之下,进食并未导致另一个参与副交感神经节前信号的脑区——疑核(NA)中c-Fos阳性或p-S6阳性神经元的增加(图2G-2L),这与DMV主要参与进食相关神经回路的观点一致。此外,作为副交感神经活动的生理指标,神经递质乙酰胆碱的血浆水平在进食后的小鼠中也有所升高(图2M)。
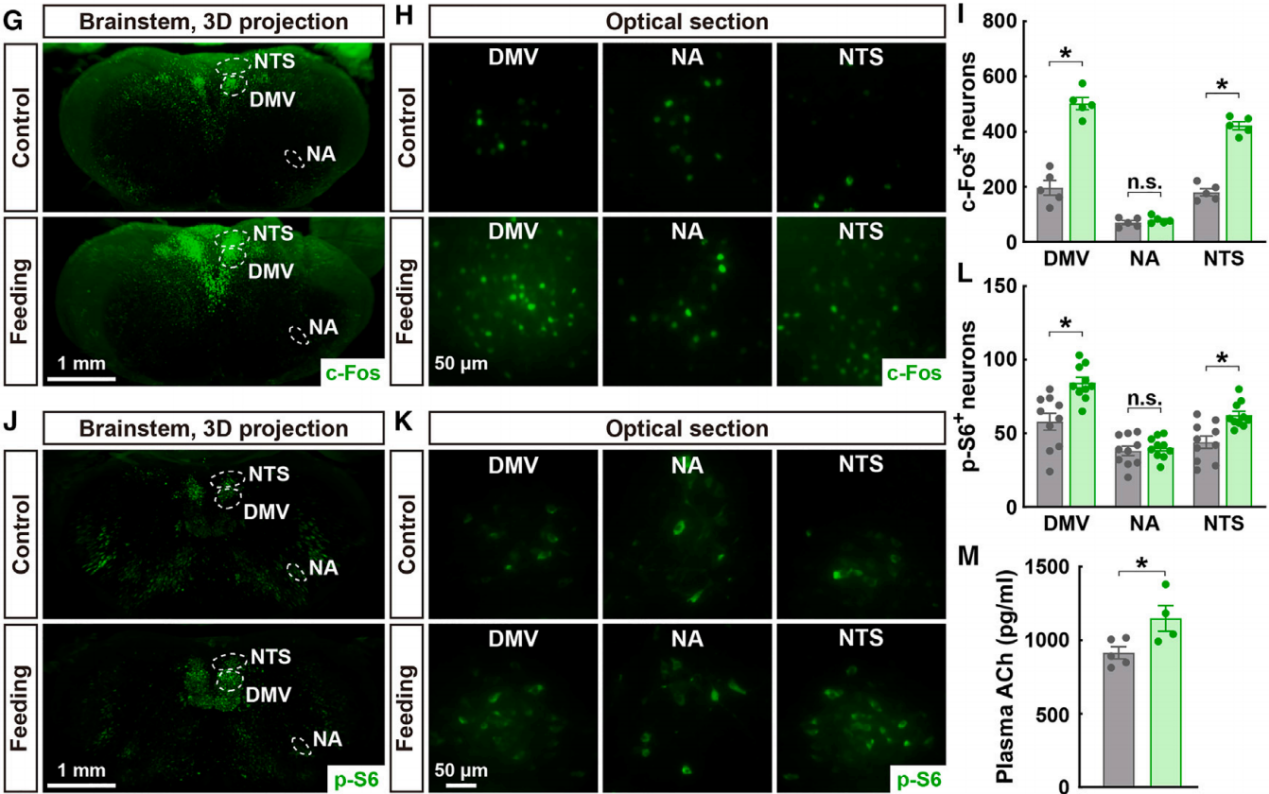
图2 进食诱导副交感神经激活
为了研究了餐后副交感神经信号是否会调节肺部2型免疫。副交感神经系统由神经节前投射,如来自DMV的投射,以及副交感神经节及其在外周组织中的神经节后神经支配组成。节前和节后副交感神经成分都是胆碱能的。利用全脑免疫标记和3D成像等技术全面检查了肺的副交感神经解剖学。此外,通过对VAChT(囊泡乙酰胆碱转运蛋白)和IL-5(由ILC2s产生的2型细胞因子)进行共免疫标记和3D成像,揭示了IL-33处理小鼠肺组织中副交感神经节后纤维与2型免疫反应的空间关联(图3A)。通过3D成像检测嗜酸性粒细胞的特异性标记物Siglec-F,发现IL-33诱导的嗜酸性粒细胞募集也与这些VAChT阳性神经纤维在空间上相关(图3B)。这些解剖学评估支持了副交感神经信号可能影响肺部2型免疫的可能性。因此,作者采用了化学遗传学方法来模拟进食诱导的副交感神经激活。小鼠DMV注射表达hM3D(Gq)的AAV病毒(图3C),与对照小鼠相比,接受AAV-hM3D(Gq)注射的小鼠在CNO处理后,其肺部IL-33诱导的2型细胞因子的mRNA水平显著提高(图3D)。
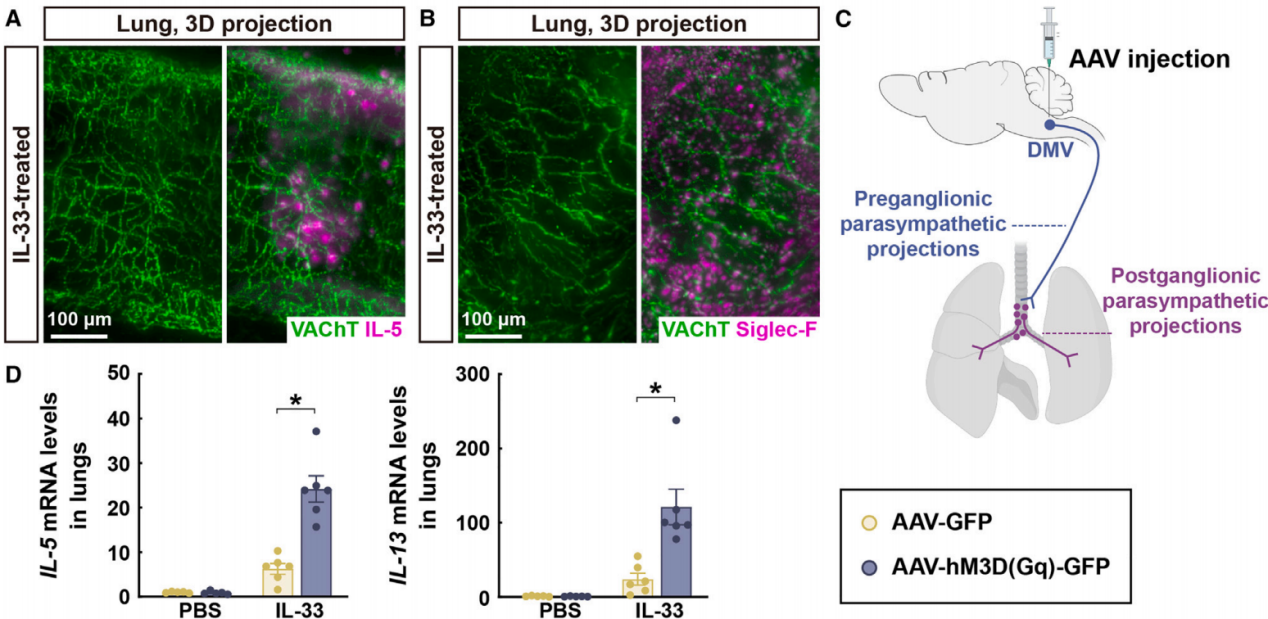
图3 节后副交感神经输入参与与肺部2型免疫反应
荧光激活细胞分选(FACS)分析显示,在接受AAV-hM3D(Gq)注射的小鼠中,IL-33处理的肺部积累了更多的嗜酸性粒细胞(图4E)。这种嗜酸性粒细胞的增加可以通过对Siglec-F阳性免疫细胞的3D成像来验证(图4F和4G)。此外,通过苏木精-伊红(H&E)染色(图4H和4I)或阿辛蓝-过碘酸雪夫(AB-PAS)染色(图4J和4K)检查的肺部病理变化,因副交感神经信号的化学遗传激活而加剧。值得注意的是,之前的研究表明CNO对野生型小鼠的肺部ILC2s没有影响。此外,在PBS处理的对照条件下,CNO并未引起AAV-hM3D(Gq)注射小鼠的任何可检测的肺部炎症,从而排除了这种化学遗传配体的非特异性作用(图4H-4K)。这些结果表明,源自DMV的副交感神经信号足以增强肺部2型免疫反应。
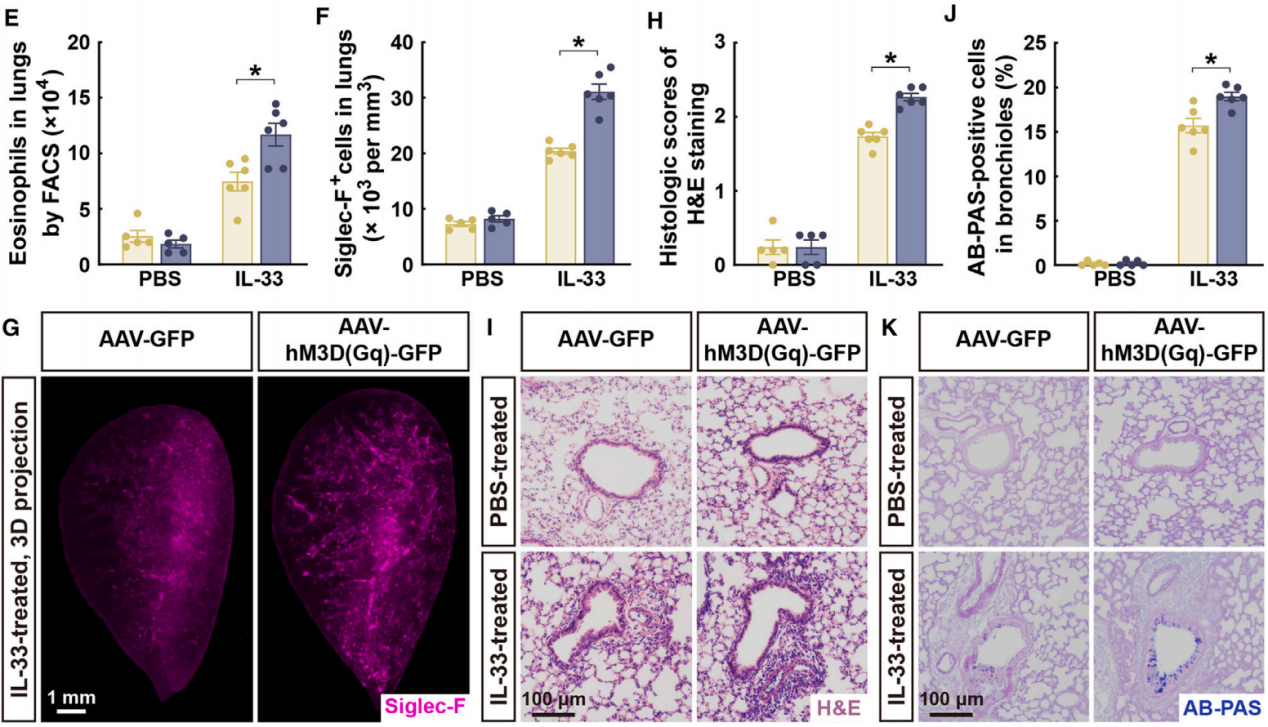
图4 化学遗传激活副交感神经增强了肺部2型免疫反应
随后,研究团队探讨了阻断肺部副交感神经信号的效果。首先,通过鼻内给予毒蕈碱型胆碱能受体拮抗剂——溴化异丙托品,对小鼠进行处理(图5A)。这种对局部副交感神经信号的药理学阻断能够使IL-33诱导的2型细胞因子表达恢复正常水平,否则这些细胞因子会在进食后增加(图5B)。类似地,溴化异丙托品也消除了进食诱导的对木瓜蛋白酶的2型免疫反应增强(图5C)。接下来,采用迷走神经切断术(vagotomy)这种外科手术方法来阻断节前副交感神经输入(图5A)。正如预期的那样,这种手术操作并未影响肺部节后副交感神经纤维的存在。迷走神经切断术显著降低了IL-33诱导的IL-5和IL-13的表达,这一点通过qPCR分析(图5D)和ELISA(图5E)得到了证实。相应地,通过H&E染色(图5F和5G)或AB-PAS染色(图5H和5I)观察到,手术阻断节前副交感神经信号减轻了肺部病理变化。值得注意的是,与接受假手术的小鼠相比,接受PBS处理的迷走神经切断术小鼠并未显示出可检测的肺部炎症(图5F-5I)。与此同时,木瓜蛋白酶诱导的2型细胞因子表达和组织病理变化在迷走神经切断术小鼠的肺部也显著降低。此外,作者在小鼠DMV注射表达hM4D(Gi)的AAV病毒,有效地减少了IL-33处理的小鼠进食后肺组织中2型细胞因子和嗜酸性粒细胞招募的增强。
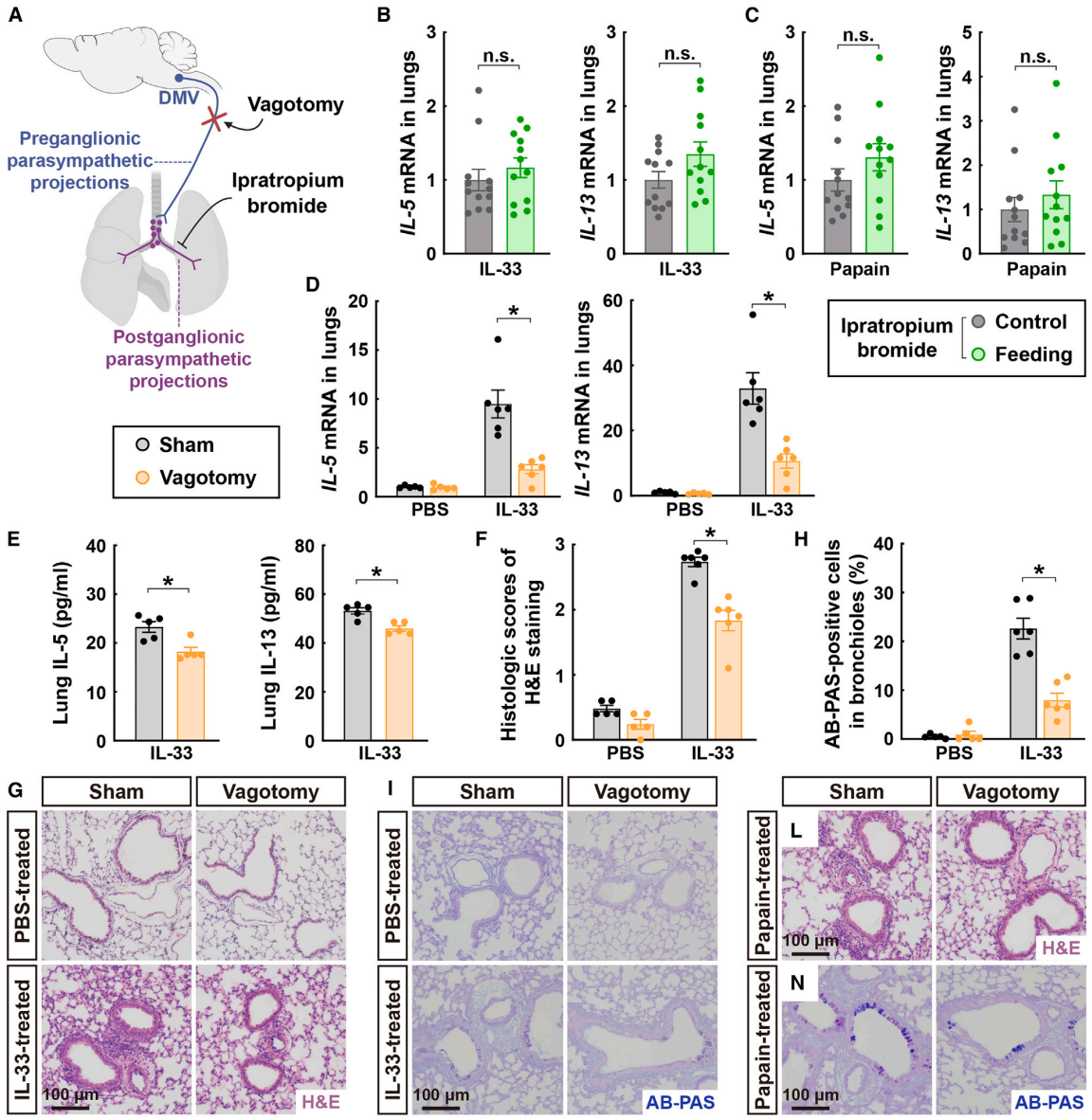
图5 副交感神经信号的阻断降低了肺部2型免疫
通过FACS技术分离了小鼠肺部的ILC2s,并对其进行了RNA测序(RNA-seq)。结果显示,Chrm4是小鼠ILC2细胞中表达的主要神经递质受体家族成员。qPCR分析进一步确认了Chrm4在小鼠肺ILC2s中的特异性表达(图6A),并且这种表达在IL-33刺激下并未显著改变。此外,作者还对小鼠肺组织中的其他主要免疫细胞类型进行了单细胞RNA测序(scRNA-seq),结果显示这些细胞群体中均未检测到Chrm4的表达。在Chrm4基因敲除(Chrm4⁻/⁻)小鼠的肺组织中,进食诱导的IL-33触发的2型细胞因子的增强被抑制,这通过qPCR分析(图6B)和ELISA(图6C)得到证实。此外,尽管Chrm4的缺失并未影响IL-33处理的肺部ILC2s的细胞数量(图6D),但它有效地减少了嗜酸性粒细胞的募集(图6E-6G)。相应地,IL-33诱导的肺部病理变化在Chrm4⁻/⁻小鼠中得到缓解(图6H-6K)。与此同时,木瓜蛋白酶诱导的2型细胞因子表达、嗜酸性粒细胞募集和肺部病理变化也通过Chrm4的缺失得到了类似的改善。
为了验证Chrm4在ILC2s中的免疫调节作用,作者构建了一种嵌合鼠,使用携带CD90.2的Chrm4⁺/⁺和Chrm4⁻/⁻同窝小鼠作为实验对象,通过抗CD90.2抗体介导的方法清除小鼠CD90.2阳性的ILC2细胞。将CD90.1+野生型肺ILC2s(这些细胞对CD90.2抗体具有抵抗力)转移到ILC2细胞被清除的小鼠体内。通过这种方式,嵌合鼠体内保留了来自供体的ILC2细胞,同时原有的ILC2细胞被清除。这种设计能够在嵌合鼠中特异性地研究ILC2的功能,而不受其他类型细胞的影响。在用IL-33(图6L)或木瓜蛋白酶处理后,两种嵌合小鼠(Chrm4⁻/⁻和Chrm4⁺/⁺)的肺组织中2型细胞因子的表达水平相似,嗜酸性粒细胞募集没有显著差异(图6M-6O),肺部病理反应也相似(图6P-6S)。
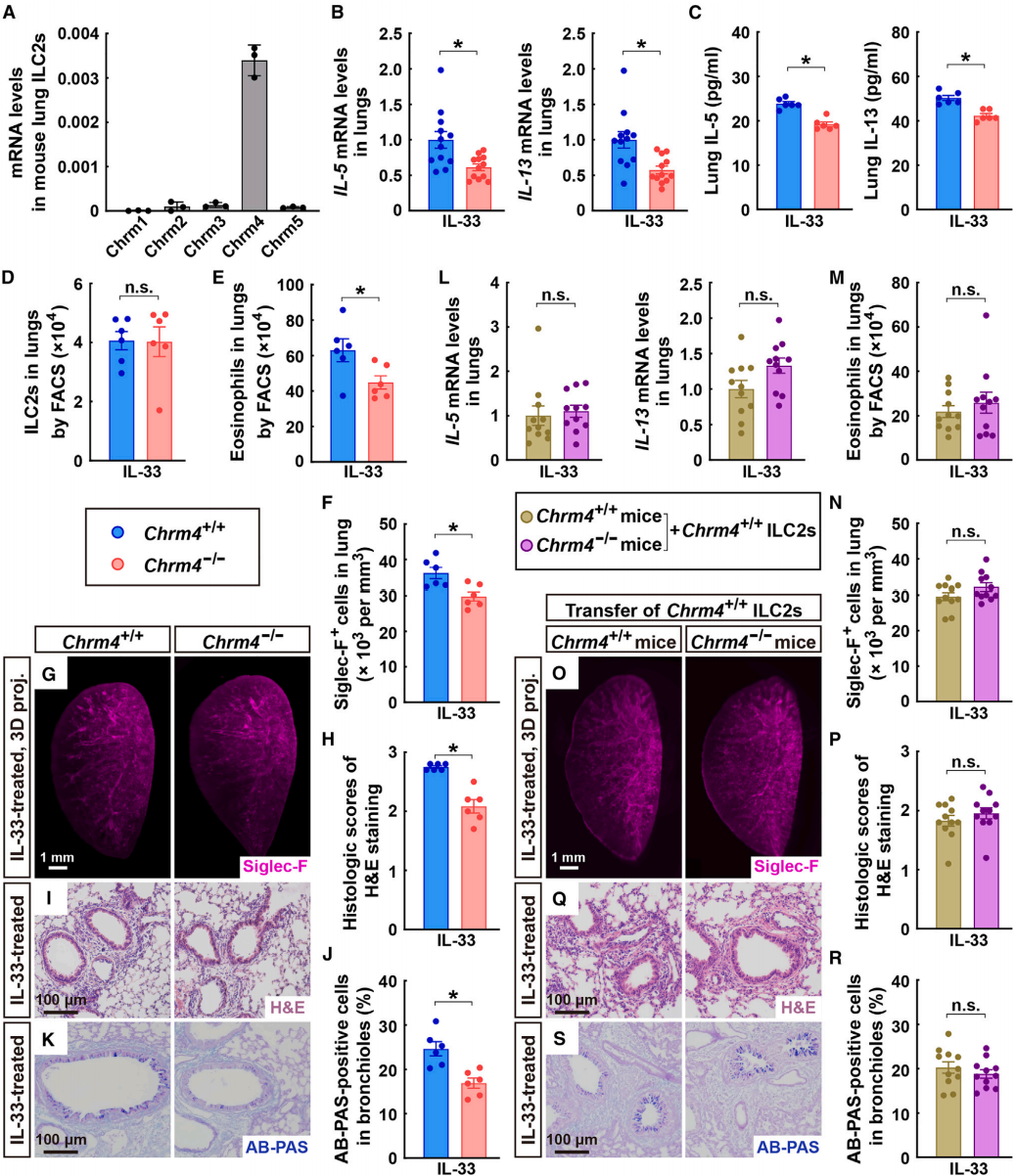
图6 Chrm4基因缺失可减轻ILC2介导的肺部免疫
相反,将Chrm4⁺/⁺或Chrm4⁻/⁻的ILC2s移植到Rag2⁻/⁻; Il2rg⁻/⁻小鼠体内,这种小鼠缺乏内源性ILC2s,以及T细胞和B细胞。在进行ILC2s移植后,Rag2⁻/⁻; Il2rg⁻/⁻小鼠的肺组织中Chrm4⁺/⁺和Chrm4⁻/⁻ ILC2s的细胞数量相似(图7A)。然而,在进食条件下,Chrm4⁻/⁻嵌合小鼠在IL-33刺激后,肺部2型细胞因子的表达水平显著降低(图7B)。此外,与接受Chrm4⁺/⁺ ILC2s的Rag2⁻/⁻; Il2rg⁻/⁻小鼠相比,Chrm4⁻/⁻嵌合小鼠中IL-33诱导的嗜酸性粒细胞募集也明显减少(图7C-7E)。因此,Chrm4⁻/⁻嵌合小鼠的IL-33诱导的肺部病理变化得到了缓解(图7F-7I)。作者进一步从Chrm4⁺/⁺或Chrm4⁻/⁻小鼠经IL-33处理的肺组织中分选了ILC2s用于体外培养。随后,ILC2s直接暴露于副交感神经递质乙酰胆碱中。乙酰胆碱处理足以刺激野生型ILC2s中2型细胞因子的表达,但在Chrm4⁻/⁻ ILC2s中,这种免疫调节效应完全消失(图7J)。此外,RNA测序(RNA-seq)证实,乙酰胆碱的体外处理能够显著上调ILC2s中的2型细胞因子,但并不影响其细胞增殖(图7K),这与上述IL-33处理的小鼠模型中的发现一致(图1D和1E)。这些结果说明副交感神经信号可以通过Chrm4作用于ILC2s,从而促进肺部2型免疫。
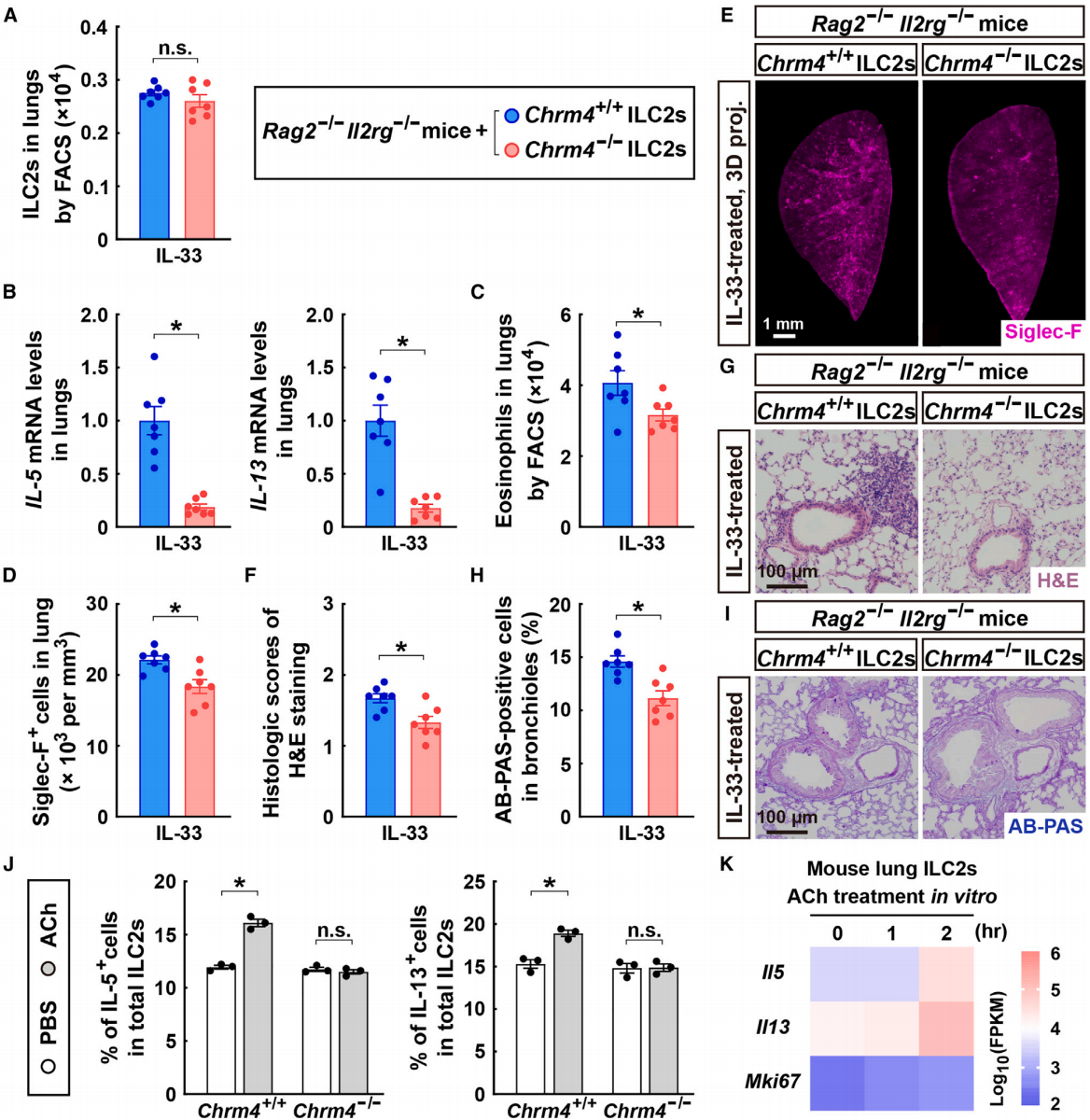
图7 在Chrm4促进肺部2型免疫应答中ILC2的特异性功能
孤束核(NTS)已被广泛认为是控制DMV节前副交感神经元的关键区域。为了确定这种进食诱导的NTS激活是否与肺部2型免疫的调控相关,作者利用了基于Fos-CreERT2小鼠的靶向重组活动神经元群体(TRAPs)策略。将表达Cre依赖性化学遗传激活剂hM3D(Gq)的病毒注射到Fos-CreERT2小鼠的NTS区域,并通过给予4-羟基他莫昔芬(4-OHT)来捕获进食激活的神经元(图8A)。与注射对照病毒的小鼠相比,注射CNO激活被捕获的NTS神经元足以刺激DMV神经元活动(图8B-8D)。更重要的是,化学遗传激活被捕获的NTS神经元促进了IL-33诱导的肺部2型细胞因子的表达(图8E)和嗜酸性粒细胞的募集(图8F),从而重现了进食诱导的2型免疫增强。这些结果表明NTS-DMV通路在副交感神经对肺部免疫的调控中起作用。
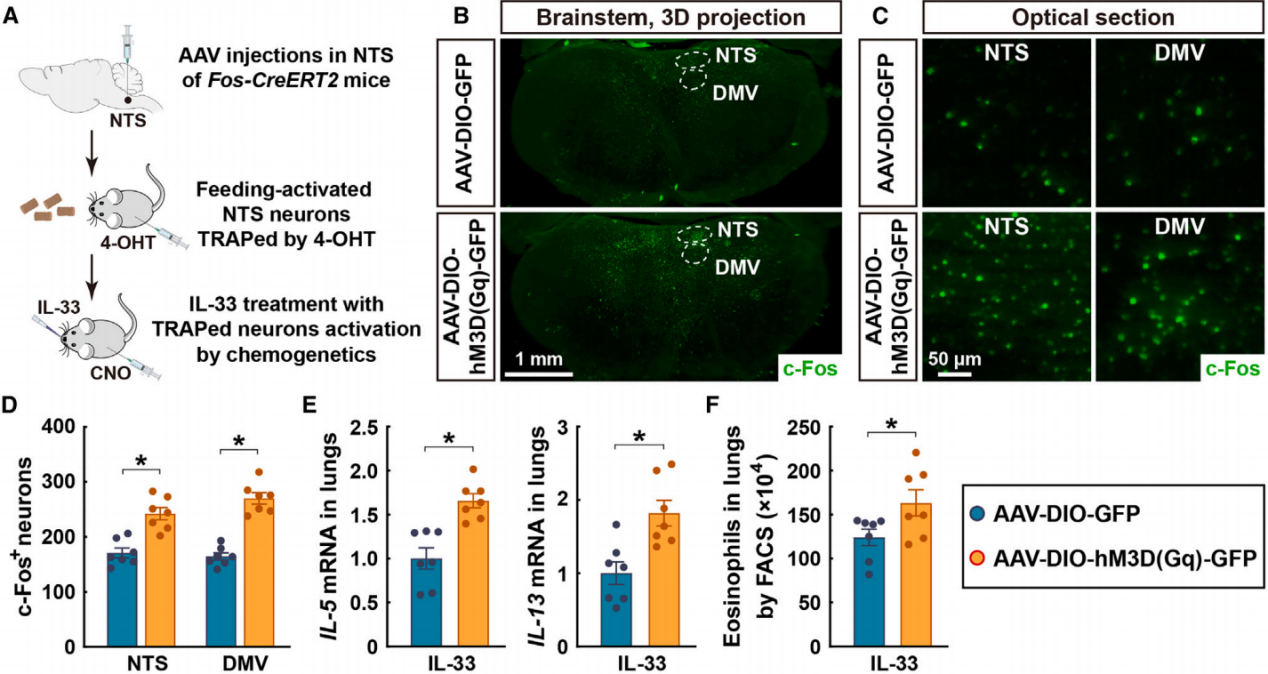
图8 进食诱导的NTS激活与肺部2型免疫的调控有关
最后,作者探索了这种肠道-大脑-肺反射的神经免疫机制的生理意义。在没有IL-33或木瓜蛋白酶刺激的情况下,进食本身也足以诱导野生型小鼠肺组织中2型细胞因子的上调(图9G)和嗜酸性粒细胞的募集(图9H)。因此,作者推测进食诱导的肺部2型免疫增强可能作为一种保护机制,以抵御进食过程中潜在的病原体吸入。将这种掺杂了烟曲霉真菌孢子的饲料喂给小鼠,并通过qPCR分析检测特异性18S rRNA,以分析它们肺组织中的真菌负荷(图9I)。结果发现,阻断节后副交感神经输入的手术减弱了进食后的2型免疫反应(图9J),导致进食后24小时肺部的真菌负荷显著增加(图9K)。此外,Chrm4基因的缺失也导致了2型免疫反应的类似降低(图9L),并且无法有效清除肺组织中的烟曲霉(图9M)。这些结果表明,副交感神经信号(由肠道-大脑-肺反射引发)的进化,可能是为了应对进食过程中暴露于食物相关病原体的风险。
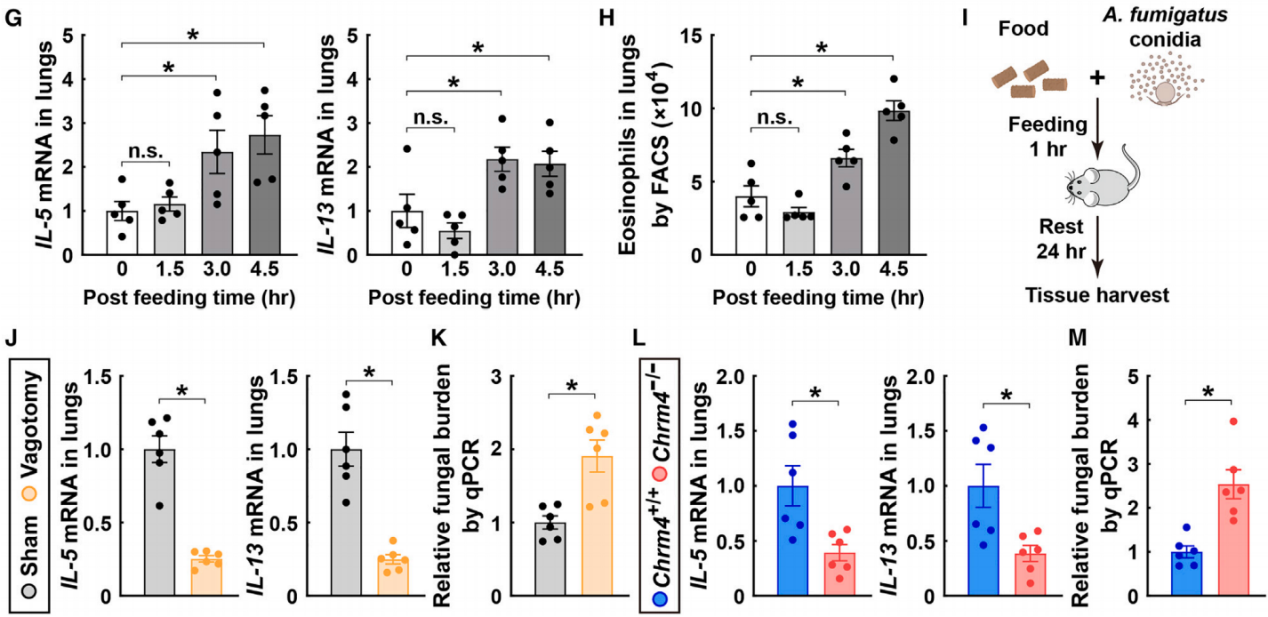
图9 健康状态下进食促进肺2型免疫反应
本文不仅阐明了进食后哮喘症状加重的潜在病理生理机制,还为开发新的治疗策略提供了理论基础。通过调节副交感神经信号或靶向Chrm4,未来有望开发出预防或缓解进食相关哮喘发作的新疗法,同时也为理解神经免疫相互作用在其他疾病中的作用提供了新的视角。
相关阅读:
❖客户文章︱Nat. Commun.︱中山大学叶小菁/林伟杰/吴文团队解析蓝光治疗AD机制
❖客户文章 | Science︱复旦大学刘星/马兰团队揭示小鼠半球间BLA-AC-NAc回路调控负面情绪
❖客户文章 | 李慧艳/张宇程/周涛合作发现痛觉神经调控免疫反应新机制