荧光蛋白的出现彻底革新了现代生物学的研究范式。1962年,日本科学家下村修在水母中发现了绿色荧光蛋白(Green Fluorescent Protein, GFP)1 。1994年,查尔菲团队在线虫中成功表达GFP2 ;同年,钱永健团队利用人工进化手段,将GFP改造成蓝色荧光蛋白3 。之后,生物学研究在荧光蛋白的推动下获得井喷式发展;同时,荧光蛋白作为一个新兴的学科分支开始逐渐发展,不同颜色的荧光蛋白相继被开发出。2002年,詹妮弗团队发现了光激活绿色荧光蛋白(PhotoActivatable Green Fluorescent Protein, PA-GFP),开启了光控荧光蛋白的发展4 。随后光开关荧光蛋白(PhotoSwitchable Fluorescent Protein, PSFP)、光转换荧光蛋白(Photo-Convertible Fluorescent Protein, PCFP)被相继开发出。伴随着荧光蛋白的发展,基于光控荧光蛋白的超分辨成像技术也相继被开发出来,比如光激活定位显微成像技术(PhotoActivated Localization Microscopy, PALM)5 、可逆饱和光致荧光跃迁(Reversible Saturable Optical Fluorescence Transition, RESOLFT)6 。
近年来,随着显微成像技术的发展,研究者对荧光蛋白的性能也提出了更高的要求。比如:光电关联成像技术(Correlative Light and Electron Microscopy, CLEM)通过结合光学显微镜提供研究目标的定位和分布信息与电子显微镜提供研究目标的超微环境和结构信息,能够结合两种成像技术的优势。然而,电镜制样过程中用到的锇酸(OsO4)是一种强氧化剂,会导致荧光蛋白的荧光信号急剧淬灭。加之,后续制样过程的脱水、高温包埋等操作,最终在超薄切片上的荧光信号所剩无几。尽管此前已有报道抗OsO4的荧光蛋白,但它们的荧光保留量通常不超过20%,极大地限制了光电关联成像技术的发展。组织透明化技术主要通过去除组织中的脂质,能够让样品实现光学透 明,有利于三维组织成像,尤其是介观脑连接图谱的绘制。然而,由于受到现有荧光蛋白的热稳定性限制,组织透明化技术通常需要在室温或37℃以下的条件进行,使得透明化过程耗时较长,通常需要一至数周才能达到最佳透明度,限制了成像的效率。活细胞超分辨成像技术则要求荧光蛋白具有较高的光稳定性,以实现长时程的活细胞成像。
2020年,mEosEM的成功开发,打破了长期以来国际上普遍认为荧光蛋白不能抵抗常规电镜制样的传统观念,首次实现了常规电镜制样后同层切片的超分辨光电关联成像7 。2022年,具有极强化学稳定性的黄色荧光蛋白hfYFP被应用于光电关联成像和膨大成像8 。同年,超亮超稳定绿色荧光蛋白StayGold王炸式震惊整个领域9 。随后,三个单体版本的StayGold被相继报道10–12 。荧光蛋白正式进入一个新的时代——“超稳定荧光蛋白”时代。相较于绿色和黄色荧光蛋白,红色荧光蛋白具有天然优势,特别是在光毒性、自发荧光、光散射以及组织穿透力等方面。然而,现有红色荧光蛋白的稳定性存在很大的不足。荧光蛋白领域的知名专家Atsushi Miyawaki曾在一次会议中提到:那个开发出超稳定红色单体荧光蛋白幸运儿将会被历史所牢记。
2025年4月17日,福建医科大学付志飞团队联合西湖大学Kiryl Piatkevich团队、厦门大学郑清炳(夏宁邵教授团队)以及北京脑科学与类脑研究所赵瑚团队在Nature Methods杂志以长文形式报道了题为“A highly stable monomeric red fluorescent protein for advanced microscopy”的文章。该研究基于蛋白质晶体结构突破性地开发出超稳定性单体红色荧光蛋白mScarlet3-H(又名mYongHong,论文预印版使用名,并以该命名在多个实验室推广使用,寓意:永红)。

首先,相较于首代耐电镜制样荧光蛋白mEosEM,mYongHong的抗锇酸特性提高了500%,常规电镜制样后荧光信噪比提升了20倍,是目前光电关联成像的首选探针。利用mYongHong,研究团队对线粒体、内质网、脂滴、核膜及细胞核等亚细胞器实现了高信噪比的光电关联成像。
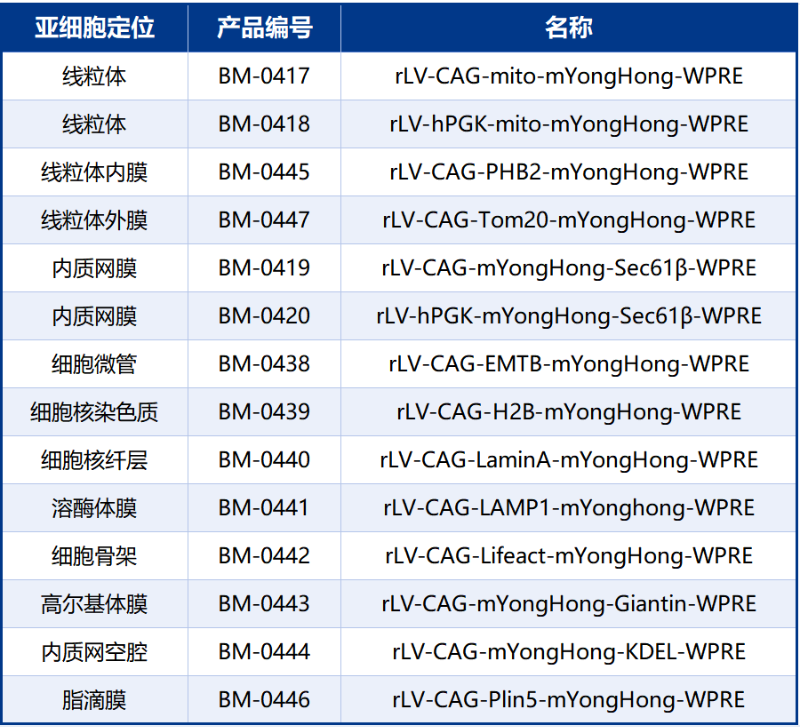
推荐产品:布林凯斯BrainCase公司提供全系列LV-mYongHong细胞器荧光探针(见表一),助您轻松开展高精度亚细胞研究。
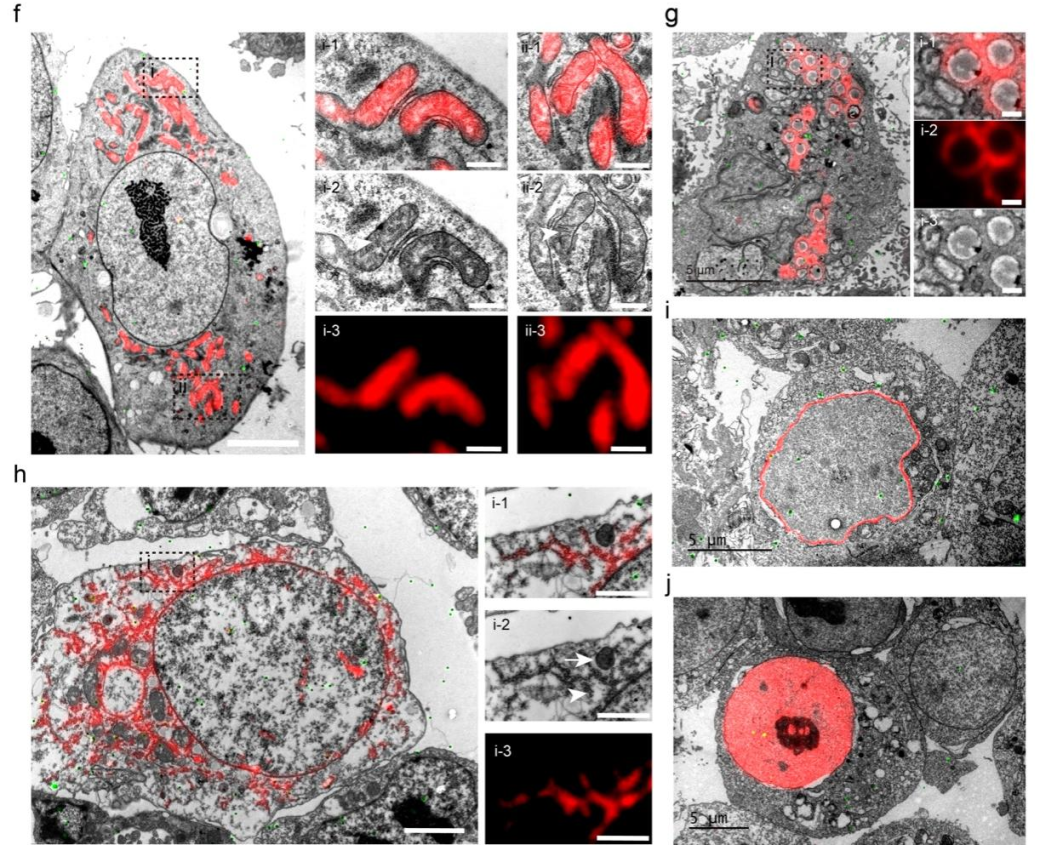
其次,mYongHong具有极强的热稳定性,能够在90℃高温处理1小时后保留90%的荧光信号。基于此,研究团队开发了小鼠全脑快速透明化方法,将透明化的制样周期从传统方法的1周缩短至24小时,并且保留足够的荧光信号用于后续高质量的三维成像,极大地提升了介观脑图谱的绘制效率(提升7倍)。
推荐产品:适用于透明化全脑成像及各类神经科学研究的产品见AAV-mYongHong产品列表(表二)。

最后,mYongHong表现出较强的耐光漂白特性,是目前最稳定的单体红色荧光蛋白,能够应用于3D-SIM活细胞长时程成像;更值得注意的是,mYongHong光稳定性使得双色活细胞长时程STED超分辨成像成为可能。
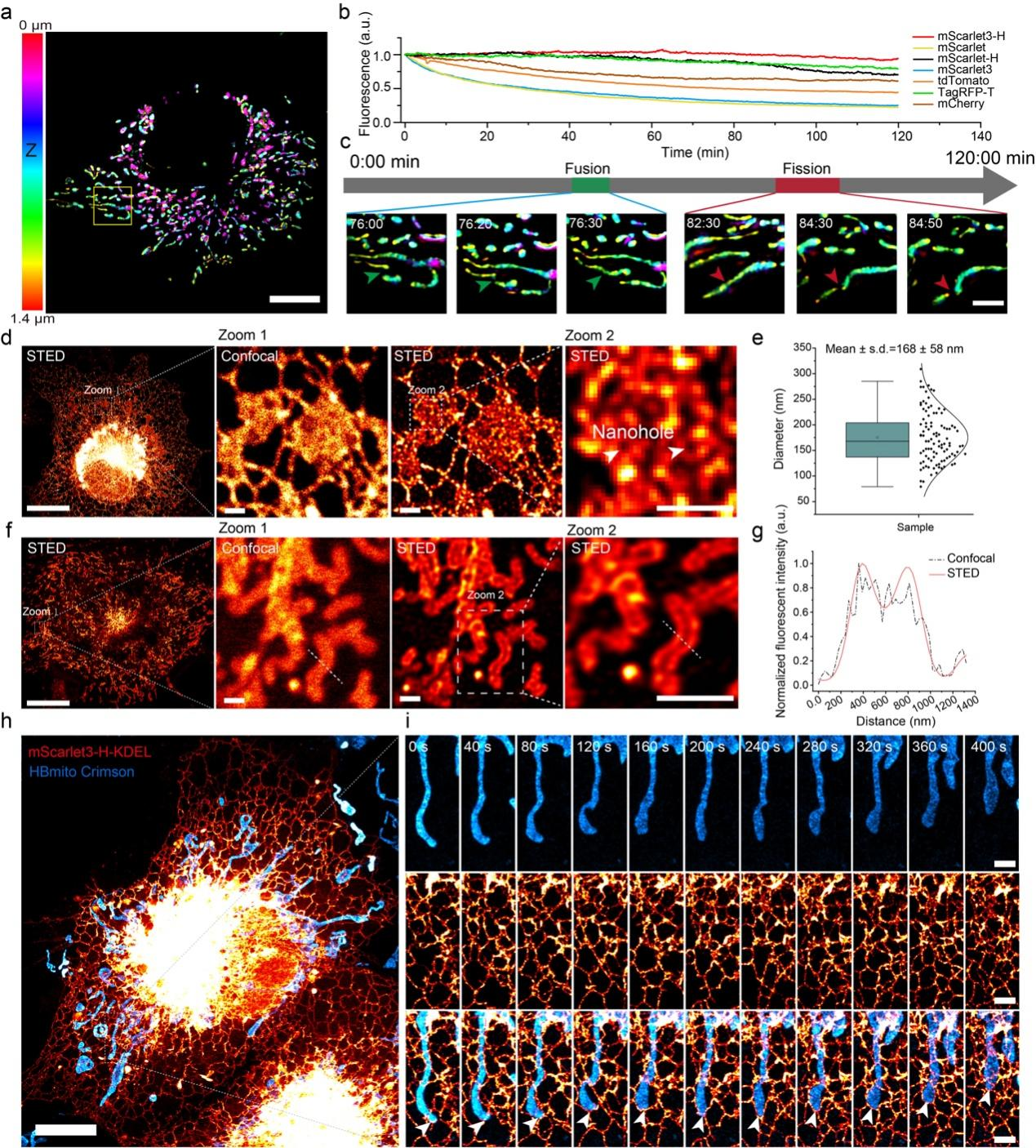
mYongHong的成功开发,突破了单体红色蛋白稳定性普遍较差的技术瓶颈,拓宽了超稳定荧光蛋白的光谱范围,为后续红色功能荧光探针的开发奠定了基础。
mYongHong的所有相关质粒已共享在质粒免费共享库Wekwikgene:https://wekwikgene.wllsb.edu.cn/plasmids?search=mYongHong。相关AAV病毒可在国内知名病毒公司 布林凯斯(BrainCase)获取。相关Cre重组酶依赖性荧光报告小鼠可在国内知名小鼠公司 金致和 获取。所有质粒、病毒及小鼠也可向 fuzhifei@fjmu.edu.cn 获取。
福建医科大学作为论文的第一单位,熊海艳(福建医科大学博士一年级)、畅启元(福建医科大学硕士二年级)、丁嘉懿(北京脑科学与类脑研究中心博士三年级)、王书远(福建医科大学公共技术中心技术员)、张文皓(西湖大学博士四年级)、李煜(厦门大学博士三年级)及吴耀琛(福建医科大学直博二年级)为论文的第一作者,吴淙贤(福建医科大学)、郑清炳(厦门大学)、Kiryl D. Piatkevich(西湖大学)及付志飞(福建医科大学)为论文的通讯作者。该研究受到国家自然科学基金和福建省科技厅等项目的支持。
招聘启事:付志飞研究员团队的主要研究方向包括:超分辨光电关联成像技术、超稳定荧光探针及新型功能荧光探针的开发和应用研究。团队现招聘神经生物学、细胞生物学、光学工程、软件工程、机械工程等专业副研究员、博士后及科研助理数名,有意向者请联系:fuzhifei@fjmu.edu.cn.
表一:布林凯斯BrainCase 第一代 LV-mYongHong 细胞器荧光探针列表
表二:AAV—mYongHong 产品列表

同时布林凯斯也可提供各类定制服务请联系小布:18971216876(微信同号)或者咨询所在区域的销售经理获取更多信息。
参考文献:
2. Chalfie, M., Tu, Y., Euskirchen, G., Ward, W.W., and Prasher, D.C. (1994). Green Fluorescent Protein as a Marker for Gene Expression. Science 263, 802–805. https://doi.org/10.1126/science.8303295.
3. Heim, R., Prasher, D.C., and Tsien, R.Y. (1994). Wavelength mutations and posttranslational autoxidation of green fluorescent protein. Proc. Natl. Acad. Sci. 91, 12501–12504. https://doi.org/10.1073/pnas.91.26.12501.
4. Patterson, G.H., and Lippincott-Schwartz, J. (2002). A Photoactivatable GFP for Selective Photolabeling of Proteins and Cells. Science 297, 1873–1877. https://doi.org/10.1126/science.1074952.
5. Betzig, E., Patterson, G.H., Sougrat, R., Lindwasser, O.W., Olenych, S., Bonifacino, J.S., Davidson, M.W., Lippincott-Schwartz, J., and Hess, H.F. (2006). Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science 313, 1642–1645. https://doi.org/10.1126/science.1127344.
6. Hofmann, M., Eggeling, C., Jakobs, S., and Hell, S.W. (2005). Breaking the diffraction barrier in fluorescence microscopy at low light intensities by using reversibly photoswitchable proteins. Proc. Natl. Acad. Sci. 102, 17565–17569. https://doi.org/10.1073/pnas.0506010102.
7. Fu, Z., Peng, D., Zhang, M., Xue, F., Zhang, R., He, W., Xu, T., and Xu, P. (2020). mEosEM withstands osmium staining and Epon embedding for super-resolution CLEM. Nat. Methods 17, 55–58. https://doi.org/10.1038/s41592-019-0613-6.
8. Campbell, B.C., Paez-Segala, M.G., Looger, L.L., Petsko, G.A., and Liu, C.F. (2022). Chemically stable fluorescent proteins for advanced microscopy. Nat Methods, 1–10. https://doi.org/10.1038/s41592-022-01660-7.
9. Hirano, M., Ando, R., Shimozono, S., Sugiyama, M., Takeda, N., Kurokawa, H., Deguchi, R., Endo, K., Haga, K., Takai-Todaka, R., et al. (2022). A highly photostable and bright green fluorescent protein. Nat. Biotechnol. 40, 1132–1142. https://doi.org/10.1038/s41587-022-01278-2.
10. Ivorra-Molla, E., Akhuli, D., McAndrew, M.B.L., Scott, W., Kumar, L., Palani, S., Mishima, M., Crow, A., and Balasubramanian, M.K. (2023). A monomeric StayGold fluorescent protein. Nat. Biotechnol., 1–4. https://doi.org/10.1038/s41587-023-02018-w.
11. Zhang, H., Lesnov, G.D., Subach, O.M., Zhang, W., Kuzmicheva, T.P., Vlaskina, A.V., Samygina, V.R., Chen, L., Ye, X., Nikolaeva, A.Yu., et al. (2024). Bright and stable monomeric green fluorescent protein derived from StayGold. Nat. Methods, 1–9. https://doi.org/10.1038/s41592-024-02203-y.
12. Ando, R., Shimozono, S., Ago, H., Takagi, M., Sugiyama, M., Kurokawa, H., Hirano, M., Niino, Y., Ueno, G., Ishidate, F., et al. (2023). StayGold variants for molecular fusion and membrane-targeting applications. Nat. Methods, 1–9. https://doi.org/10.1038/s41592-023-02085-6.