曾经,科学家们认为大脑是 “免疫豁免” 的,它与免疫系统之间隔着一道不可逾越的屏障。1885 年,科学家发现给动物外周注射染料,染料无法进入大脑,这一现象让人们更加坚信大脑与免疫系统互不干涉。加上大脑组织移植后的排斥反应比外周组织弱,“大脑免疫豁免” 的观点便深入人心。甚至在发现大脑淋巴系统后,这个观点依旧被很多人坚持,因为大家觉得没有淋巴循环就意味着大脑和免疫系统是分离的。
然而,随着研究的不断深入,这个传统观念被彻底颠覆。现在我们知道,免疫系统在大脑的发育、日常运作和修复过程中都扮演着至关重要的角色。免疫细胞就像大脑的 “忠诚卫士”,分布在大脑的各个关键位置,守护着大脑的健康。由 Giulia Castellani 等人撰写的题为“Transforming the understanding of brain immunity”的综述,发表于Science,文章回顾了大脑免疫领域的研究进展,阐述了大脑与免疫系统从 “免疫特权” 到 “紧密联系” 的认知转变,探讨了大脑免疫细胞、免疫微环境及相关疾病机制,并展望了治疗策略,为深入理解大脑免疫及相关疾病治疗提供了重要参考。

自20世纪以来,研究发现免疫系统参与自身免疫性炎症疾病和神经发育障碍,提出“保护性自身免疫”概念。此外,还发现了大脑中的免疫微环境,包括脑膜、脉络丛、血管周围间隙等,以及大脑淋巴引流和与颅骨骨髓的连接,表明大脑与免疫系统存在紧密联系。大脑与免疫系统并非完全隔绝,而是存在复杂的相互作用,这种认识的转变为后续研究奠定了基础。
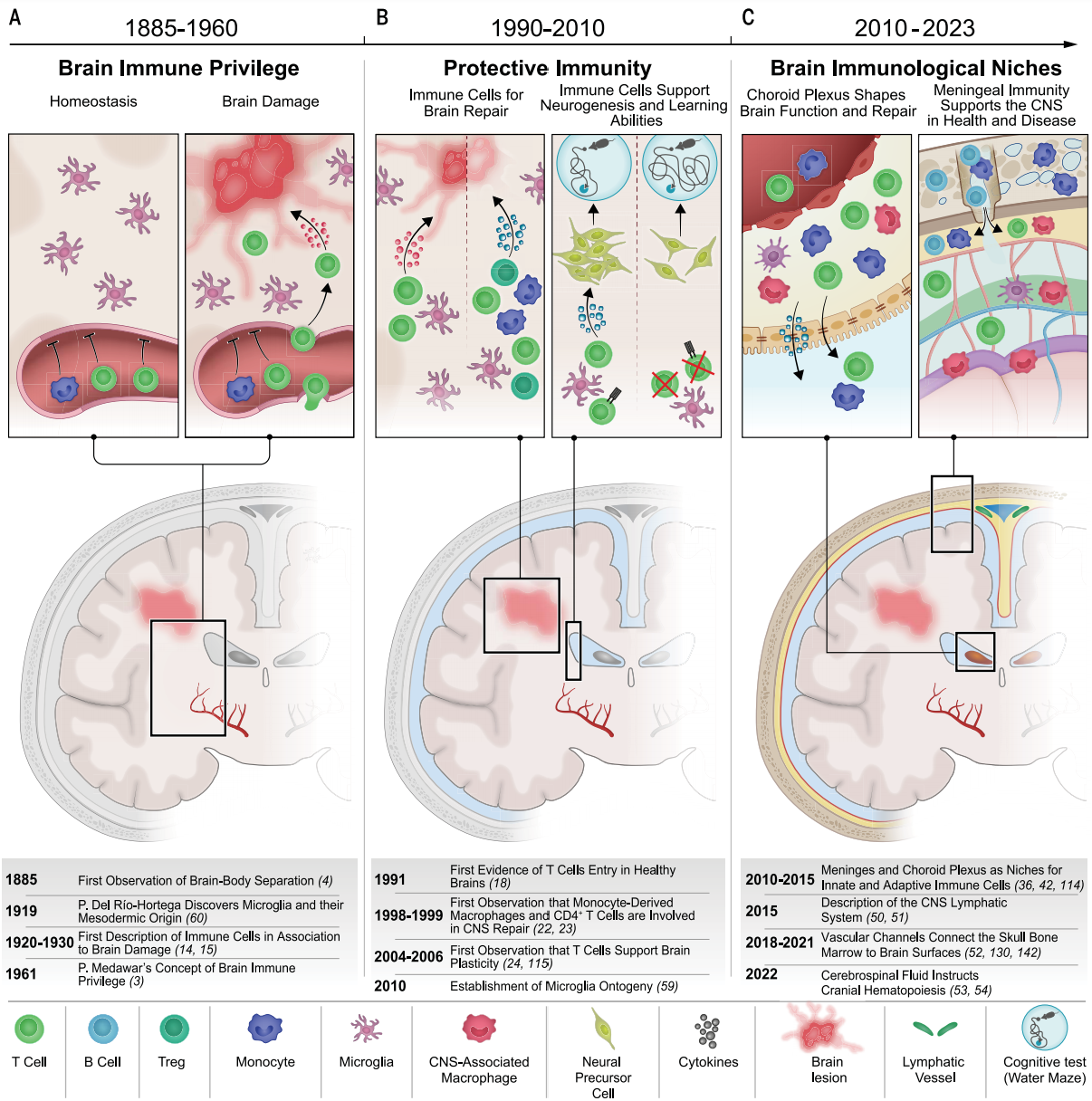
图1描绘大脑免疫新认知主要里程碑的时间轴。改变人们对大脑免疫理解的主要进展分为三个时期。(A)20世纪上半叶的发现支持了大脑“免疫豁免”的概念。根据这一观点,免疫细胞的浸润总是与中枢神经系统炎症和疾病状态相关。(B)20世纪末开始的早期发现将免疫反应在中枢神经系统维持和修复中的作用进行了阐释,随后还发现免疫细胞会影响神经发生和认知。(C)确定了大脑内不同的免疫微环境,固有免疫细胞和适应性免疫细胞可从这些微环境调节大脑功能和修复过程。
髓系细胞(Myeloid cells):髓系细胞中的小胶质细胞,早在胚胎发育时期就开始发挥作用了。从胚胎 9.5 天起,小胶质细胞的前体就从卵黄囊迁移到发育中的中枢神经系统,它们不仅参与神经发生、神经元存活的调控,还在髓鞘形成过程中贡献力量。成年后,小胶质细胞更是兢兢业业地维持着大脑的稳定状态,堪称大脑的 “巡逻兵”。但随着年龄的增长,小胶质细胞也会 “力不从心”。在人类和小鼠的老年大脑中,它们会积累脂质滴,活性氧和促炎细胞因子的分泌量增加,吞噬能力下降,这不仅会破坏血脑屏障,还会对成年神经发生和突触功能产生负面影响,与阿尔茨海默病、帕金森病等神经退行性疾病的发生发展密切相关。
适应性免疫细胞(Adaptive immune cells):除了髓系细胞,适应性免疫细胞在大脑中也有着不可或缺的作用。虽然淋巴细胞何时侵入中枢神经系统还没有定论,但研究发现,出生后 5 天耗尽小鼠体内的 CD4+ T 细胞会阻碍小胶质细胞的成熟,导致小鼠出现多种行为异常。而在成年阶段,CD4+ T 细胞对维持大脑的正常功能意义重大,它能帮助大脑应对精神压力、保持认知功能和正常的社会行为。不过,大脑衰老时,免疫细胞的平衡会被打破。比如,老年小鼠中分泌 IFN-γ 的 CD8+ T 细胞会侵入神经发生区域,抑制神经干细胞的增殖;自然杀伤细胞的积累也会导致神经发生能力下降。
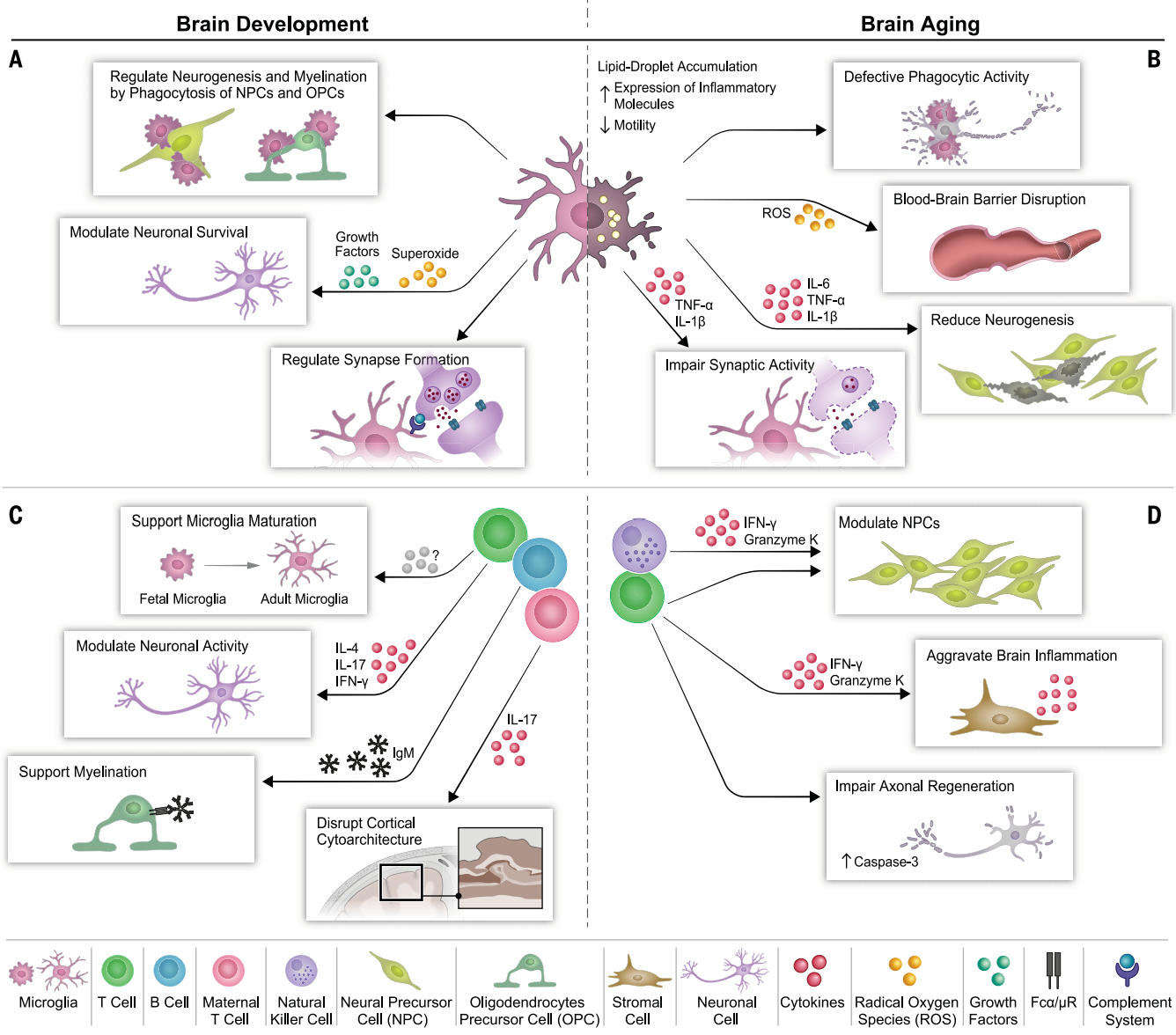
图2小胶质细胞和适应性免疫细胞在大脑发育和衰老过程中的影响。(A)小胶质细胞促进大脑健康发育的机制。(B)老年小胶质细胞的形态学和功能改变及其对年龄相关性神经退行性变的影响。(C)B和T淋巴细胞在脑发育过程中的作用。(D)淋巴细胞浸润脑实质可促进脑衰老的机制。
脑膜(Meninges):脑膜以前被认为只是保护大脑的 “盾牌”,现在却发现它是个充满免疫细胞的 “活跃战场”。这里有淋巴细胞和抗原呈递细胞,能呈递抗原、调节免疫细胞的招募和归巢。比如,脑膜中的 γδ T 细胞可以通过影响皮质谷氨酸释放神经元来调节焦虑情绪;肠道来源的 IgA + 浆细胞则像忠诚的 “卫士”,守护在硬脑膜静脉窦附近,防止血液中的病原体侵入大脑。
脉络丛(Choroid plexus):脉络丛位于脑室中,不仅参与调节脑脊液的成分和体积,还是免疫细胞进入大脑的重要 “关口”。这里的巨噬细胞分为不同类型,它们能感知外周炎症并做出反应。在急性中枢神经系统损伤或肌萎缩侧索硬化症等疾病中,脉络丛会成为 T 细胞和巨噬细胞进入大脑的通道。不过,随着年龄增长或在神经退行性疾病中,脉络丛中的 IFN 信号会失衡,对大脑功能产生负面影响。
血管周围间隙(Perivascular spaces):血管周围间隙则像是大脑的 “垃圾清理站”,它围绕着脑血管,里面的免疫细胞可以调节脑脊液的流动,参与清除中枢神经系统的抗原、代谢产物和分子。在神经退行性疾病中,激活血管周围的 CAMs 能够降低致病性淀粉样蛋白 -β42 的水平,这为相关疾病的治疗提供了新的思路。
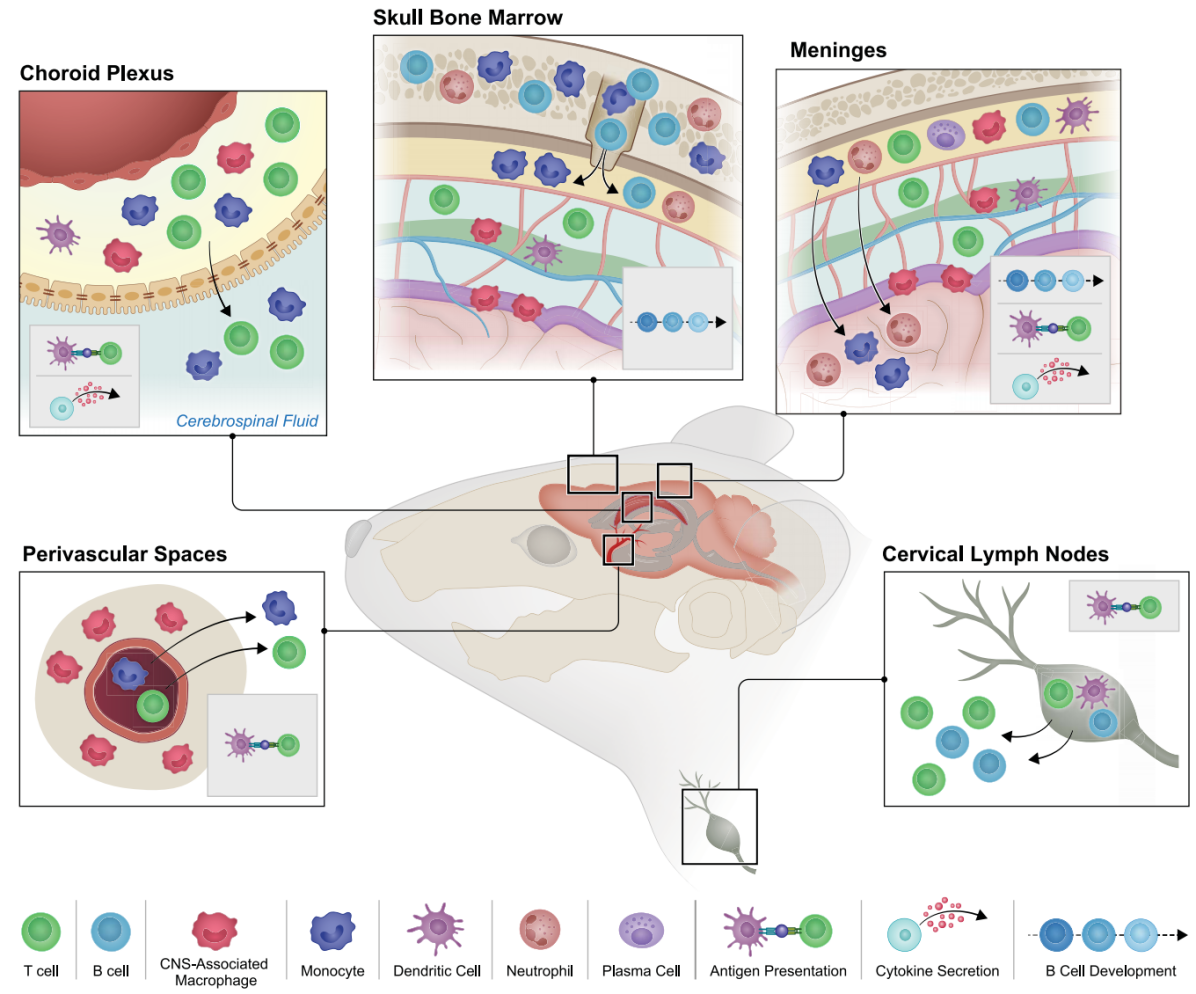
图3大脑边界以及连接外周与大脑的路径。该图展示了小鼠大脑内部及附近免疫细胞的分布情况,说明了在稳态下归巢到不同免疫微环境的细胞类型,这些免疫微环境包括血管周围间隙、脉络丛、颅骨骨髓、脑膜以及引流的颈淋巴结。图中还展示了在健康和疾病状态下,这些部位所发生的免疫过程:抗原呈递、细胞因子分泌和B细胞发育。箭头表示在各种病理条件下已被证实的、连接这些免疫微环境与大脑的主要路径。
颅骨骨髓(Skull BM):研究发现颅骨骨髓的免疫细胞可直接迁移至脑膜,脑脊液可影响颅骨骨髓的微环境和造血过程。在疾病状态下,如多发性硬化症,颅骨骨髓的免疫细胞变化可能参与疾病进展。颅骨骨髓是大脑免疫的重要组成部分,与大脑之间存在密切的细胞和体液交流,可能在大脑免疫反应和疾病发展中起重要作用。
颈淋巴结(CLNs):颈淋巴结通过脑膜淋巴系统引流大脑的细胞外液,是外周淋巴细胞接触大脑抗原的部位,可引发适应性免疫反应。在多种疾病和衰老过程中,颈淋巴结的功能变化会影响大脑的免疫状态和认知能力。研究发现,切除或结扎小鼠的颈淋巴结会导致其认知能力下降,这充分说明了颈淋巴结对大脑保护的重要性。
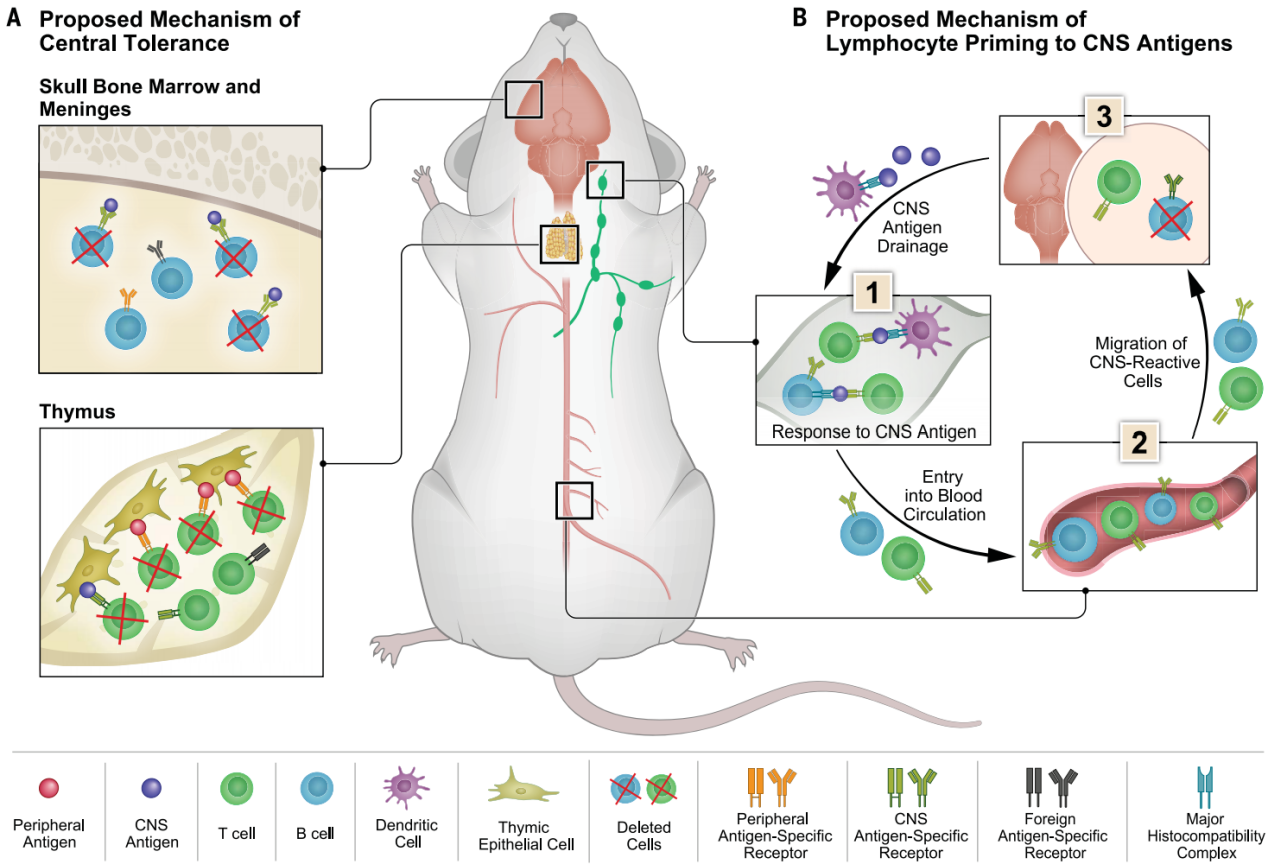
图4诱导免疫耐受、淋巴细胞分化以及中枢神经系统(CNS)反应性免疫细胞归巢至大脑边界的机制示意图。(A) 脑膜中源自颅骨骨髓的B细胞被清除,同时胸腺中高亲和力的潜在自身反应性T细胞也通过生物过程被清除。尽管高亲和力的自身反应性T细胞被排除在外,但低亲和力的自身反应性T淋巴细胞可能会从胸腺中逸出。(B) 该模型解释了CNS抗原引流至引流颈淋巴结(CLNs)并在其中呈递后的一系列事件(1);抗原引发免疫反应后(2),CNS反应性淋巴细胞进入血液循环,最终归巢至CNS边界(3)。
重新审视大脑免疫豁免的概念,指出新的研究发现挑战了传统观点。大脑依赖免疫系统的完整性,存在复杂的免疫网络,包括免疫细胞的募集、免疫微环境的调节等。大脑的免疫特权并非免疫隔离,而是能够精准调控免疫细胞的参与。大脑免疫豁免的概念需要重新定义,大脑与免疫系统之间存在复杂而精细的相互作用,这种认识为开发针对大脑疾病的免疫治疗策略提供了理论基础。
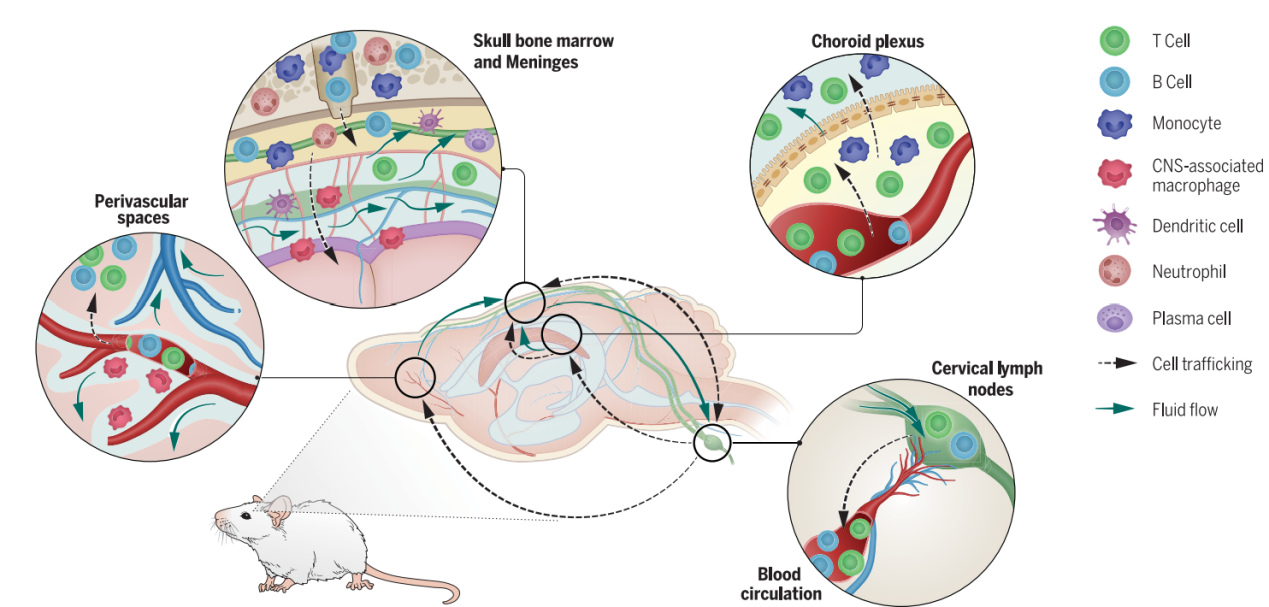
图5大脑免疫的新认知。此图展示了一个能够实现精细调节的大脑免疫监测的通讯网络。免疫细胞战略性地分布于免疫微环境中,在这些微环境里,它们持续接触由颅内间质液、脑脊液和淋巴液运输的中枢神经系统信号。一旦感知到大脑信号,免疫细胞便能够向中枢神经系统迁移,以发挥它们的效应功能。
大脑免疫失衡与衰老、自身免疫性疾病、神经退行性疾病和神经发育障碍等多种疾病相关。例如,在阿尔茨海默病、帕金森病等疾病中,免疫细胞的异常变化参与疾病进展。基于对大脑免疫的新认识,有望开发针对这些疾病的新治疗策略,如调节免疫细胞功能、改善免疫微环境等。大脑免疫失衡在多种疾病中起重要作用,深入理解大脑免疫机制可为疾病治疗提供新的靶点和策略。