LV (慢病毒(LV)的生产)
简介:
慢病毒的生产主要基于三质粒(核心质粒pLV-GOI/shRNA、辅助质粒psPAX2和pMD2G )共转染HEK293T细胞。其中核心质粒含有病毒的基本元件 5’LTR 和 3’LTR 以及外源目的基因。psPAX2质粒主要携带gag、pol、rev 基因,分别编码病毒主要的结构蛋白、特异性的酶以及调节 gag 和 pol 基因表达的调节因子。pMD2G 载体中含有vsvg 基因,为病毒包装提供所需要的包膜蛋白。
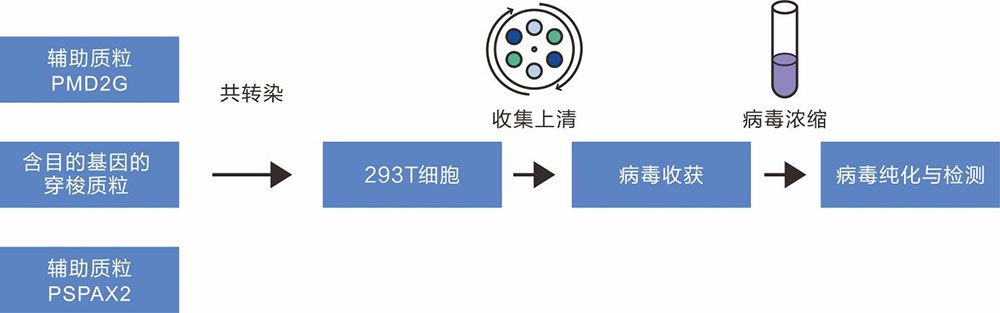
图1 慢病毒包装流程图
1 LV质粒构建
1)根据实验目的和受试细胞选择不同的rLV载体。一般通过简单酶切-连接-转化-测序的方式将目的基因克隆至LV表达载体,并验证载体表达功能。
2)为了获得高质量、高浓度且低内毒素含量的质粒,通过柱离心法及去内毒素试剂进行质粒DNA纯化。
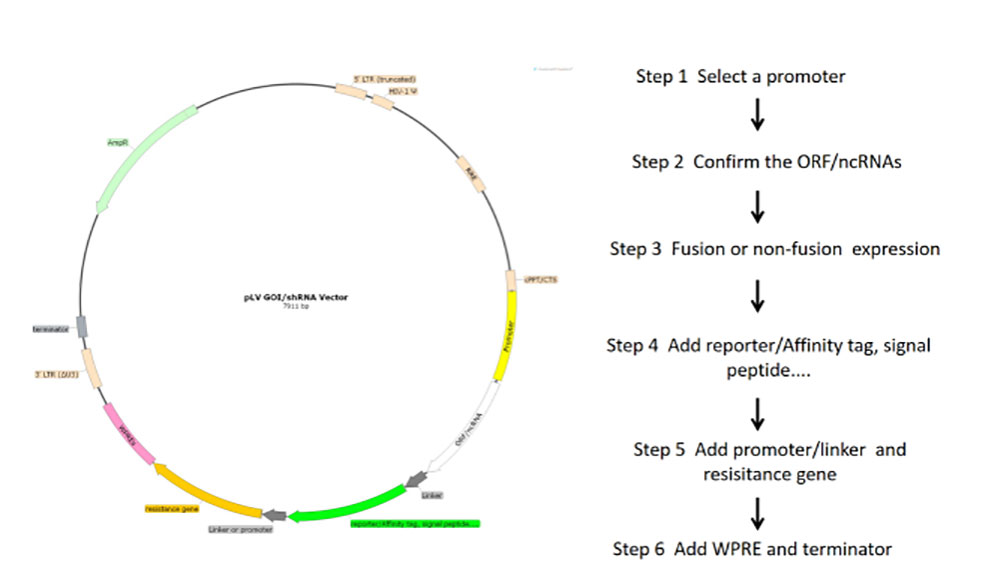
图2 慢病毒核心质粒构建流程图
2 病毒包装
1.细胞准备
从液氮灌中取出冻存细胞,迅速放入37℃水浴锅中复苏,离心后向细胞中加入新鲜培养基,37℃、5%CO2条件下培养,每2-3天进行细胞传代;待细胞生长正常后转入10cm的培养皿中贴壁培养备用。
2.质粒转染
当细胞密度达到约80~90 %的汇合率即可进行转染,将转染三质粒体系按一定比例配置后,使用转染试剂(PEI max)将质粒转染到准备好的293T细胞中,按照每皿1000μL体系进行转染及培养,转染6h后更换新鲜培养基。(转染条件参考PEI max转染试剂使用方法)
3.细胞培养
培养一天后,通过显微镜观察细胞转染情况。
4.病毒收毒及除杂
培养48hr后,收集病毒上清并更换新鲜培养基继续培养,72hr后收集病毒上清,0.45μm滤膜过滤。
5.病毒纯化及浓缩
将过滤后的病毒上清进行超速离心4℃,25000rpm,2.5h后,离心后弃去上清,利用病毒保存液重悬病毒沉淀,4℃溶解并放置过夜。
6.病毒收集
收集病毒液并进行分装。
二、慢病毒(LV)质量检测
腺相关病毒的质量主要包括滴度检测、纯度检测、无菌检测、支原体检测及内毒素检测。
1 滴度检测
慢病毒的滴度单位为TU/mL,指每毫升中含有的具有生物活性的病毒颗粒数,即感染并进入到靶细胞中的病毒基因组数。根据感染后目的基因的表达情况,可以换算单位体积中慢病毒的含量,即慢病毒的感染滴度。
- 1) 携带荧光标签的慢病毒滴度检测方法
a.细胞准备(day 1)
将293T细胞接种于96孔板,约3~5x104个目的细胞/孔,37℃、5%CO2条件下培养过夜,一般病毒感染时细胞的融合度约为70%左右为宜。- b.病毒稀释及感染(day 2)
利用细胞培养液将待检测慢病毒原液进行10倍梯度稀释,一般设置6~8组稀释度的病毒。可根据实验实际情况提高或者降低稀释倍数,调整病毒稀释组数。将稀释的病毒分别加入到准备好的293T细胞中孵育过夜,每个稀释度重复3个孔。
- c.更换培养液(day 3)
病毒感染24小时内更换新鲜培养液后继续培养。
- d.荧光计数及滴度计算(day 5)
通过显微镜观察孔内带有荧光的细胞数,每个稀释度样品重复3次,计算3个复孔带有荧光的细胞数的平均值。按照下列公式计算慢病毒滴度。假设A为倒数第二个可观察到荧光孔的荧光细胞平均值,B为倒数第一个可观察荧光孔的荧光细胞平均值。
滴度(TU/ml)=(A+10xB)x1000/2/A孔病毒量(uL)
检测标准:滴度≥1.0E+8 TU/mL
- 2) 无荧光标签的慢病毒滴度检测方法
a细胞准备(day 1)
将293T细胞接种于24孔板,约3~5x104个目的细胞孔,37℃、5%CO2条件下培养过夜,一般病毒感染时细胞的融合度约为70%左右为宜。- b病毒稀释及感染(day 2)
利用细胞培养液将待测慢病毒原液、已知TU的带荧光标签的慢病毒原液(实验对照组)分别进行10倍梯度稀释,一般设置3组稀释度的病毒。将稀释的病毒分别加入到准备好的293T细胞中孵育过夜,每个稀释度重复3个孔。
- c更换培养液(day 3)
病毒感染24小时内更换新鲜培养液后继续培养。
- d基因组DNA提取及滴度计算(day 5)
病毒感染72h后,收集细胞并进行基因组DNA的提取(可参考Takara基因组DNA提取试剂盒说明书)。利用特异性的引物进行荧光定量PCR实验,检测待测病毒样品的基因拷贝数,并利用对照组的基因拷贝数及TU值,换算无荧光标签的慢病毒滴度(TU/mL)值。每个样品重复3次,取3个复孔基因拷贝数平均值。按照下列公式计算慢病毒滴度。
滴度(TU/mL)=(待测样品基因拷贝数/对照组样品基因拷贝数)*对照组样品滴度
检测标准:滴度≥1.0E+8 TU/mL
2 无菌检测
- 检测方法:将病毒样品加入96孔板的293T细胞,37℃培养72h后,显微镜检测细菌和真菌的生长情况。
- 检测标准:培养基需澄清透明,细胞间隙无明显颗粒,无任何细菌及真菌污染。
3 支原体检测
- 检测方法:利用支原体16S rRNA基因的保守区设计引物,通过凝胶电泳和荧光定量检测病毒样品中有无支原体的污染。
- 检测标准:PCR胶图无条带。

